Il trattamento dei tumori stromali gastrointestinali
(GIST) dalla rivista scientifica CancerWorld, edizione maggio-giugno 2010
Traduzione in italiano a cura di A.I.G. Associazione Italiana GIST Olus
In questo numero, il Dott. Jean-Yves Blay del Centre
Léon Bérard, Lione, Francia, che è direttore della rete
di eccellenza CONTICANET e presidente della
EORTC, ripercorre le piu' comuni procedure per il
corretto trattamenti dei GIST. il Dott. Daniel Holblig,
del Onkozentrum Zurigo, Svizzera, gli pone domande
su alcuni temi.
L’intervista è redatta da Susan Mayor.
Una migliore comprensione delle diverse mutazioni geniche nei GIST sta
portando a nuovi paradigmi di trattamento personalizzato, in
particolare nella gestione della progressione.
di Susan Mayor
I Tumori stromali gastrointestinali (GIST) sono tumori rari, con un'incidenza di circa 10 nuovi casi
per milione di abitanti per anno, cioè 4.000-5.000 nuovi casi nell'Unione europea ogni anno.
Inizialmente si pensava che il GIST fosse un tumore estremamente raro, ma le migliorate
tecniche diagnostiche hanno rivelato che è un po' meno raro di quanto si credeva.
I GIST possono svilupparsi in tutti gli organi dell'apparato digerente: stomaco, intestino, il retto,
l'esofago e, in alcuni casi, il mesentere. Mutazioni possono verificarsi in diverse parti del gene
KIT, e questo può influenzare il sito dove il tumore si sviluppa. Per esempio, le mutazioni di KIT
esone 9 si verificano più spesso nei GIST del piccolo intestino. Mutazioni del recettore PDGFalfa (PDGFRα) si verificano più spesso in lesioni gastriche. Questo interessante parallelo tra
l'anatomia molecolare di questo tumore e la localizzazione dei GIST deve essere tenuto a mente,
perché potrebbe guidare il trattamento dei pazienti in futuro.
La maggior parte delle lesioni GIST presentano mutazioni di KIT, con la maggior parte presenti
nella regione della chinasi appena all'interno della membrana cellulare. Queste mutazioni hanno
conseguenze funzionali, tra cui un’attivazione costituzionale della chinasi, che può essere
bloccata da farmaci inibitori della tirosin-chinasi (TKI).
Più di recente, si è scoperto che un altro gene - PDGFRα - può essere mutato in questo tumore.
Ciò si verifica meno frequentemente che nelle mutazioni di KIT - circa il 5% nel contesto
metastatico, ma probabilmente il 20% nei tumori localizzati. I due geni (KIT e PDGFRα) si
escludono a vicenda.
LE MUTAZIONI CAMBIANO A SECONDA DELLA LOCALIZZAZIONE
L'impatto di imatinib nella cura
L'introduzione di imatinib (Glivec) nel trattamento dei GIST inoperabili o diffusi ha notevolmente
migliorato la cura dei pazienti, segnando il piu’ grande successo degli ultimi 20 anni di una terapia
oncologica in pazienti con tumori solidi. Imatinib ha migliorato significativamente il risultato della
terapia rispetto al trattamento precedente, con doxorubicina. Il forte aumento della
sopravvivenza globale ha portato all’approvazione di imatinib per i GIST, senza il requisito
normalmente necessario per un studio clinico randomizzato controllato.
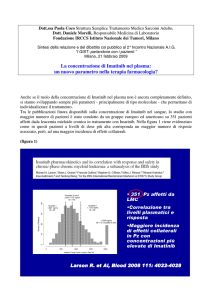
Risultati ottenuti da CONTIANET sull’osservazione di pazienti con GIST mostrano che la
mediana della sopravvivenza globale nei pazienti con GIST trattati con imatinib è di circa cinque
anni, mentre la mediana per la progressione di malattia di pazienti in trattamento è di circa 24
mesi. Questo è importante perché è la più lunga serie che abbiamo fino ad oggi sul trattamento
dei GIST, e comprende i pazienti da prima dell'era imatinib. Esso dimostra che imatinib è in
grado di migliorare non solo la sopravvivenza senza progressione, ma anche la sopravvivenza
globale, anche oltre il tempo di progressione della malattia. Questo è molto importante per la
strategia di trattamento per i GIST.
IMATINIB HA MIGLIORATO NOTEVOLMENTE LA CURA DEI GIST
Domanda: La curva non è piatta alla fine del grafico, significa che Glivec non è la cura definitiva
per i pazienti GIST?
Risposta: Non abbiamo una risposta certa a questa domanda. Non sappiamo se ci sarà un
appiattimento della curva, alla fine. Sappiamo che alcuni pazienti non hanno avuto alcuna
progressione di malattia anche dopo 10 anni di trattamento, il che è rassicurante, ma questa
proporzione di pazienti è relativamente piccola, circa il 25%. Tuttavia, questi dati raggruppano
casi di GIST con diverse mutazioni, e i risultati reali sono probabilmente diversi tra le mutazioni.
Lo sviluppo di un nuovo trattamento come Glivec, che è estremamente efficace nel migliorare la
vita di questi pazienti, ha portato ad una serie di paradigmi in continua evoluzione.
Paradigma 1
Raddoppiare la dose di imatinib per un paziente che ha progressione di malattia alla dose
standard di 400 mg
Il miglior trattamento per un paziente con metastasi da GIST, che sta registrando una
progressione di malattia mentre è in cura con 400 mg al gorno di imatinib è probabilmente quello
di raddoppiare la dose. Questo è, a mia conoscenza, l'unico esempio in oncologia di un
trattamento in cui la dose viene aumentata in caso di progressione di malattia. Questo approccio
è stato testato nello studio EORTC n° 62.005-S0033, che ha confrontato le due dosi di 400 mg e
800 mg in pazienti con GIST avanzato. Nello studio, ai pazienti in cura con la dose piu’ bassa
era data la possibilità di passare a 800 mg ai primi segni di progressione del tumore . I risultati
hanno mostrato che circa un terzo dei pazienti ha potuto ottenere il controllo della malattia
semplicemente raddoppiando il dosaggio di imatinib.
Indagini sulla farmacocinetica di Glivec hanno misurato il livello di imatinib nel plasma dopo un
mese di trattamento, mostrando che i pazienti nel quartile inferiore di esposizione ai farmaco
hanno avuto un tasso di risposta inferiore e un più alto rischio di progressione di quelli che si
trovavano negli altri tre quartili superiori (GD Demetri et al. 2008, ASCO cancri gastrointestinali
Simposio, astratto 3). Questo fa pensare che l'esposizione al farmaco (cioè la quantità di
farmaco nel plasma) è correlato al risultato. Ciò è già stato osservato nel trattamento della
leucemia mieloide cronica, che è l'altra malattia curabile con imatinib. C'è stata una tendenza ad
avere benefici clinici maggiori con esposizione a imatinib superiore (67% nel primo quartile vs
84% nel quarto quartile), con maggiori benefici clinici nei pazienti con la mutazione KIT esone 11,
che è particolarmente sensibile a imatinib (100% per il quarto quartile, P = 0.009).
Domanda: Questa è l'unica situazione in cui l’aumento della dose è raccomandata in una cura
oncologica. Forse perché la tolleranza del farmaco è buona?
Risposta: La tolleranza all’aumento della dose con imatinib è buona rispetto ai normali agenti
citotossici, ma non è sempre molto facile. Alcuni pazienti hanno difficoltà a mantenere gli 800 mg
al giorno.
Domanda: Per quanto tempo i pazienti beneficiano dell'aumento della dose?
Risposta: I dati sono molto variabili, ma tuttavia abbiamo alcuni pazienti che hanno stabilità di
malattia anche dopo diversi anni dall’aumento della dose. Questo è molto raro rispetto ad altri
trattamenti chemioterapici in altri tumori Alcuni pazienti hanno registrato controllo del tumore con
800 mg per più di due anni, dopo aver avuto progressione di malattia a 400 mg.. Ciò dimostra
che l'esposizione al farmaco è fondamentale per capire perché questi pazienti rispondono.
Paradigma 2
Non smettere mai il trattamento farmacologico nella fase avanzata
Per quanto tempo dobbiamo continuare a trattare con imatinib? Questa è una domanda
importante che i pazienti chiedono spesso dopo 3-4 anni di trattamento. Per affrontare tale
questione, lo studio francese BFR14 ha esaminato pazienti con GIST che hanno interrotto la cura
con Glivec dopo un anno di assunzione. I risultati hanno mostrato che questi pazienti hanno
avuto progressione dopo, mediamente, sei mesi. La buona notizia è che tutti i pazienti, a parte
uno che è deceduto per cause diverse, hanno riportato la malattia sotto controllo quando hanno
ricominciato a prendere Glivec. Ne è emerso che il trattamento con Imatinib per un anno non
elimina tutte le cellule tumorali, in quanto tutti i pazienti che hanno interrotto imatinib hanno avuto
una ripresa di malattia, anche se questo si è verificato dopo tre anni in un paziente.
Lo stesso studio clinico ha poi esaminato pazienti che hanno cessato la cura con imatinib dopo
tre anni, con lo stesso risultato. Anche in questo caso i pazienti hanno avuto progressione dopo,
mediamente, sei mesi e tutti i pazienti che hanno ricominciato la cura hanno riguadagnato
stabilità di malattia, il che è rassicurante.
L’aspetto preoccupante è che tutti i pazienti che hanno smesso la cura, sia dopo un anno sia
dopo tre anni, hanno avuto progressione di malattia dopo mediamente sei mesi, quindi dopo lo
stesso periodo di tempo di interruzione. Questo dimostra che Glivec ha bloccato la proliferazione
delle cellule malate, ma non le ha uccise nel periodo di tempo osservato. Quindi, dovremmo
probabilmente trattare con imatinib per più di tre anni. Stiamo ora completando lo studio che
esamina i pazienti che interrompono la cura dopo cinque anni ed avremo i risultati quest’anno.
UN ANNO DI CURA NON BASTA
Paradigma 3
La risposta alla cura farmacologia non sempre equivale alla riduzione del volume del
tumore
Questo concetto è una novità in campo clinico: noi medici siamo abituati a pensare che per
constatare una risposta alla terapia, abbiamo bisogno di vedere una riduzione del tumore nel
paziente oncologico, e che il tumore aumenta di volume quando si verifica la progressione.
Questo non è vero per il trattamento dei GIST con imatinib, e probabilmente non è vero anche
per altri farmaci mirati in altri tipi di tumore. “Risposta” non significa necessariamente riduzione
del volume del tumore, e la progressione non significa necessariamente un aumento di volume.
Una falsa progressione può essere notata in pazienti con GIST trattati con imatinib. La figura
sotto mostra le immagini della TAC di un paziente trattato nei primi giorni di imatinib. Dopo tre
mesi, sembrano esserci nuove lesioni. Invece, queste sono lesioni ipointense causate dal
trattamento, tipico di una falsa progressione. Viceversa, si può anche avere una falsa risposta.
Anche se il paziente ha una risposta in base a criteri RECIST, la malattia in realtà continua a
progredire. Dobbiamo essere consapevoli di questo, come si dovrebbe probabilmente essere
pronti a cambiare la nostra pratica negli anni a venire.
UN CASO DI FALSA PROGRESSIONE NELLA TAC
Dobbiamo partire dal presupposto che la TAC è lo standard. E 'anche importante ascoltare il
paziente. Se un paziente ha una risposta parziale, ma avverte sensazione di malessere,
dobbiamo sospettare che si stia verificando eventualmente una progressione parziale o limitata.
D'altra parte, se nonostante l'aumento del volume del tumore alla TAC, i pazienti riferiscono di
sentirsi bene e non hanno più dolore, questa potrebbe essere una falsa progressione. In tal
caso, è importante approfondire.
Domanda: Se hai un paziente che sta facendo clinicamente meglio, ma si vede nella TAC che la
lesione è in aumento, tu continui con lo stesso trattamento o ti insospettisci?
Risposta: dipende dal livello di sospetto. Uno degli aspetti che è molto importante tenere in
considerazione è la densità del tumore, misurato in unità Hounsfield. La maggior parte delle
lesioni in risposta farmacologia, diminuisce le unità Hounsfield. Se ci basiamo sui criteri di Choi
possiamo distinguere tra risposta e non-risposta nei GIST: è molto condiviso che le lesioni
“ipointense” stanno rispondendo alla cura. Per quanto riguarda il trattamento, sì, si potrebbe
continuare. Se avessi dei dubbi, probabilmente prescriverei una PET. Se non avessi dubbi,
vorrei semplicemente vedere il paziente di nuovo entro sei settimane con una nuova TAC e la
valutazione clinica, invece dei soliti tre mesi di follow-up.
Domanda: Quindi tu non ordini la PET subito, la riservi per approfondire i casi di incertezza?
Risposta: Esatto. C'è un'altra indicazione per la PET nelle linee guida ESMO, ed è quando si
avvia una terapia neo-adiuvante in tumori voluminosi prima dell’intervento chirurgico. Si fa la
PET in questi casi per assicurarsi che il tumore stia reagendo rapidamente e non sia un GIST con
resistenza primaria, che è rara - solo 5%.
Paradigma 4
Comprendere la biologia molecolare del GIST è importante per il trattamento di routine del
paziente
La biologia molecolare è una questione molto importante. Esistono diversi tipi di mutazione, con
diversi siti di mutazione di KIT: per esempio, esone 9 ed esone 11. Una meta-analisi di due studi
importanti - lo studio S0033 negli Stati Uniti e gli studi EORTC 62.005 in Europa (1640 pazienti) -
ha mostrato in modo significativo il diverso risultato di pazienti con esone 9 trattati con 400 mg di
imatinib (vedi sotto, linea blu) rispetto a quelli trattati con 800 mg (linea verde).
Questo non si verifica nell’ esone 11 (linee rosso e giallo). E’ importante conoscere la mutazione
primaria di un paziente perché abbiamo bisogno di raddoppiare la dose di imatinib in un paziente
con mutazione dell’esone 9. Questa strategia è raccomandata dalle linee guida ESMO in Europa
e NCCN negli Stati Uniti.
Quindi la dose standard per l’esone 9 è 800 mg al giorno e questo significa che abbiamo bisogno
di informazioni sulla mutazione primaria del paziente nel contesto metastatico. Ciò non è facile
perché le informazioni sul tipo di mutazione sono disponibile in meno del 50% dei pazienti, e il
test per l’esame delle mutazioni non è disponibile ovunque. L’esame delle mutazioni richiede
una tecnologia complessa, ma questo è il modo giusto di andare avanti.
LA MUTAZIONE E’ PREDITTIVA DELLA RISPOSTA
Domanda: E’ necessario fare l’esame delle mutazioni per trovare l’esone 9 o anche per
conoscere le altre mutazioni?
Risposta: Certamente è necessario per l’esone 9 e anche per le altre mutazioni. Abbiamo il
sospetto che diverse mutazioni di PDGFRα o l’esone 11 possano anche essere associate a
prognosi diverse e siamo in attesa di dati su questo all'ASCO quest'anno.
Quale strategia dovrebbe essere adottata nella malattia in progressione?
Ci sono diverse cose che dovremmo fare se un paziente progredisce.
Controllare l'aderenza alla terapia
La prima cosa da verificare è se una progressione è legata al non-rispetto della cura con imatinib.
Negli USA uno studio sul numero di confezioni di imatinib acquistatie dai pazienti ha mostrato che
questo era solo il 75% di quanto previsto, il che indica che l'aderenza è, nella migliore delle
ipotesi, di tre quarti. Questo non va bene e sappiamo che l'esposizione a imatinib è correlata al
risultato. Non è semplice prendere una pillola ogni giorno per il resto della tua vita. Dobbiamo
cercare di migliorare l'aderenza del paziente, e noi dobbiamo prestare ascolto alle esperienze di
altre malattie, come l'HIV, dove l'aderenza al trattamento a lungo termine è stato studiato
estensivamente.
Controllare l'esposizione
I livelli di imatinib nel plasma sono importanti, come accennato in precedenza.
Considerare la chirurgia
Il trattamento chirurgico è molto interessante, ma ancora sperimentale. Un piccolo studio
condotto da CP Raut e collaboratori ha evidenziato che pazienti in terapia con imatinib, operati
mentre avevano una progressione limitata, hanno avuto risultati migliori di quelli operati mentre
erano in progressione generalizzata. Lo studio ha anche mostrato che i pazienti operati con
malattia stabile sono quelli che hanno avuto i risultati migliori di tutti (JCO 2006 , 24:2325-2331).
Questo è interessante, ma non è ancora dimostrato che la chirurgia sia superiore al trattamento
con sunitinib.
Abbiamo iniziato uno studio randomizzato dove osserviamo due gruppi di pazienti: un gruppo di
pazienti che affronta la chirurgia mentre è in risposta a imatinib (il momento di miglior risposta è
entro un anno dall'inizio della cura) e un altro gruppo di pazienti in risposta alla terapia che
continua con imatinib e affronta la chirurgia solo al momento della progressione di malattia. Si
tratta di uno studio molto importante, ma molto difficile.
Passare a un altro farmaco
Sunitinib ha un più ampio spettro di attività in termini di inibizione della chinasi che imatinib, così
ci aspettiamo che esso possa avere un effetto aggiuntivo. Questo effetto aggiuntivo è stato
dimostrato in uno studio sunitinib contro placebo in pazienti resistenti a imatinib, mostrando
risultati migliori (P. Casali et al. ASCO 2006, astratto 9.513; IR Judson et al ESMO 2006, abstract
506). Alcuni potrebbero sostenere che il placebo non era il braccio di controllo adeguato, ma
tuttavia lo studio è stato molto importante perché ha dimostrato l'attività di sunitinib.
I risultati che si ottengono con sunitinib nei pazienti con mutazioni dell'esone 9 sono diversi
rispetto ad altre mutazioni. Nella ricaduta, i pazienti con esone 9 e wild type sembrano avere un
risultato migliore con sunitinib (mentre questi due tipi di GIST hanno risultati limitati con imatinib).
Questo però non significa che sunitinib non sia attivo anche nell'esone 11.
Al momento della progressione, abbiamo osservato la comparsa di cloni resistenti che sono
associati a mutazioni secondarie della chinasi. Queste mutazioni codificano per una proteina che
è resistente a imatinib e/o sunitinib. Queste mutazioni secondarie si trovano sugli esoni 13, 14,
17 e 18 della stessa chinasi. Vi è un elevato livello di eterogeneità in questi tumori - con
mutazione dell'esone 13 e 14 in una regione, e la mutazione di 17 in un'altra.. Si tratta di un
livello di complessità che non è stato affrontato in precedenza e che noi non sappiamo ancora
come gestire esattamente, ma che deve essere studiato visto che i risultati delle terapie variano a
seconda della natura della mutazione secondaria.
MUTAZIONI SECONDARIE CON LA PROGRESSIONE
I GIST iniziano con una sola mutazione primaria, ma mutazioni secondarie si possono sviluppare dopo
trattamento con Imatinib e/o Sunitinib. Dobbiamo imparare a come meglio gestire la malattia in queste
circostanze.
Fonte: CT scan: courtesy of JY Blay, Centre Léon Bérard, Lyon
Purtroppo, molti pazienti hanno progressione di malattia anche con sunitinib, quindi qual è il
passo successivo? Ci sono altri farmaci e altre strategie. Nilotinib (Tasigna) è un TKI (Inibitore di
Tirosin-Chinasi) che blocca la BCR-ABL. E 'stato testato in una fase I / II in pazienti con GIST
resistente. Il risultato dei pazienti trattati con una combinazione di imatinib e nilotinib, oppure con
nilotinib come agente singolo per i pazienti intolleranti, ha mostrato efficacia in termini di controllo
del tumore, valutato in base alla risposta completa (RC), oppure alla risposta parziale (RP),
oppure ad una stabilizzazione della malattia. Il risultato di Nilotinib è stato simile a quello dei
pazienti trattati con sunitinib in seconda linea.
Nilotinib è davvero utile? Questo è stato l'oggetto di uno studio clinico dove si è confrontato
nilotinib contro la migliore terapia di supporto, imatinib o sunitinib. I risultati saranno presentati
all'ASCO 2010. Questo è stato uno studio molto interessante, ma è stato complesso da
realizzare. I risultati nel corso del 2010 mostreranno se nilotinib è un agente attivo.
Domanda: dopo aver preso imatinib e sunitinib, i pazienti rispondono ancora se ricominciano ad
assumere imatinib?
Risposta: Sì, questo avviene nella terza, quarta, quinta e sesta linea di terapia. Quando diciamo
“risposta” non sempre significa riduzione del tumore, ma può essere stabilità e beneficio clinico
per il paziente.
Un quarto agente, sorafenib (Nexavar), è stato testato in fase II per i pazienti che non avevano
risposto a imatinib e sunitinib. Ha dimostrato un controllo della malattia in circa due-terzi dei
pazienti. Questo inibitore della chinasi ha un profilo simile al sunitinib, e ha una certa attività
nella terza o quarta linea di terapia in pazienti con GIST resistenti a imatinib e sunitinib (HS
Nimeiri et al. ASCO cancri gastrointestinali Symposium 2008, abstract 7). Purtroppo, non vi sarà
alcuno studio clinico prospettico da parte della società farmaceutica produttice (Bayer, ndr), ma
potremmo cercare di studiare questo nel contesto accademico.
Il quinto farmaco che è stato studiato è l'inibitore IPI 504 della proteina heat shock 90 (HSB90).
Uno studio di fase I ha mostrato un certo livello di controllo del tumore in una parte significativa di
pazienti con GIST. Sulla base di questo, l'inibitore HSB90 è stato testato in uno studio clinico di
fase III, ma purtroppo questo è stato interrotto a causa di tossicità inattesa. Tuttavia questa è
sicuramente una strategia che deve essere ulteriormente studiata.
Un altro percorso che è cruciale per superare il problema della resistenza è l'inibizione di mTOR.
Uno studio sta esaminando la combinazione di imatinib, sunitinib e sorafenib con RAD 001 everolimus – che ha mostrato un prolungato controllo della malattia in alcuni pazienti. Circa il
20% dei pazienti ha avuto grande beneficio dal trattamento. Questi dati sono stati presentati
all'ASCO 2008, ma non sono ancora stati pubblicati. La combinazione non è ancora standard,
ma deve essere ulteriormente studiata.
La figura sottostante mostra uno dei miei pazienti con una metastasi al fegato molto voluminosa,
che era progredita dopo trattamento con 800 mg di imatinib al giorno. Il paziente è stato incluso
nello studio RAD 001, ha potuto essere operato dopo il trattamento con everolimus e sta ancora
bene più di tre anni dopo l'operazione. Questo paziente non sarebbe stato operato senza questo
trattamento.
IL RUOLO DELL’INIBITORE DI mTOR
Questo paziente GIST, resistente a imatinib, aveva una metastasi al fegato molto voluminosa che ha potuto
essere rimossa dopo trattamento con terapia Everolimus, che è un inibitore di mTOR
Fonte: Pierre Meeus, Centre Léon Bérard, Lyon
Paradigma 5
Continuare la terapia anche in caso di progressione
Come rispondere alla progressione di un tumore in trattamento farmacologico è ancora un
paradigma in evoluzione. Non ci sono altre situazioni in oncologia dove si continua un
trattamento che ha dimostrato di essere diventato inattivo. Tuttavia, in questo caso, il criterio per
fare proprio questo è che imatinib continua ad avere una certa efficacia. La seconda questione è
la resistenza focale, cioè localizzata e non generalizzata, dove la maggioranza di cloni cellulari
rimangono sensibili al farmaco, quindi non è logico interrompere un trattamento che è ancora
attivo in un gran numero di cloni. Quindi continuare la terapia è probabilmente molto logico.
Che dire della terapia adiuvante? La questione è stata affrontata nello studio ACOSOG Z9000 di
fase II. Il trattamento con imatinib dopo l'intervento chirurgico completo e in assenza di malattia
visibile ha mostrato dei vantaggii. La fase III dello studio ACOSOG Z9001 ha dimostrato che un
anno di trattamento con imatinib adiuvante ha notevolmente ridotto il rischio di progressione
durante e dopo questo periodo di tempo.
Tuttavia c'è il sospetto che un anno di trattamento non sia sufficiente. Questo deve essere
ulteriormente studiato, ma il messaggio fondamentale è che noi non sappiamo ancora per quanto
tempo dovremmo trattare in adiuvante. Uno studio scandinavo, SSG / AIO, sta esaminando i
pazienti trattati in terapia adiuvante ad un anno rispetto a tre anni, mentre lo studio clinico
EORTC (62.024) sta ossservando i due anni di trattamento. I risultati saranno disponibili nel
2011.
Le domande sulla terapia adiuvante che rimangono aperte sono:
Chi dovremmo trattare?
Quale livello di rischio trattare?
Per che durata?
Che tipo di mutazione?
Qual è l'impatto sulla resistenza secondaria?
Quale sarà l'impatto sulla sopravvivenza globale?
Conclusioni
Chirurgia e terapia imatinib adiuvante possono essere considerati trattamenti standard nei GIST
localizzati, ma molte domande rimangono sul trattamento adiuvante. Il trattamento di prima
linea imatinib è l'unico standard a 400 mg al giorno, eccetto l'esone 9 che va trattato con 800 mg
al giorno. Dobbiamo continuare il trattamento fino alla progressione di malattia o intolleranza,
perché i pazienti andranno in recidiva se il trattamento viene interrotto. La biologia molecolare
sta diventando sempre più importante per la prognosi e la scelta del trattamento.
La valutazione della risposta ad imatinib non è semplice, e può essere determinata adottando i
criteri RECIST, quelli di WHO e i criteri di Choi. Tuttavia, sappiamo che ci sono false
progressioni e false risposte. Dobbiamo prendere in condiderazione non solo la riduzione di
volume, ma anche la densità e la stabilizzazione prolungata della malattia come criteri utili. La
chirurgia non è un beneficio ancora dimostrato in fase metastatica, deve essere ancora ben
studiata e incoraggio tutti i pazienti con le caratteristiche adatte a partecipare alla
sperimentazione EORTC (o studio SURGIST, ndr*). L'ultima questione è se si debba continuare
il trattamento in pazienti che hanno progressione nel corso delle terapie precedenti. Il parere
degli esperti di ESMO e di NCCN è che dovremmo continuare il trattamento almeno per il
controllo dei cloni sensibili della malattia..
(*) Informazioni sullo studio SURGIST nel nostro sito ai seguenti links:
http://www.gistonline.it/default.aspx?c=9&s=62&t=2
http://www.gistonline.it/default.aspx?c=21&s=89&t=2
§§§