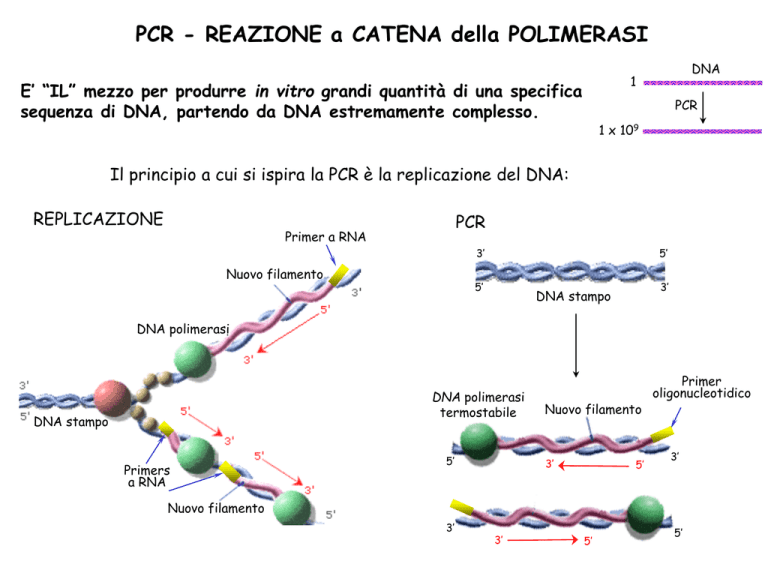
PCR - REAZIONE a CATENA della POLIMERASI
DNA
1
E’ “IL” mezzo per produrre in vitro grandi quantità di una specifica
sequenza di DNA, partendo da DNA estremamente complesso.
PCR
1 x 109
Il principio a cui si ispira la PCR è la replicazione del DNA:
REPLICAZIONE
PCR
Primer a RNA
3’
Nuovo filamento
5’
5’
3’
DNA stampo
DNA polimerasi
DNA polimerasi
termostabile
DNA stampo
Primers
a RNA
5’
Nuovo filamento
3’
5’
Primer
oligonucleotidico
3’
Nuovo filamento
3’
3’
5’
5’
Le FASI della PCR
DENATURAZIONE:
Il DNA viene denaturato mediante
riscaldamento in provetta a ~ 92-95°C
Denaturazione
(~ 95°C)
Allungamento
(~ 70°C)
ANNEALING:
La miscela viene raffreddata fino a
raggiungere la temperatura che garantisce
la specifica ibridazione dei primers alle
regioni dello stampo ad essi complementari
Annealing
(~ 60°C)
ALLUNGAMENTO:
La temperatura della miscela viene portata a 68-72°C consentendo
alla DNA polimerasi termostabile di sintetizzare il filamento
complementare allo stampo a partire dall’innesco oligonucleotidico
PCR
I°step
regione di interesse
5’
3’
5’
3’
III°step
i filamenti vengono separati
ed i primers si appaiano
5’
3’
primer 1
primer 2
3’
complementarietà
al primer 1
5’
3’
3’
5’
5’
i primers si estendono
5’
3’
complementarietà
al primer 2
II°step
i filamenti vengono separati
ed i primers si appaiano
complementarietà
al primer 1
3’
5’
i filamenti vengono separati
ed i primers si appaiano
3’
5’
5’
3’
i primers si estendono
3’
complementarietà
al primer 2
i primers si estendono
5’
3’
3’
5’
5’
3’
3’
5’
Frammenti desiderati
(quelli di lunghezza variabile non sono mostrati)
5’
filamenti di
lunghezza variabile
5’
filamenti di
lunghezza omogenea
3’
E così via
I primi 4 cicli della PCR in dettaglio
2° ciclo
Frammento desiderato
3° ciclo
4° ciclo
Amplificazione
esponenziale
1° ciclo
35° ciclo
DNA stampo
Numero di copie di DNA
contenenti il frammento
desiderato
21 = 2
22 = 4
23 = 8
24 = 16
Numero di copie di DNA
della corretta lunghezza
contenenti il frammento
desiderato
0
0
2
8
235
PROGETTAZIONE dei PRIMERS
Lunghezza: 16 bp o più
Caratteristiche di un buon primer:
Una sequenza di 16 bp sarà statisticamente presente solo una volta ogni 416 bp
(~ 4 miliardi di basi) corrispondenti circa alla grandezza del genoma umano.
Tm primer 1
~
Tm primer 2
La Tm dipende dalla lunghezza e dalla sequenza del primers
Tm = 4(G+C)+2(A+T)°C
T annealing
~ 2-5°C al di sotto della più bassa Tm dei due primers usati
Se la Ta dei due primers è molto diversa si possono verificare amplificazioni
asimmetriche o a singolo filamento.
Assenza di sequenze ripetute invertite che possano far ripiegare il
primers su se stesso o di sequenze complementari fra i primers che
causano l’amplificazione di dimeri dei primers
rev
for
PROGETTAZIONE “COMPUTERIZZATA” dei PRIMERS
rev
3314
842
425
Primer FOR
Primability of Match = 100%
Stability of Match = 82%
5’- GGACACGTATGCCACAGCCC
TGCTAAATTTTCCAGCTAGGTAGCAGGACACGTATGCCACAGCCCTTAAAAGCATATCTGCACATGTCTT
1442
Primer REV
Primability of Match = 100%
Stability of Match = 81%
2264
1461
2281
CATGCATGATGCTCAAATGCCGCATTGTTGCGCTGTACGCACACATGTATGAATGCATGGCACGGATCAA
3’-
Primer REV
Primability of Match = 71%
Stability of Match = 44%
-3’
-5’
GTTGCGCTGTACGCACAC
5’-
-3’
GTGTGCGTACAGCGCAAC
GGGTGGGACCTGGGCGCCCCCGCCGTGAGCGCCTACTGCTCCACCTGGGACGCCGGCAAGCCGTACTCG
1859
...PROGETTAZIONE “COMPUTERIZZATA” dei PRIMERS
5’ TGTTACAAGTGTGGATGGATGCC
5’ CTTTTGGCATAGACCACATGCCA
Tm = 56.1
Tm = 58.6
GGCCAGTGAATTCAGCTCACGCCCCAAATATGCAGCTTCCAGTCCAGTTTCATCCGGCGCGCTGAAGAT
TTTTTAGAGCATGCTCTATTATGCAGCGTCCGTTGGAATGCTCTTTTTAACTCCGCGCGCGCTAAACTT
GCGATTTTTTGGGCGCGGCGCTGATATTGGGCGTCTGTTGAAGATGCTCTTAAGTGGCCACAAGGGAGA
TGGGTCGGGCTAAGGTTTCATATCTTACAATATAAAGTTGAAGACGATTTGTGGCACCCAGGGGCGGGA
GACGCATGCATGCAGCTGCATGATTGCACCAAGATCCGAAGAGTGGTTTATGGTTTGAGCTTAATTACT
GCATGCATGCAACTTTTTGGTACAACTTTTGGCATAGACCACATGCCATCCCACCTCCCATGCTTTTCA
TTTTTACTTGTAAATTTGGATCTATTATATCTTTTGAATCAAAAGTTCAATTTATATTTCGTTTGCGTA
TTCTTGTCCCTTGTGTCGAGAGCTTTGAAACAAGCCCACTTTTGAATACGTTTTGACAAATTCTAAAAA
CTTAAGTGAGTTTCAACTGCTAAAACTTGATAGAATGAATGAAAAATTTAGCAAGTTTCAAAGACTAAA
ACTGAAACCCTAAGCCCTTAGCCCTAGATCCTAAGCCCTAAGCCGGAAGTCCTAAACCGTATGCCCCTA
ACA
Tm = 83.6
?
Clear
Open file
Calculate
Minimum stem size: 4
Minimum 3’ overlap: 2
Optimal annealing temperature is 56.7. 3’ end of oligo 1 pairs to positions 5 to 10
of itself.
COMPONENTI di una REAZIONE di PCR
Mg2+
Stampo
DNA a doppio filamento
Primers
Oligonucleotidi complementari a regioni dei filamenti
opposti che fiancheggiano la sequenza DNA bersaglio
Deossiribonucleotidi trifosfati
Tampone contenente
cloruro di magnesio
Enzima
Miscela equimolare di dATP,
dTTP, dGTP, dCTP
Lo ione Mg2+ è essenziale per il
funzionamento dell’enzima
Tradizionalmente viene usata la Taq polimerasi, enzima
termostabile estratto dal batterio termofilo Thermus
aquaticus
I FATTORI CRITICI della PCR
…nella miscela di reazione
Non utilizzare quantità eccessive di stampo, primers e/o dNTP
al fine di evitare amplificazioni non specifiche.
Dosare accuratamente la [Mg2+] in funzione della quantità di stampo,
primers e dNTP utilizzata
Mg2+ è indispensabile al funzionamento della Taq polimerasi, ma
è chelato da stampo, primers e dNTP.
Se in eccesso causa una perdita di fedeltà da parte dell’enzima.
Selezionare l’enzima più idoneo alle proprie necessità
Emivita alla temperatura di denaturazione
Processività
Capacità di correzione degli errori
Taq,
Pfu...
I FATTORI CRITICI della PCR
…nella programmazione
94°C
1’
TEMPERATURA e TEMPO
di DENATURAZIONE
91-97°C a seconda della complessità dello stampo
Emivita Taq polimerasi: 30 min a 95°C
~
30 cicli di denaturazione di 1 min
Quindi, se:
TDEN › 95°C o N. cicli › 30
Diminuire il tempo di denaturazione/ciclo
TEMPERATURA e TEMPO
di ANNEALING
Dipende da [stampo]iniziale
TANN troppo bassa
TANN troppo alta
~
il tempo
Allungare
di annealing
25-30 cicli
50 molecole iniziali
TMELTING
o
primers lunghi
TANN
60°C
30’’
3x105 molecole iniziali
amplificazione aspecifica
amplificazione con bassa resa
NUMERO di CICLI
40-45 cicli
TEMPERATURA e TEMPO
di ALLUNGAMENTO
72°C
1’
TEMPERATURA: 68-72°C a seconda dell’enzima
TEMPO: 1min / Kb di amplificato
ALLUNGAMENTO FINALE di 7-10 min per completare
la sintesi degli eventuali prodotti parziali
N.B. Dopo 30-35 cicli:
- l’attività dell’enzima
si riduce
- primers e dNTP si
esauriscono
STRATEGIE per AUMENTARE la SPECIFICITA’
PCR CLASSICA
Den.
iniziale
94°C
3-5 min
Den.
30 sec
94°C
Ann.
30 sec
Tm(-5°C)
All.
1 min/Kb
72°C
TOUCHDOWN PCR
Mantenimento
7 min
72°C
4°C
3-5 min
Den.
30 sec
Ann.
30 sec
30
cicli
All.
1 min/Kb
1
ciclo
94°C
1
ciclo
All.
finale
Den.
iniziale
1
ciclo
94°C
Tm(+5°C) -1°C/ciclo
72°C
10
cicli
Den.
30 sec
94°C
Ann.
30 sec
Tm(-5°C)
All.
1 min/Kb
72°C
All.
finale
7 min
Mantenimento
72°C
4°C
20
cicli
1
ciclo
...STRATEGIE per AUMENTARE la SPECIFICITA’
HOT START
Perché realizzare una PCR “hot start”?
Durante l’allestimento della reazione di PCR o
durante il riscaldamento iniziale del campione si
possono verificare situazioni di appaiamento non
specifico fra primers e stampo.
Fra 40 e 50°C la Taq polimerasi ha un’efficiente
attività polimerasica e può estendere i primers
non correttamente appaiati.
NESTED PRIMER PCR
Procedura:
L’amplificazione è realizzata con
un set di primers
Il prodotto è riamplificato con un set
di primers interni ai precedenti
Ia PCR
5’
3’
3’
5’
3’
5’
3’
5’
La PCR “hot start” previene la formazione di
questi prodotti non specifici in quanto un
componente chiave della miscela di reazione
(enzima o MgCl2) viene aggiunto dopo lo step
di denaturazione iniziale.
IIa PCR
3’
pr. nested
5’
pr. nested
3’
5’
5’
3’
NOVITA’:
Enzimi “Hot start”
Gocce di cera
3’
5’
I prodotti non specifici amplificati nella
Ia PCR non saranno amplificati nella IIa
CLONAGGIO dei PRODOTTI di PCR
La Taq e altre polimerasi hanno un’attività
trasferasi-terminale che conduce all’aggiunta di
un singolo nucleotide all’estremità 3’ dei
prodotti di PCR.
Siti di clonaggio
multiplo
T
T
In presenza dei 4 dNTPs è preferenzialmente
aggiunto dA.
5’
3’-A
A-3’
r
5’
I prodotti di PCR possono quindi essere agevolmente clonati in plasmidi
aperti che contengono un deossitimidin nucleoside (dT) alle estremità 5’.
APPLICAZIONI della PCR
PCR
Produzione di sonde oligonucleotidiche
PCR
PCR
Clonaggio e manipolazione dei geni
PCR
PCR
PCR
PCR
PCR
PCR
PCR
Mutagenesi casuale o sito-specifica
Tipizzazione dei geni e del DNA:
-caratterizzazione di ricombinanti batterici
-diagnosi cliniche
-analisi di campioni biologici in medicina legale
CLONAGGIO e MANIPOLAZIONE di GENI
STRATEGIA
Caso 1:
Caso 2:
Sequenza genica nota
Sequenza genica omologa nota
o
sequenza proteica nota
Si disegna un primer specifico
Si disegna un primer degenerato
Si amplifica il gene desiderato direttamente
dal DNA genomico o dall’’RNA
N.B.
I primers possono essere disegnati in maniera
tale da contenere al 5’ la sequenza di specifici
siti di restrizione che possono essere sfruttati
per l’inserimento dei prodotti di PCR nei vettori
di clonaggio.
5’-TCGAATTCNCCYAAYTGNCC-3’
EcoRI
Primers degenerati
Presentano varie opzioni a certe posizioni
della sequenza rendendo possibile l’annealing
e l’amplificazione di sequenze omologhe da
organismi differenti
R = A, G
Y = C, T
W = A,T
M = A,C
K = G, T
S = C, G
H = A, C, T
B = C, G, T
V = A, C, G
D = A, G, T
N o I= A, C, G, T
5’ - RACE Rapid Amplification Complementary Ends
mRNA 7-mG
AAAAA-3’
Sintesi primo filamento cDNA
Trascrittasi inversa
+ GSP1
7-mG
GSP1
Aggiunta coda omopolimera
al primo filamento cDNA
GSP1 5’
P
TTTT
P
TTTTT
3’
TTTTT
GSP1’ 3’
3’
P
TTTTT
P’
AAAAA
GSP1 5’
complementarietà
al primer GSP1
GSP1 5’
I° gruppo di amplificazioni
5’
P
GSP2
P
TTTTT
3’-AAAAAAAAA
5’
Trasferasi terminale
+ dATP
3’-AAAAAAAAA
Sintesi secondo filamento cDNA
AAAAA-3’
II° gruppo di amplificazioni
GSP1’ 3’
GSP1 5’
complementarietà
al primer P(dT)
5’
P
TTTTT
GSP1’ 3’
3’
P’
AAAAA
GSP1 5’
5’
P
TTTTT
GSP2’ 3’
3’
P’
AAAAA
GSP2 5’
Prodotto PCR finale
3’ - RACE Rapid Amplification Complementary Ends
mRNA
7-mG
AAAAAAAA-3’
Sintesi primo filamento cDNA
Trascrittasi inversa
+ P(dT)
7-mG
AAAAAAAA-3’
TTTTT
Sintesi secondo filamento cDNA
GSP1
P
complementarietà
al primer P(dT)
GSP1
3’
TTTTT
complementarietà
al primer GSP1
P
5’
I° gruppo di amplificazioni
5’ GSP1
AAAAA
P’
3’
3’ GSP1’
TTTTT
P
5’
II° gruppo di amplificazioni
3’ GSP1’
GSP2
5’ GSP1
TTTTT
P
TTTTT
P
AAAAA
P’
5’
3’
5’ GSP2
AAAAA
P’
3’
3’ GSP2’
TTTTT
P
5’
Prodotto PCR finale
MUTAGENESI CASUALE
?
In che modo delle mutazioni nel gene influenzano la funzione del prodotto?
R
EROR PRONE PCR
PREMESSA:
La frequenza di errore delle DNA polimerasi è
grazie ad un’attività corretrice 3’
~
allo 0,001 ‰ (una base ogni 106 nucleotidi)
5’ che rimuove i nucleotidi male incorporati.
E’ possibile indurre l’aumento di errori nella PCR utilizzando:
Taq polimerasi prive di attività correttrice
Basse temperature di annealing che diminuiscono la fedeltà
Ineguali concentrazioni dei dNTP
Elevate concentrazioni di MgCl2
Alto numero di cicli (60-80)
Amplificazioni successive del prodotto di PCR
MUTAGENESI SITO-SPECIFICA
LEGENDA
sequenza bersaglio
1
primer con differenza
di un solo nucleotide
4
nucleotide originale
PCR
2
PCR
Filamento 4
Filamento 1
Filamento 2
Denaturazione,
rinaturazione
Filamento 1
Filamento 3
nucleotide cambiato
3
DNA lineare amplificato
Filamento 3
DNA plasmidico
circolare con incisure
e nucleotide cambiato
Filamento 4
Trasformazione di
E. coli
Filamento 2
REAL-TIME PCR
Amplificazione sequenza bersaglio
+
quantificazione dell’espressione genica
identificazione del prodotto di amplificazione specifico
rispetto a prodotti aspecifici
analisi simultanea di due campioni nella stessa reazione
individuazione di mutazioni puntiformi
… on-line e in tempo reale!
LigthCycler SYSTEM
Roche
Caratteristiche:
Rapide variazioni di temperatura durante i
cicli termici
Come mezzo di trasmissione della temperatura dalla resistenza
ai campioni viene utilizzata l’aria che, essendo virtualmente senza
massa, rende questo processo molto veloce.
Le reazioni vengono preparate in capillari di vetro borosilicato che,
avendo un alto rapporto superficie:volume, assicurano una rapida
equilibrazione fra l’aria ed i componenti della reazione.
Una reazione di PCR di 30-40 cilci può essere completata in 20-30 min.
Monitoraggio on-line e simultaneo dell’amplificazione dei vari
campioni mediante sistemi di rilevamento della fluorescenza
...LigthCycler SYSTEM
L’unità ottica è dotata di un LED come sorgente di
luce e di tre canali di rilevamento che misurano la
luce emessa a tre differenti lunghezze d’onda:
530nm
640nm 710nm
I valori di fluorescenza rilevati vengono visualizzati
sullo schermo del computer consentendo il
monitoraggio on-line della reazione di PCR.
resistenza
capillari
(max 32)
camera
termica
ventilatore
Fluorescenza
L’intensità del segnale
filtri
prodotto dal fluoroforo è
proporzionale alla quantità del
prodotto di PCR.
Numero di cicli
LED
canali di
rilevamento
fluorimetrico
L’aumento dell’intensità del segnale inizia a cicli
differenti a seconda della concentrazione iniziale
del DNA bersaglio.
SYBR Green
E’ un colorante fluorescente che si lega solo al DNA a doppio filamento ed
emette la fluorescenza solamente in queste condizioni.
DENATURAZIONE
Non viene rilevata fluorescenza
SYBR Green
Primer
ANNEALING
L’intensità della fluorescenza
comincia ad aumentare
Luce emessa
ALLUNGAMENTO
L’intensità della fluorescenza continua
ad aumentare e diventa massima al
termine della fase di allungamento
Polimerasi
L’AUMENTO DELLA FLUORESCENZA E’
REGISTRATO A 530nm
SONDE di IBRIDAZIONE
Oligo 1
Fluoresceina
Due sonde oligonucleotidiche sequenza-specifiche,
marcate con coloranti diversi, ibridizzano con la
sequenza bersaglio sul filamento di DNA amplificato
in un arrangiamento testa-coda che consente
l’emissione della fluorescenza.
Oligo 2
LC Red 640
Prodotto di
amplificazione
DENATURAZIONE
Non viene rilevata fluorescenza:
il colorante donatore è eccitato dalla sorgente ed
emette energia in grado di eccitare l’accettore solo
se la distanza fra i due è pari a 1-5 nucleotidi
Trasferimento
Eccitazione
1-5 nucleotidi
Colorante
donatore
Colorante
accettore
ANNEALING
Viene registrata la massima fluorescenza
Emissione
L’AUMENTO DELLA FLUORESCENZA E’
REGISTRATO A 640nm
ANALISI della CURVA di MELTING
Consente di identificare il prodotto di amplificazione specifico rispetto
a prodotti aspecifici.
Curva di fluorescenza
100
104 copie
2.5
80
10 copie
2.0
0 copie
1.5
1.0
Fluorescenza
3.0
Fluorescenza
Curva di melting
104 copie
10 copie
0 copie
60
40
20
0
0.5
0
65
0
10
20
30
40
70
80
85
90
95
Temperatura (°C)
50
Cicli di amplificazione
Derivata negativa della curva di melting
100
104 copie
10 copie
0 copie
prodotti non
specifici
80
-dF/dT
Al termine della PCR la temperatura viene
lentamente aumentata inducendo un decremento
della fluorescenza.
La temperatura in corrispondenza della quale si
ha un repentino decremento della fluorescenza
corrisponde alla Tm del prodotto.
75
60
TM
40
20
0
65
70
75
80
85
Temperatura (°C)
90
95
QUANTIFICAZIONE del PRODOTTO di PCR
Identificando il primo ciclo della PCR in corrispondenza del quale inizia
l’amplificazione esponenziale del prodotto è possibile quantificare la
concentrazione iniziale del DNA bersaglio.
106
105
Estrapolazione della curva standard
106
104 copie
105
104 copie
linea di base
Numero cicli
La linea di base identifica il ciclo in corrispondenza del
quale inizia l’aumento esponenziale della fluorescenza per
ciascun campione.
N. cicli
Fluorescenza
Curva di fluorescenza di campioni
a concentrazione nota
Log concentrazione
Riportando in grafico il valore di intersezione con la linea di base in funzione del Log della
concentrazione iniziale di ciascun campione si ottiene la curva standard da cui si può
estrapolare il valore della concentrazione di campioni a titolo ignoto.
MULTIPLEX PCR
Consente l’analisi simultanea di due campioni nella stessa reazione
STRATEGIA:
Due coppie di Sonde di Ibridazione, ciascuna specifica per un prodotto di
amplificazione, vengono marcate con un diverso colorante accettore che
emette la fluorescenza a differenti lunghezze d’onda.
Fluorecseina
LC Red 640
LC Red 705
Fluorecseina
Canale 2
Canale 3
640 nm
705 nm
Il segnale emesso viene letto
simultaneamente attraverso due canali di
rilevamento fluorimetrico.
Trasferimento
Eccitazione
Emissione
ANALISI di MUTAZIONI PUNTIFORMI
Sfrutta differenze nella Tm di Sonde di Ibridazione perfettamente
legate al DNA bersaglio o il cui legame è destabilizzato dalla presenza
di basi non appaiate.
Sonda 2
marcata con LC Red 640
gene selvatico
omozigote wildtype
omozigote mutante
eterozigote
3.0
Fluorescenza
Sonda 1
marcata con Fluoresceina
2.5
2.0
1.5
La Sonda 1 si ibridizza alla parte
La Sonda 2 si ibridizza alla parte
della sequenza bersaglio mutata della sequenza bersaglio non mutata
gene mutato
50
55
60
65
70
Temperatura
75
80
50
55
60
65
70
Temperatura
75
80
0.25
0.20
Al termine della PCR si analizza la curva di melting:
se è presente una mutazione, la Tm dell’ibrido sarà
più bassa che in assenza di mutazione.
-dF/dT
0.15
0.10
0.05
0.00
-0.05
L’ETICHETTATURA nei REGOLAMENTI C.E.E.
REGOLAMENTO 258/97 sui Novel Food
Disciplina la vendita di prodotti contenenti OGM destinati al
consumo umano ed introduce la nozione di sostanziale
equivalenza : due alimenti sono considerati sostanzialmente
equivalenti quando non presentano alcuna differenza dal punto
di vista nutrizionale, organolettico e della sicurezza.
Rende inoltre obbligatoria l’etichettatura degli alimenti transgenici che
non siano sostanzialmente equivalenti ai prodotti convenzionali.
REGOLAMENTI COMUNITARI 49 E 50/2000
Prevedono l’obbligo di etichettatura per tutti gli alimenti che contengano ingredienti
(49/2000), additivi e aromi (50/2000) derivanti da organismi geneticamente
modificati.
L’obbligo non vale se il prodotto risulti accidentalmente contaminato da derivati
di organismi geneticamente modificati in una percentuale non superiore all’1%.
DIAGNOSTICA degli OGM negli ALIMENTI
TEST sulle PROTEINE
TEST sul DNA
Rilevazione immunologica
della proteina codificata dal
transgene (ELISA)
- Quali- / quantitativo
- Rapido
- Test da campo
- Richiede materie prime non lavorate
- L’espressione delle proteine è spesso
tessuto-specifica e sviluppo-dipendente
Ricerca del transgene e di
sequenze ad esso correlate
(Real-time PCR)
- Quali- / quantitativo
- Rapido
- Sensibile (limite = 0.0001%)
- Degradazione del DNA
- Presenza di inibitori della polimerasi
- Possibili contaminazioni con DNA
estraneo
- Non tutti i derivati alimentari
contengono DNA (es. olio di semi
di mais)
ITER per il RILEVAMENTO di OGM negli alimenti
mediante TEST sul DNA
I° STEP
Analisi qualitativa (screening)
Rivela la presenza/assenza dell’OGM nel campione
Si ricerca la presenza di sequenze regolatrici comuni alla maggior parte degli OGM
risultato
negativo
risultato
positivo
Si identifica il transgene presente, verificando
se è uno di quelli autorizzati in commercio
L’analisi si arresta
II° STEP
Nessun transgene
autorizzato
Alimento illegale
Transgene autorizzato
Analisi quantitativa
Se i singoli ingredienti superano la
percentuale dell’1% scatta l’obbligo di
riportarne la presenza in etichetta
GENI BERSAGLIO nell’analisi qualitativa degli alimenti
Elementi caratteristici dei costrutti ricombinanti
Promotore
CaMV 35S
Transgene
tNOS
Gene
marcatore
Promotore
CaMV 35S
Amplificazione di una delle seguenti sequenze:
PCR QUALITATIVA
Gene
marcatore
Amplificazione di geni sicuramente presenti nel campione
(es. lectina della soia, zeina del mais)
Individuazione del transgene
(è disponibile una banca dati che contiene tutte le sequenze
di DNA depositate nei brevetti a livello mondiale)
PCR QUANTITATIVA
tNOS
2 ESEMPI di QUANTIFICAZIONE...
Mais Bt
Il mais-BT è stato reso resistente
alla piralide mediante l’inserimento
di un gene che codifica per una tossina insetticida
derivata dal batterio Bacillus
turingiensis la cui ingestione
provoca la morte delle larve
paralizzandone l’intestino.
Soia Roundup Ready
La soia Roundup Ready (Monsanto) è
stata modoficata geneticamente per
resistere alla somministrazione del
glifosato, un diserbante ad ampio
spettro.
Per quantificare mais e soia transgenici negli alimenti sono state opportunamente
disegnate combinazioni di Sonde di Ibridazione che riconoscono tanto il transgene
quanto un gene endogeno, rendendo possibile quantificare simultaneamente sia il
contenuto di mais/soia GM che di mais/soia totale nel campione in analisi.
Sonda 1 specifica per il transgene
cryIA(b), codificante per la tossina
Sonda 1 specifica per il transgene
CP4-EPSPS
Sonda 2 specifica per il gene endogeno
codificante per l’enzima invertasi
Sonda 2 specifica per il gene endogeno
codificante per la lectina









![(Microsoft PowerPoint - PCR.ppt [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/001402582_1-53c8daabdc15032b8943ee23f0a14a13-300x300.png)


