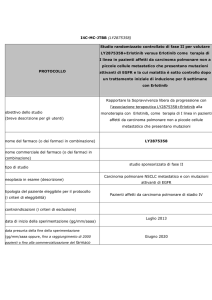
ERLOTINIB (17-10-2006)
Specialità: Tarceva® (Roche)
Forma Farmaceutica:
30 cpr
Dosaggio: 100mg
Prezzo: € 2.596,41
30 cpr
Dosaggio: 150mg
Prezzo: € 3.239,24
Prezzo al pubblico da banca dati Farmadati Marzo 2007
ATC: L01XE03
Categoria terapeutica: Inibitori della proteina chinasi
Fascia di rimborsabilità:
Classe PTN: H-OSP2
Indicazioni Ministeriali:
®
Tarceva è indicato nel trattamento di pazienti affetti da carcinoma polmonare non a piccole cellule
localmente avanzato o metastatico, dopo fallimento di almeno un precedente regime chemioterapico. Nel
®
prescrivere Tarceva , devono essere tenuti in considerazione i fattori associati ad un aumento della
sopravvivenza. Il trattamento non ha dimostrato vantaggi in termini di sopravvivenza o altri effetti
clinicamente rilevanti in pazienti con tumori EGFR-negativi.
Scheda di monitoraggio AIFA: Ai fini delle prescrizioni a carico del SSN, i centri utilizzatori dovranno
compilare la scheda raccolta dati informatizzata di arruolamento che indica i pazienti eleggibili e la scheda
di follow up, secondo le indicazioni pubblicate sul sito http://aifa-onco.agenziafarmaco.it
Decisioni della CTR:
Farmaco inserito in PTORV con nota (data valutazione: 17.10.2006)
Nota:
Nel trattamento in seconda e terza linea di pazienti affetti da carcinoma polmonare non a piccole cellule
localmente avanzato o metastatico, con test EGFR positivo. Il test EGFR viene considerato positivo
quando le cellule tumorali che presentano colorazione, dopo trattamento con apposito reagente, sono più
del 10% del totale. Tale restrizione è valida nei casi in cui sia possibile ottenere il prelievo istologico e
ovviamente non si applica nei casi di impossibilità tecnica ad ottenerlo.
Commenti:
Viene sottolinea l’importanza
di selezionare soltanto i pazienti che presentano all’analisi
immunoistochimica EGFR positivo, in quanto sono i pazienti che traggono i maggiori benefici dal
trattamento. Secondo quanto riportato dalla Scientific Discussion dell’EMEA viene definito EGFR positivo il
test (pharDx Kit) in cui le cellule tumorali che presentano colorazione, dopo trattamento con apposito
reagente, sono più del 10% del totale.
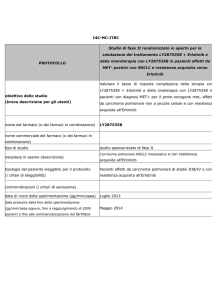
Analisi della letteratura
Il carcinoma polmonare rappresenta una delle neoplasie più comuni e la forma non a piccole cellule ne
costituisce il 75%. Nel 60-65% dei casi la malattia viene diagnosticata ad uno stadio localmente avanzato
(stadio III) o metastatico (stadio IV) e non operabile. I pazienti vengono abitualmente trattati in prima
linea con regimi a base di derivati del platino, con una sopravvivenza mediana a 12 mesi del 33% [1] ed
a 24 mesi del 11%.
La terapia di seconda linea è generalmente costituita da chemioterapici in monoterapia. Il farmaco
generalmente più adoperato è il docetaxel.
Le linee guida ASCO (2003), relative al trattamento del carcinoma polmonare non a piccole cellule non
operabile [2], raccomandano di utilizzare docetaxel come seconda linea di trattamento per pazienti affetti
da carcinoma polmonare non a piccole cellule che presentino un adeguato performance status e che
abbiamo manifestato progressione successivamente ad una prima linea di terapia con platino. In queste
linee guida Gefitinib (ora ritirato dalla FDA) è raccomandato per il trattamento di pazienti con cancro
polmonare non a piccole cellule localmente avanzato o metastatico dopo fallimento sia della terapia a
base di platino che della terapia con docetaxel.
Erlotinib è un inibitore della tirosina chinasi del recettore del fattore di crescita epidermico / recettore del
fattore di crescita epidermico umano di tipo I (EGFR, noto anche come HER1), indicato nel trattamento di
pazienti affetti da carcinoma polmonare non a piccole cellule (NSCLC) localmente avanzato o metastatico,
dopo fallimento di almeno un precedente regime chemioterapico [3]. L’EMEA ha approvato erlotinib con
procedura centralizzata, sottolineando che nel prescrivere tale farmaco, si dovranno tenere in
considerazione i fattori associati ad un aumento della sopravvivenza e che il trattamento non ha
dimostrato vantaggi in termini di sopravvivenza o altri effetti clinicamente rilevanti in pazienti con tumori
EGFR-negativi [1].
Nell’uomo erlotinib viene metabolizzato a livello epatico, soprattutto dal CYP3A4 e in misura minore dal
CYP1A2 [3]. Anche il metabolismo extraepatico, mediato dal CYP3A4 nell’intestino, dal CYP1A1 nel
polmone e dal CYP1B1 nel tessuto tumorale, fornisce un potenziale contributo alla clearance metabolica
di erlotinib. Sono, pertanto, possibili interazioni con i principi attivi che vengono metabolizzati da questi
enzimi o che su di essi agiscono da inibitori (es. ketoconazolo) o da induttori (es. rifampicina).
Ai fini delle prescrizioni a carico del SSN, i centri utilizzatori dovranno compilare la scheda raccolta dati
informatizzata di arruolamento che indica i pazienti eleggibili e la scheda di follow up, secondo le
indicazioni pubblicate sul sito http://aifa-onco.agenziafarmaco.it [4].
Efficacia e tollerabilità in seconda e terza linea
L’efficacia e la tollerabilità di erlotinib nel carcinoma polmonare non a piccole cellule, dopo fallimento della
chemioterapia di prima o di seconda linea, sono state valutate dall’EMEA in 2 studi clinici.
Uno studio randomizzato di fase III, in doppio cieco, controllato con placebo (studio BR.21) è stato
condotto per valutare se erlotinib fosse in grado di prolungare la sopravvivenza nei pazienti con
carcinoma polmonare non a piccole cellule dopo fallimento della chemioterapia di prima o di seconda linea
[5].
In questo studio, 731 pazienti affetti da NSCLC allo stadio IIIB o IV sono stati stratificati (in base al
centro, al performance status, al numero delle terapie praticate in passato, alla miglior risposta a
precedenti terapie ed ad una eventuale precedente terapia con derivati di platino) e randomizzati, in un
rapporto di 2:1, a ricevere per via orale erlotinib 150 mg/die (n=488) oppure placebo (n=243).
I pazienti inclusi nello studio presentavano un performance status da 0 a 3 secondo la scala ECOG
(Eastern Cooperative Oncology Group) ed erano stati sottoposti in precedenza ad uno o due regimi
chemioterapici. In particolare, il 49% dei pazienti aveva ricevuto due precedenti regimi chemioterapici e
il 92 % aveva ricevuto una chemioterapia a base di platino. Relativamente al performance status, solo il
9 % dei pazienti di entrambi i gruppi presentava un performance status pari a 3, mentre la maggior parte
di essi presentava un performance status pari a 1 (53 % nel gruppo erlotinib e 54% nel gruppo placebo).
Il trattamento è stato proseguito fino a progressione della malattia o fino all’insorgenza di una tossicità
non accettabile.
Come end-point primario di efficacia è stata considerata la sopravvivenza complessiva.
Come end-point secondari sono stati considerati la sopravvivenza libera da progressione, la frequenza
complessiva di risposta (completa e parziale), la durata della risposta, gli effetti tossici e la qualità della
vita. Le risposte sono state misurate con l’utilizzo dei criteri RECIST (Responce Evaluation Criteria in
Solid Tumours) mentre gli effetti tossici sono stati valutati secondo i Common Toxicity Criteria del
National Cancer Institute.
L’analisi di efficacia è stata effettuata sulla popolazione intention-to-treat.
La sopravvivenza complessiva mediana è stata di 6.7 mesi nel gruppo erlotinib e 4.7 mesi nel gruppo
placebo (HR=0.70; 95 % IC 0.58-0.85, p<0.001).
La sopravvivenza libera da progressione mediana era pari a 2.2 mesi nel gruppo erlotinib e 1.8 mesi nel
gruppo placebo (HR=0.61; 95 % IC 0.51-0.74, p<0.001).
Nei pazienti con almeno una lesione target (427 nel gruppo erlotinib e 211 nel gruppo placebo), le lesioni
sono state valutate secondo i criteri RECIST.
Nel gruppo erlotinib, le frequenze di risposta completa e parziale sono state, rispettivamente, pari a 0.7%
e 8.2%, con una durata mediana di risposta pari a 7.9 mesi; la frequenza di risposta parziale è risultata,
invece, inferiore all’1% nel gruppo placebo (p<0.001).
Una ulteriore analisi per sottogruppi ha valutato, utilizzando dei campioni bioptici di tumore polmonare a
non piccole cellule, se la risposta ad erlotinib ed il suo impatto sulla sopravvivenza fossero associati
all’espressione del recettore del fattore di crescita epidermico ( EGFR ) e all’amplificazione e a mutazioni
del gene EGFR [6].
L’espressione di EGFR è stata valutata, mediante tecniche immunoistochimiche, nei campioni bioptici
ottenuti da 325 dei 731 pazienti inclusi nello studio BR 21; 197 campioni sono stati analizzati per le
mutazioni a livello del gene EGFR e 221 per il numero di geni EGFR.
All’analisi univariata, la sopravvivenza è risultata superiore nel gruppo erlotinib rispetto al gruppo placebo
nei casi di espressione di EGFR (HR = 0.68; 95 % IC 0.49-0.95, p = 0.02) o elevata
polisomia/amplificazione di EGFR (HR = 0.44; 95 % IC 0.23-0.82, p =0.008).
La probabilità di risposta non era influenzata in maniera significativa dal performance status, da
precedenti trattamenti, da precedenti risposte o dall’età, ma è risultata, comunque, più elevata per donne
(p=0.006), pazienti che non hanno mai fumato (p<0.001), pazienti di origine asiatica (p=0.02), pazienti
con adenocarcinoma (p<0.001) e pazienti con sovraespressione di EGFR (p=0.03). All’analisi di
regressione logistica multivariata, il non aver mai fumato (p<0.001), la presenza di adenocarcinoma
(p=0.01) e l’iperespressione di EGFR (p=0.03) erano associati ad una risposta con erlotinib.
L’analisi di sicurezza è stata condotta sui 727 pazienti che hanno ricevuto il trattamento [4].
Gli effetti indesiderati riscontrati con maggior frequenza nel gruppo erlotinib rispetto al placebo sono stati
rash (76% vs 17%), diarrea (55% vs 19%), tossicità oculare (28% vs 9%) e infezioni (34% vs 21%). Il
19% dei pazienti nel gruppo erlotinib ha richiesto una riduzione della dose per effetti correlati al farmaco
(12% a causa di rash e 5% a causa di diarrea), rispetto al 2 % nel gruppo placebo; 26 pazienti (5 %)
hanno sospeso il farmaco a causa della tossicità. Nel corso dello studio sono state registrate 2 morti per
polmonite interstiziale (un paziente nel gruppo erlotinib e uno nel gruppo placebo).
La popolazione arruolata è stata oggetto di uno studio sulla qualità della vita, pubblicato in agosto 2006. I
risultati mostrano che erlotinib ha presentato un miglioramento significativo di sintomi quali tosse,
dispnea, dolore, delle capacità fisiche e della qualità della vita complessiva [7].
Uno studio di fase II, in aperto, a singolo braccio (studio A248-1007) è stato condotto per valutare
l’efficacia e la sicurezza di erlotinib nei pazienti con carcinoma polmonare non a piccole cellule di stadio
III o IV EGFR positivo dopo fallimento di una precedente chemioterapia a base di platino [1,8].
In questo studio, 57 pazienti hanno ricevuto per via orale erlotinib 150 mg/die fino a progressione della
malattia o fino all’insorgenza di una tossicità non accettabile.
I pazienti inclusi nello studio presentavano un performance status da 0 a 2 secondo la scala ECOG. Il
77% presentava un performance status pari a 1 e il 74% erano ex fumatori.
Come end-point primario di efficacia è stata considerata la frequenza di risposta.
La sopravvivenza complessiva mediana è stata di 8.4 mesi (95 % IC, 4.8-13.9).
La frequenza di risposta è stata simile nei vari pazienti indipendentemente dal numero e dal tipo di
chemioterapie effettuate in precedenza (durata mediana della risposta 19.7 settimane).
Efficacia e tollerabilità in prima linea
Uno studio randomizzato controllato di fase III in doppio cieco (studio TRIBUTE) ha valutato l’efficacia di
erlotinib in pazienti con NSCLC allo stadio IIIB o IV non precedentemente trattati [9]. In questo studio
1.059 pazienti sono stati randomizzati a ricevere per via orale erlotinib 150 mg/die + carboplatino +
paclitaxel (n=526) oppure placebo + carboplatino + paclitaxel (n=533). Come end-point primario di
efficacia è stata considerata la sopravvivenza complessiva, mentre come end-point secondari sono stati
considerati il tempo alla progressione, la risposta oggettiva e la durata della risposta. Nell’analisi di
efficacia non sono state riscontrate differenze nella sopravvivenza complessiva e nel tempo alla
progressione tra i due gruppi di trattamento. Gli effetti indesiderati sono risultati simili, ad eccezione di
rash cutanei e diarrea, manifestatisi con una frequenza superiore nel gruppo erlotinib.
Un ulteriore RCT, condotto su 1.172 pazienti randomizzati a ricevere erlotinib + cisplatino + gemcitabina
oppure placebo + cisplatino + gemcitabina, ha considerato come end-point principali di efficacia la durata
della sopravvivenza e come end-point secondari il tempo alla progressione, la percentuale di risposta, la
durata della risposta (usando i criteri RECIST). In questo studio, il trattamento con erlotinib in
associazione a cisplatino e gemcitabina non ha mostrato un beneficio nei pazienti con carcinoma
polmonare non a piccole cellule di stadio avanzato [10-11]. Uno studio di fase II ha valutato l’efficacia di
erlotinib in pazienti con NSCLC allo stadio IIIB o IV non precedentemente trattati [12]. In questo studio
53 pazienti hanno ricevuto erlotinib 150 mg/die fino a progressione di malattia o a comparsa di tossicità
non accettabile. Come end-point primario di efficacia è stata considerata la percentuale di pazienti senza
progressione di malattia dopo 6 settimane di trattamento. In questo studio, la frequenza complessiva di
non progressione a 6 settimane è stata del 52,8%. Erlotinib è risultato ben tollerato: gli effetti
indesiderati più comuni sono stati diarrea e rash cutanei di grado da lieve a moderato.
Sintesi:
Il carcinoma polmonare rappresenta una delle neoplasie più comuni e la forma non a piccole
cellule è quella più comune, verificandosi nel 75% dei casi. Nel 60-65% dei casi la malattia
viene diagnosticata ad uno stadio localmente avanzato (stadio III) o metastatico (stadio IV) e
non operabile. I pazienti vengono abitualmente trattati in prima linea con regimi a base di
derivati del platino, con una sopravvivenza mediana del 33% a 12 mesi [1] e del 11% a 24
mesi. La terapia di seconda linea è generalmente costituita da chemioterapici in monoterapia e
il docetaxel è il farmaco maggiormente utilizzato.
Erlotinib è un inibitore della tirosina chinasi del recettore del fattore di crescita epidermico /
recettore del fattore di crescita epidermico umano di tipo I (EGFR, noto anche come HER1),
indicato nel trattamento di pazienti affetti da carcinoma polmonare non a piccole cellule
(NSCLC) localmente avanzato o metastatico, dopo fallimento di almeno un precedente regime
chemioterapico. Il trattamento non ha dimostrato vantaggi in termini di sopravvivenza o altri
effetti clinicamente rilevanti in pazienti con tumori EGFR-negativi.
L’efficacia e la tollerabilità di erlotinib sono state analizzate dall’EMEA in un RCT di fase III, in
doppio cieco e in uno studio di fase II, in aperto, a singolo braccio, condotti su pazienti con
NSCLC di stadio III o IV.
Nel primo studio, 731 pazienti sono stati randomizzati, in un rapporto di 2:1, a ricevere per
via orale erlotinib 150 mg/die oppure placebo. In questo studio la sopravvivenza complessiva
mediana (end-point primario di efficacia) è stata di 6.7 mesi nel gruppo erlotinib e 4.7 mesi
nel gruppo placebo (HR=0.70; 95 % IC 0.58-0.85, p<0.001). La sopravvivenza è risultata
superiore nei pazienti con espressione di EGFR o elevata polisomia/amplificazione di EGFR.
Gli effetti indesiderati riscontrati con maggior frequenza nel gruppo erlotinib rispetto al
placebo sono stati rash, diarrea, tossicità oculare e infezioni. Il 19% dei pazienti nel gruppo
erlotinib ha richiesto una riduzione della dose per effetti correlati al farmaco rispetto al 2 %
nel gruppo placebo; 26 pazienti (5%) hanno sospeso il farmaco a causa della tossicità.
La popolazione arruolata è stata oggetto di uno studio sulla qualità della vita, pubblicato in
agosto 2006. I risultati mostrano che erlotinib ha presentato un miglioramento significativo di
sintomi quali tosse, dispnea, dolore, delle capacità fisiche e della qualità della vita
complessiva.
Nel secondo studio sono state valutate l’efficacia e la sicurezza di erlotinib su 57 pazienti con
NSCLC EGFR positivo dopo fallimento di una precedente chemioterapia a base di platino. La
sopravvivenza complessiva mediana è stata di 8.4 mesi (95% IC, 4.8-13.9).
Sono stati, infine, pubblicati studi che valutano l’impiego di erlotinib in prima linea,
indicazione non registrata a livello ministeriale. In particolare, due RCT controllati con
placebo, condotti su pazienti non precedentemente trattati, non hanno dimostrato un beneficio
di erlotinib in associazione a terapia standard nel carcinoma polmonare non a piccole cellule.
Bibliografia:
®
1. Erlotinib (Tarceva ).Scientific Discussion.
http://www.emea.eu.int/humandocs/Humans/EPAR/tarceva/tarceva.htm (accesso del 06/10/2006)
2. ASCO Guidelines (2003); J Clin Oncol 2004; 22:330-63.
®
3. Tarceva . Riassunto delle caratteristiche del prodotto.
4. G.U. n. 173 del 27/07/06.
5. Sheperd FA, et al. N Eng J Med. 2005;353:123-32.
6. Tsao MS; et al. N Eng J Med. 2005;353:133-44.
7. Bezjal A, et al. J Clin Oncol. 2006; 24: 3831-7.
8. Perez-Soler R, et al. J Clin Oncol. 2004; 22: 3238-47.
9. Herbst RS, J Clin Oncol 2005; 23: 5892-9.
10. Gatzmeler U, et al. J Clin Oncol 2004; 14S: 7010 (abstract).
11. Cohen M, et al. The oncologist. 2005; 10:461-6.
12. Giaccone G, et al. Clin Cancer Res. 2006; 12: 6049-55.
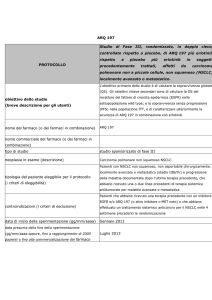
Costi:
Principio
attivo
Erlotinib
Dosaggio da
scheda tecnica
Costo all’ospedale per 21
giorni di terapia^
150 mg/die
1373,74 €
Costo all’ospedale per 52
settimane di terapia^*
21.849 €
(sconto 50% sulle prime 2
confezioni)*
^Prezzo fornito dalla ditta (Marzo 2007)
*L’Azienda farmaceutica Roche comunica che per ogni nuovo paziente che entrerà in terapia con Tarceva e verrà
inserito nel sito http://aifa-onco.agenziafarmaco.it verrà applicata sulle prime due confezioni (2 mesi di terapia) una
scontistica obbligatoria del 50%, negoziata con AIFA. Lo sconto verrà erogato solo dopo opportuna verifica
dell’inserimento in terapia di un nuovo paziente cui deve corrispondere un nuovo codice di arruolamento sul sito di cui
sopra. La modalità di erogazione dello sconto verrà successivamente comunicata da parte dell’AIFA.
Altri farmaci per il trattamento del carcinoma polmonare non a piccole cellule localmente
avanzato o metastatico dopo una precedente chemioterapia:
Principio
Dosaggio da
Costo all’ospedale per
Costo all’ospedale per 52 settimane
attivo
scheda tecnica
ciclo di terapia^
di terapia (17 cicli)^
75 mg/m2
Docetaxel
954,34 €
16.224 €
ogni 21 giorni
500 mg/m2
Pemetrexed
2.280 €
38.760 €
ogni 21 giorni
^Prezzo fornito dalla ditta (Marzo 2007)
News:
Secondo quanto riportato nella Final Appraisal Determination del NICE del 09 Marzo 2007 [1], erlotinib
non è raccomandato per il trattamento del carcinoma polmonare non a piccole cellule localmente
avanzato o metastatico. Il NICE ritiene necessari ulteriori dati relativi all’utilizzo in particolari gruppi di
malati oncologici, nei quali erlotinib potrebbe apportare grandi benefici. Il costo mensile del trattamento è
stato stimato dal NICE pari a circa 1.631 sterline. Nel Febbraio 2008 il NICE, sulla base di nuove
eventuali evidenze scientifiche, potrà rivedere la propria decisione.
1-http://guidance.nice.org.uk/page.aspx?o=414794
Ultima revisione del testo: marzo 2007