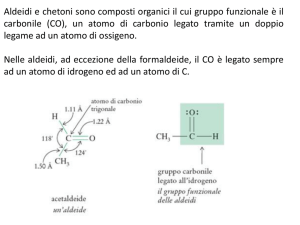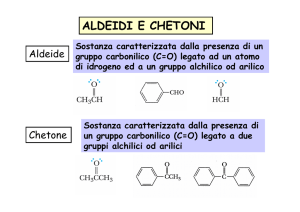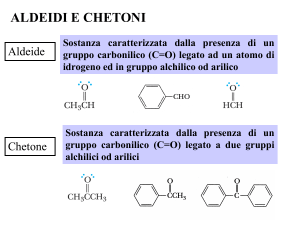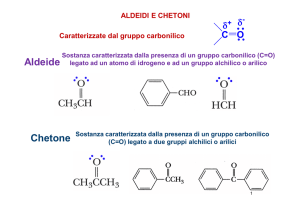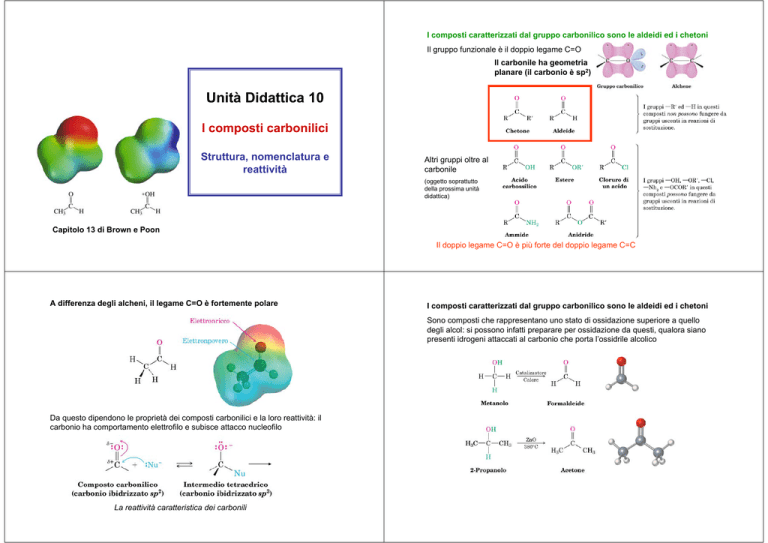
I composti caratterizzati dal gruppo carbonilico sono le aldeidi ed i chetoni
Il gruppo funzionale è il doppio legame C=O
Il carbonile ha geometria
planare (il carbonio è sp2)
Unità Didattica 10
I composti carbonilici
Struttura, nomenclatura e
reattività
Altri gruppi oltre al
carbonile
(oggetto soprattutto
della prossima unità
didattica)
Capitolo 13 di Brown e Poon
Il doppio legame C=O è più forte del doppio legame C=C
A differenza degli alcheni, il legame C=O è fortemente polare
I composti caratterizzati dal gruppo carbonilico sono le aldeidi ed i chetoni
Sono composti che rappresentano uno stato di ossidazione superiore a quello
degli alcol: si possono infatti preparare per ossidazione da questi, qualora siano
presenti idrogeni attaccati al carbonio che porta l’ossidrile alcolico
Da questo dipendono le proprietà dei composti carbonilici e la loro reattività: il
carbonio ha comportamento elettrofilo e subisce attacco nucleofilo
La reattività caratteristica dei carbonili
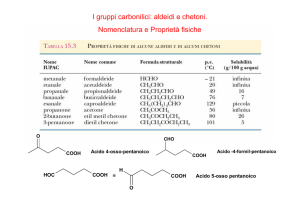
Alla nomenclatura IUPAC sopravvive anche quella comune:
-ale è la desinenza delle aldeidi per la nomenclatura IUPAC
-one è la desinenza IUPAC per i chetoni. Si numera dall’estremità che consente
di dare il numero più basso al carbonile.
Il nome comune deriva da quello dell’acido carbossilico corrispondente con
desinenza -aldeide
Nella nomenclatura comune, si indicano i sostituenti del carbonile e si usa la
desinenza chetone.
Nomi comuni
propanone
Regola generale per la priorità di nomenclatura dei composti
Priorità crescente
La nomenclatura IUPAC di carbonili, carbossili e derivati: strutture e desinenze
Classe
Desinenza
Prefisso nel caso di
sostituente
Acidi carbossilici
Acido -oico
Carbossi-
Esteri
-oato
Alcossicarbonil-
Ammidi
-ammide
Amido-
Nitrili
-nitrile
Cyano-
Aldeidi
-ale
OssoFormil- (nel caso di –CH=O)
Chetoni
-one
Osso-
Alcol
-olo
Idrossi-
Ammine
-ammina
Ammino-
Alcheni
-ene
Alchenil- (es: propenil-)
Alchini
-ino
Alchinil- (es: propinil-)
Alcani
-ano
Alchil- (es: butil-)
Eteri
–
Alcossi- (es: metossi-)
Alogenuri alchilici
–
Alogeno- (es: cloro-)
Esempi di denominazione di molecole con più di un gruppo funzionale
Proprietà chimico-fisiche
Polarità del gruppo carbonile
Χ
Le aldeidi sono
meno impedite
stericamente e il
carbonio
carbonilico è meno
stabilizzato: sono
più reattive.
Generalità sulla reattività dei carbonili e dei substrati correlati
Reazione con i nucleofili: riduzione e addizione di Grignard
Il doppio legame C=O è altamente polare: il C è la parte elettrofila, specialmente reattiva
nella formaldeide e nelle aldeidi perché meno impedita e più povera di elettroni. Un
carbonile reagisce con i nucleofili per dare alcoli in seguito ad addizione nucleofila.
Se in seguito all’addizione di nucleofilo c’è un H legato in alfa al carbonio ex-carbonilico,
può avvenire una disidratazione (si perde l’ossigeno carbonilico) per formare un nuovo
doppio legame tra il carbonio carbonilico e l’atomo del nucleofilo entrato.
La riduzione del doppio legame C=O produce un alcol (primario da un’aldeide,
secondario da un chetone), La riduzione dei carbonili (spesso condotta con idruri
come NaBH4 o LiAlH4) può essere interpretata come un attacco nucleofilo da
parte dello ione idruro (H–).
L’addizione di un reattivo di Grignard ad un carbonile genera un alcol (Alcol
primario da formaldeide, alcol secondario da altra aldeide, alcol terziario da
chetone).
Attacco nucleofilo su substrati che portano buoni gruppi uscenti
In questo caso, la reazione può evolvere nella direzione di espellere il gruppo
uscente per portare alla conversione del prodotto in un nuovo composto
carbonilico
meccanismo
L’idratazione dei carbonili: catalisi basica
L’idratazione dei carbonili: catalisi acida
gem-dioli
È un esempio di reazioni di questo tipo:
non danno generalmente addizioni
stabili, essendo il carbonile il composto
favorito ed Y, elettronegativo, in grado
di stabilizzare bene la carica negativa
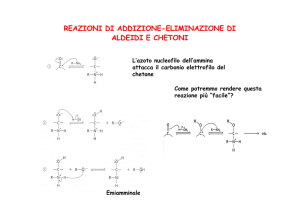
La reazione dei carbonili con le ammine: la formazione
delle immine (e delle enammine)
:
:
Le immine sono intermedi importanti di molti processi metabolici.
Queste sono reazioni all’equilibrio: si possono riottenere i carbonili o fare
reagire le immine o enammine per avere altri composti stabili (ad esempio
ridurre l’immina ad ammina)
Sono esempi tipici di addizioni nucleofile in cui si elimina H2O dall’intermedio
tetraedrico (le due reazioni hanno meccanismi analoghi).
Esempi di formazione di immine e enammine
La formazione degli acetali
Le aldeidi ed i chetoni reagiscono con due equivalenti di alcol in
ambiente acido per dare acetali (detti anche chetali se derivati da un
chetone).
Come l’acqua, gli alcoli sono nucleofili e si sommano al C=O. In ambiente
acido, la protonazione del carbonile ne aumenta la reattività rendendo la
reazione più veloce.
L’addizione porta inizialmente ad un idrossietere detto emiacetale (analogo al
gem-diolo che si forma per addizione di acqua al carbonile).
Gli acetali sono importanti come gruppi protettori dei carbonili
In presenza di acido, l’OH
dell’emiacetale può essere
protonato e può disidratare
(meccanismo E1) dando uno
ione ossonio che addiziona
un’altra molecola di alcol per
dare l’acetale (dopo
deprotonazione).
(ricordate i silil-eteri per proteggere i gruppi alcolici?)
Gli acetali (come gli eteri) sono inerti alla maggior parte delle reazioni (reattivi di
Grignard, riduzioni con idruri o con idrogeno) e sono stabili in ambiente alcalino
(si riconvertono in carbonili in ambiente acido).
Tutti i passaggi sono
reversibili: si può usare in
un verso o nell’altro,
semplicemente modificando
le condizioni di reazione
(reazione in alcol e separazione
dell’acqua fanno prevalere
l’acetale).
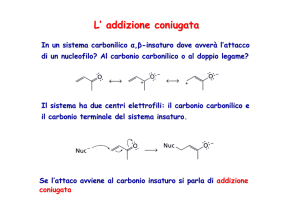
Addizioni coniugate su aldeidi o chetoni α,β-insaturi (doppio legame
tra le posizioni 2 e 3 rispetto al carbonile in 1)
Un esempio dell’impiego di un equivalente di glicole etilenico (1,2-etandiolo) come
gruppo protettore del un carbonile per ottenere esclusivamente la riduzione del
carbossile ed evitare la contemporanea riduzione del carbonile (che avverrebbe nelle
stesse condizioni). La formazione dell’acetale in questo caso è ulteriormente favorita
per fattori entropici (reazione intramolecolare).
Esempi di addizione di nucleofili a carbonili α,β-insaturi
Nel caso di un carbonile α,β-insaturo, il carbonio β è elettrofilo per risonanza.
α
β
Questi prodotti possono dare addizione
coniugata di un nucleofilo al doppio
legame C=C. Il prodotto iniziale è uno
ione enolato stabilizzato per risonanza
che viene protonato al carbonio in α per
dare un’aldeide o un chetone saturo.
Doppio legame C=C attivato, può reagire
con un nucleofilo (altrimenti non c’è
reazione)
Ricordate l’addizione
coniugata agli 1,3-dieni?
I reattivi di Grignard o di
organo-litio in genere non
danno addizione coniugata,
mentre i reattivi di organi-rame
danno addizione coniugata.
(diverso meccanismo con i diversi organometallici, per cui posso scegliere)
La tautomeria cheto-enolica
Ogni composto carbonilico con un idrogeno sul carbonio in α è in rapido equilibrio
con l’enolo corrispondente.
Sono tautomeri quegli isomeri che differiscono per
la localizzazione di un atomo di idrogeno ed un
doppio legame. Sono composti diversi, con struttura
diversa, messi in relazione da una reazione: non
sono forme di risonanza.
La tautomeria cheto-enolica è molto importante per spiegare la reattività dei
carbonili con idrogeni in α. Ad esempio, spiega la racemizzazione spontanea al
carbonio in α in presenza anche solo di tracce di acido.
O
O
Ph
Ph
Ph
OH
H
H
(3R)-3-fenilbutan-2-one enolo achirale (3S)-3-fenilbutan-2-one
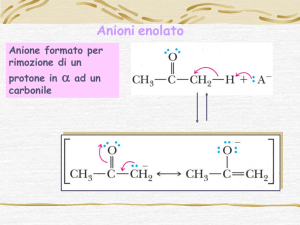
Gli ioni enolato
Gli enoli sono in genere
sfavoriti (prevale la forma
chetonica) e sono difficili da
isolare, ma sono molto
reattivi (quindi molto
importanti).
La tautomeria cheto-enolica
è catalizzata sia dagli acidi
che dalle basi.
Gli ioni enolato sono molto utili: sono un modo per fare un nucleofilo al carbonio
(e quindi poter fare reazioni per costruire una catena di carboni lunga da reagenti
semplici).
Una base molto forte (NaH, ad esempio) è in grado di strappare un idrogeno in α
ad un carbonile. In questo modo si forma uno ione enolato, stabilizzato per
risonanza. L’idrogeno in α è molto più acido che per un alcano.
Per lo stesso tipo di risonanza, i composti 1,3 dicarbonilici hanno idrogeni ancora
più acidi (studia le forme di risonanza come esercizio)
La condensazione aldolica
Abbiamo visto che il carbonile può
comportarsi sia da elettrofilo al
carbonio che da nucleofilo al
carbonio quando trasformato
nell’enolato.
LDA=litio di-isopropil ammide, una base
molto forte.
Il carbonio α dell’enolato può
addizionarsi al carbonio elettrofilo
del carbonile non deprotonato,
anche dello stesso composto, per
dare un prodotto di
condensazione (un aldolo).
Esempi di condensazione aldolica (può essere sfruttata a scopi sintetici)
Fattori sterici (affollamento)
spesso sembrano motivare le
basse rese della condensazione
aldolica su aldeidi con
sostituenti in α o su chetoni.