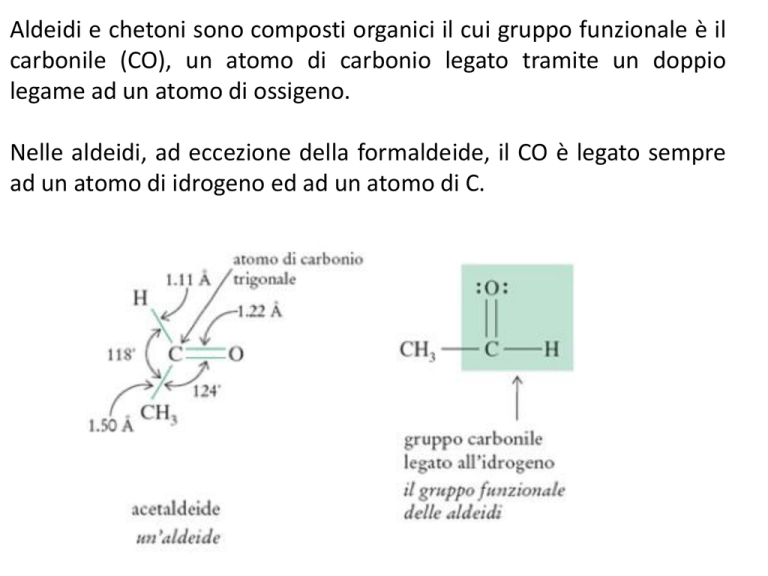
Aldeidi e chetoni sono composti organici il cui gruppo funzionale è il
carbonile (CO), un atomo di carbonio legato tramite un doppio
legame ad un atomo di ossigeno.
Nelle aldeidi, ad eccezione della formaldeide, il CO è legato sempre
ad un atomo di idrogeno ed ad un atomo di C.
Nei chetoni, invece il CO è legato a due atomi di C
L’atomo di C del gruppo carbonile è:
•legato all’O e ad altri due atomi, tutti giacenti nello stesso piano,
•trigonale planare, con angoli di legame approssimativamente di
120°,
•ibridato sp2 ed i suoi tre orbitali ibridi formano lo scheletro dei
legami σ del gruppo carbonile.
di ossigeno.
Il legame σ tra il C e l’O è formato dalla sovrapposizione di uno degli
orbitali ibridi del carbonio con un orbitale ibrido sp2 dell’ossigeno.
Il C del carbonile ha un orbitale atomico 2p perpendicolare al piano in
cui giacciono i tre orbitali ibridi sp2. La sovrapposizione tra questo
orbitale atomico 2p del C ed un orbitale atomico 2p dell’O porta alla
formazione del legame π tra C e O.
Anche nel caso del gruppo carbonile i doppietti non condivisi
dell’ossigeno sono situati in orbitali ibridi che, in questo caso,
corrispondono agli orbitali ibridi sp2 dell’atomo
Polarità
L’ossigeno è più elettronegativo del carbonio e, quindi, il carbonile ha
un momento dipolare permanente con l’estremità negativa del
dipolo localizzata sull’atomo di ossigeno.
La sua elevata polarità si può comprendere considerando le strutture
limite di risonanza, in particolare quella in cui l’atomo di carbonio ha
una formale carica positiva e l’atomo di ossigeno ne ha una negativa.
Nomenclatura Classica e IUPAC – Aldeidi
Fatta eccezione per le due aldeidi più semplici, formaldeide ed
acetaldeide, è preferibile utilizzare le regole IUPAC:
•trovo la catena di atomi di carbonio più lunga contenente il gruppo
CHO;
•sostituisco con il suffisso “ale” la desinenza “-o” del nome
sistematico della porzione;
•la catena di atomi di carbonio è numerata a partire dalla funzione
aldeidica che è, per sua natura, terminale;
•gli altri sostituenti sono indicati come prefissi preceduti da un
numero che identifica la loro posizione rispetto al gruppo aldeidico;
•se il gruppo aldeidico è sostituente di un anello, si usa il suffisso
“carbaldeide” legato al nome del composto ciclico;
•il derivato del benzene in cui è presente un gruppo aldeidico viene
generalmente indicato con il nome di benzaldeide.
Classica e IUPAC – Chetoni
Fatta eccezione per il capostipite, l’acetone, è preferibile utilizzare le
regole IUPAC:
•trovo la catena di atomi di carbonio più lunga contenente il gruppo CO;
•sostituisco con il suffisso “one” la desinenza “-o” del nome sistematico
della porzione;
•la numerazione è attribuita in maniera da assegnare al carbonile la
posizione più bassa possibile;
•per indicare gli altri sostituenti si usano gli opportuni prefissi preceduti
da numeri che ne definiscono la posizione;
•se il nome sistematico è troppo complesso, si considerano i gruppi
organici come sostituenti del carbonile che, in tal caso, viene indicato
con la parola “chetone”;
•chetoni che abbiano un fenile direttamente legato al carbonile si
indicano generalmente con il suffisso “fenone”;
•quando è necessario denominare il carbonile come sostituente, si
usa il prefisso “osso” preceduto dal numero che ne indica la posizione
nella catena.
Preparazione
Ossidazione non selettiva
Aldeidi e chetoni sono comunemente preparati per ossidazione degli
alcoli.
Gli alcoli primari e secondari sono facilmente ossidati a composti
carbonilici mentre gli alcoli terziari non subiscono l’ossidazione:
infatti, perché l’ossidazione abbia luogo è necessario che sia
presente un atomo di idrogeno sullo stesso atomo di carbonio del
gruppo ossidrile.
Gli alcoli primari e secondari sono facilmente ossidati da reagenti del
cromo(VI), in soluzioni acquose acide (reattivo di Jones). Gli alcoli
primari danno per ossidazione gli acidi carbossilici attraverso le
aldeidi corrispondenti: nelle condizioni di ossidazione, infatti,
l’aldeide formatasi dall’alcol reagisce ulteriormente con il cromato
acido per dare l’acido carbossilico corrispondente.
Nelle stesse condizioni, gli alcoli secondari danno i chetoni e la
reazione non va oltre.
Reattività del CO
Il carbonile è fortemente polarizzato e il suo atomo di carbonio risulta
elettrofilo.
Le reazioni dei composti carbonilici, influenzate da questa caratteristica
del gruppo funzionale, sono generalmente divisibili in due categorie:
•quelle che avvengono al C carbonilico – addizione nucleofila.
Molte reazioni delle aldeidi e dei chetoni, in effetti, hanno inizio con
l’attacco di un nucleofilo all’atomo di carbonio del carbonile e si
completano per protonazione dello ione alcossido che si viene a
formare.
•quelle che avvengono al C α – reazioni degli enolati.
Gli atomi di carbonio adiacenti al gruppo carbonile sono definiti atomi
di carbonio alfa e gli atomi di idrogeno legati ad essi, idrogeni in α (o
semplicemente idrogeni α). Le posizioni α rispetto al carbonile sono
molto importanti a causa della particolare reattività degli idrogeni in α.
Addizione nucleofila al C: meccanismo generale.
Per l’addizione nucleofila si può parlare di due meccanismi
generali a seconda del tipo di nucleofilo utilizzato (carico
negativamente o neutro) e della presenza o assenza di un
catalizzatore acido.
Nel caso più generale, parliamo di due stadi:
1.il nucleofilo carico negativamente, attacca il CO al C elettrofilo
rompendo il legame π e muovendo la sua coppia di elettroni
sull’O. In questo stadio si forma un intermedio ibridato sp3 che
contiene un nuovo legame C-Nu;
2.la protonazione dell’O carico negativamente ad opera di una
molecola di acqua, che forma il prodotto finale.
Addizione nucleofila al C (segue)
Meccanismo generale
Con un nucleofilo debole la reazione richiede un ulteriore
passaggio, ma il prodotto finale non cambia:
1.protonazione dell’O carbonilico; si forma un catione
stabilizzato per risonanza che possiede una carica positiva. Il
carbonile, risulta, pertanto, più elettrofilo e quindi più
suscettibile all’attacco di un nucleofilo;
2.il nucleofilo, attacca il CO al C elettrofilo;
3.perdita di un protone, con formazione del prodotto finale.
Addizione nucleofila al C (segue)
Meccanismo generale
•Le aldeidi sono più reattive dei chetoni sia per
ragioni steriche che elettroniche (infatti i due
sostituenti R sui chetoni stabilizzano la carica
positiva del C del CO, rendendolo meno reattivo)
Stereochimica dell’addizione del nucleofilo.
•l’addizione del Nu converte il C carbonilico ibridato sp2 in un C
ibridato sp3, ma come sempre nel caso di materiale di partenza
achirale, la formazione del nuovo centro stereogenico avviene in
maniera equimolecolare per i due enantiomeri. Pertanto, si ottiene
una miscela racemica.
Addizione di alcoli
Formazione di acetali
Gli alcoli si addizionano alle aldeidi dando luogo all’equilibrio a
composti che sono noti come emiacetali. Nell’emiacetale un
ossidrile e un alcossile sono legati allo stesso atomo di carbonio.
Gli emiacetali, per perdita di una molecola di acqua e addizione di
una seconda molecola di alcol, danno gli acetali nei quali due gruppi
alcossilici sono legati allo stesso atomo di carbonio. Ad esempio,
quando l’acetaldeide è trattata con un eccesso di metanolo, sono
presenti all’equilibrio sia l’aldeide libera sia l’emiacetale che
l’acetale.
Chetoni ed alcoli danno anch’essi emiacetali ed acetali, ma non si
formano altrettanto spontaneamente.
Tuttavia, se l’aldeide o il chetone sono trattati con un eccesso di
alcol in presenza di un acido si ottiene direttamente la formazione
dell’acetale.
Addizione di alcoli ad aldeidi (segue)
Decorso della reazione: primo stadio (FORMAZIONE EMIACETALE)
Nella reazione di un’aldeide o di un chetone con un alcol l’atomo di
ossigeno dell’alcol funziona da nucleofilo che attacca l’atomo di
carbonio del carbonile.
Il catalizzatore acido protona l’atomo di ossigeno del carbonile,
aumentando l’elettrofilia dell’atomo di carbonio carbonilico.
Infine, la deprotonazione dello ione ossonio, che deriva dall’attacco
dell’alcol sul composto carbonilico protonato, porta all’emiacetale.
Addizione di nucleofili azotati: Reazioni con le ammine
Le ammine ed altri composti correlati con l’ammoniaca costituiscono una classe
importante di reagenti che si comportano da nucleofili verso il gruppo carbonile.
Tutti questi composti reagiscono con le aldeidi e i chetoni per dare prodotti in
cui c’è un doppio legame fra l’atomo di carbonio appartenente in origine al
carbonile e l’atomo di azoto.
Addizione di nucleofili azotati (segue)
Reazioni con le ammine: decorso
Le aldeidi reagiscono facilmente con le ammine primarie per dare
composti noti come immine o basi di Schiff. La reazione può essere
vista come un’addizione al doppio legame carbonio-ossigeno
seguita da eliminazione di acqua (disidratazione) che crea un
doppio legame carbonio-azoto.
I chetoni, come le aldeidi, formano immine, sebbene non altrettanto
prontamente.
Le reazioni viste sono reversibili: le immine sono infatti riconvertite in
composti carbonilici e ammine per idrolisi.
N.B. l’ambiente acido è necessario per consentire la perdita di acqua
nello stadio finale della reazione: quindi, la soluzione deve essere
leggermente acida. La velocità di reazione è massima a pH ~5.
Enoli ed enolati
Definizione
Lo strumento che permette di fare previsioni sulla basicità e
sull’acidità dei composti organici è la stabilizzazione,
rispettivamente degli acidi e delle basi coniugate, per effetto
induttivo e per risonanza (effetto mesomerico).
Questo concetto, è molto importante per introdurre una nuova
classe di composti: gli enoli ed i corrispondenti ioni enolato,
composti che possiedono un gruppo ossidrilico legato ad un C
ibridato sp2.
Enolizzazione
Gli enoli sono tautomeri di aldeidi e chetoni ed
esistono in equilibrio con quest’ultimi. Il processo
attraverso il quale un composto carbonilico si
converte nel suo enolo è chiamato enolizzazione e
può aver luogo in condizioni acide, basiche o anche
neutre.
Nel caso di condizioni basiche: dal carbonio adiacente al carbonile può essere
rimosso un protone, per azione della base, e si ottiene un carbanione stabilizzato
per delocalizzazione degli elettroni sull’atomo di ossigeno del carbonile, che è
detto ione enolato.La sua protonazione sull’atomo di ossigeno lo converte poi in
enolo (pKa 10.9). Le basi più usate sono H-, R2N, OH- e RO-.
Meccanismo alternativo di enolizzazione (promossa da acidi)
Anche gli acidi promuovono reazioni di enolizzazione, ma in questo
caso il carbonile viene protonato e solo la successiva rimozione del
protone in alfa al CO, ad opera dell’H2O, forma l’enolo.
In ambiente neutro le percentuali di enolo presenti
all’equilibrio con le rispettive forme chetoniche
dipendono dalla natura del composto, così come da altri
fattori quali ad esempio il solvente: per un composto
con un solo carbonile, come l’acetone, l’equilibrio è
fortemente spostato verso la forma chetonica (>
99.999%).
CONDENSAZIONE
ALDOLICA
I carbanioni
Nel meccanismo della condensazione aldolica, abbiamo visto due
forme di risonanza dell’anione enolato: di queste, la prima è un
carbanione. I carbanioni sono intermedi reattivi in cui un atomo di
carbonio possiede una coppia di elettroni non leganti e porta una
carica negativa. Essi possono essere generati in due modi: (a) per
rimozione di un protone da un composto organico tramite una base
e (b) per reazione di alogenuri organici con metalli per dare reagenti
organometallici.
Il C del carbanione che porta una carica negativa, presenta
un’ibridazione sp3, con una struttura che ricorda quella
dell’ammoniaca. L’atomo di C, infatti, è circondato da 3 atomi (H e/o
C) e da un doppietto di elettroni non di legame, che lo rendono
ibridato sp3 con struttura di piramide trigonale, con angoli di legame
approssimativamente di 109,5°. Dei quattro orbitali ibridi sp3, uno è
occupato da una coppia di elettroni.