Anioni enolato
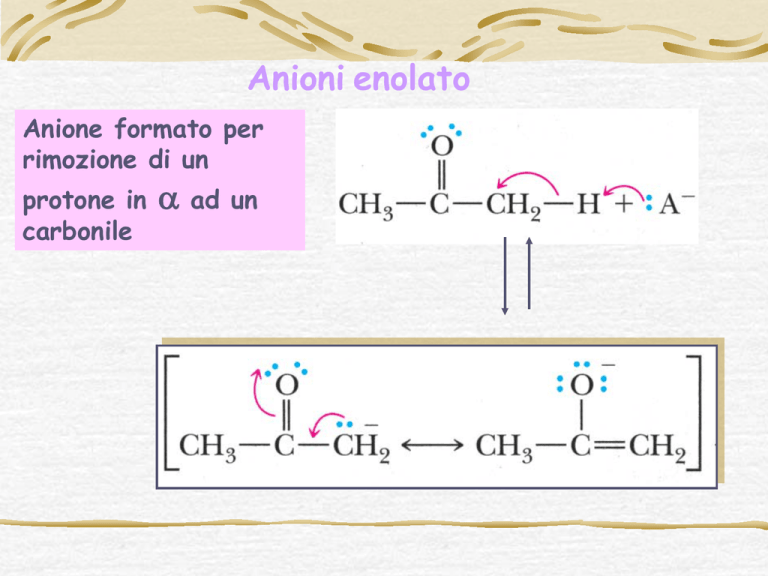
Anione formato per
rimozione di un
protone in
carbonile
α
ad un
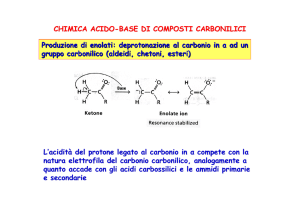
Gli idrogeni in α sono relativamente più acidi
rispetto agli idrogeni degli alcani
idrogeni in α
carboni in α
pKa = 20
CH3CH2O-H pKa = 16
CH3CH2-H
pKa = 51
Ciò si verifica perché l’anione enolato è stabilizzato per risonanza
(effetto di risonanza) e per la parziale carica positiva presente sul C
carbonilico (effetto induttivo).
Gli anioni enolato sono importanti perché generano un
carbonio di tipo carbanionico (nucleofilo)
δIbrido di
risonanza
δ-
Carbonio nucleofilo
Il carbonio α dell’enolato (nucleofilo) può reagire
con gli elettrofili e quindi anche con un carbonio
carbonilico (elettrofilo)
Si ha la formazione di
un nuovo legame C-C
La reazione aldolica
Aldolo (β-idrossialdeide)
La reazione aldolica è data da aldeidi che hanno
idrogeni α (possono formare anioni enolato)
Meccanismo della reazione aldolica
1
2
3
Le β-idrossialdeidi e i β-idrossichetoni
disidratano facilmente portando al
composto carbonilico α−β insaturo
calore
basi
meccanismo base catalizzato
Reazione aldolica incrociata
Avviene tra una aldeide con idrogeni in α (produce lo
ione enolato) e un’altra aldeide senza idrogeni in α
Aldeidi senza idrogeni in α
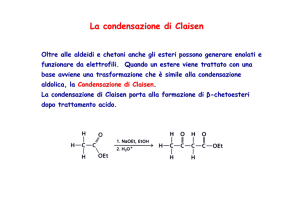
La condensazione di Claisen
Reazione di condensazione tra due esteri (che hanno idrogeni α)
che porta ad un β-chetoestere.
Avviene con formazione di ioni enolato
β-chetoestere
Struttura di un β-chetoestere
Meccanismo della condensazione di Claisen
1
2
3
4
L’anione enolato del β-chetoestere, infine, è trasformato nel
prodotto desiderato per addizione di un acido organico
Condensazioni di Claisen incrociate
Avviene tra un estere con idrogeni in α (produce lo
ione enolato) e un altro estere senza idrogeni in α
Esteri senza idrogeni in α
La condensazione di Dieckman
La condensazione di Dieckman è una
condensazione di Claisen intramolecolare.
Porta alla formazione di una molecola ciclica
Meccanismo della condensazione di Dieckman
viene rimosso
1
2
3
Le condensazioni di Claisen ed aldolica
nel mondo biologico
tiolasi
Acetil-CoA
acetoacetil-CoA
La seconda condens.
avviene su questo carbonile
colesterolo
terpeni
ormoni steroidei
isopentenilpirofosfato
esteri acetacetici: reattività
Gli acidi carbossilici con gruppi carbonili in posizione β alla funzione
carbossilica sono instabili poiché, attraverso uno stato di transizione
ciclico, possono subire simultaneamente sia il trasferimento di un protone
sia la perdita di CO2 e la formazione di un enolo. Per esempio, quando
l’acido 2-butilacetoacetico perde diossido di carbonio, la specie che si
forma è l’enolo del 2-eptanone che viene trasformato nella forma
chetonica per deprotonazione all’ossigeno e protonazione all’atomo di
carbonio in posizione α al carbonile (tautomeria cheto-enolica).
Decarbossilazione di un diestere (estere malonico)
Acido carbossilico