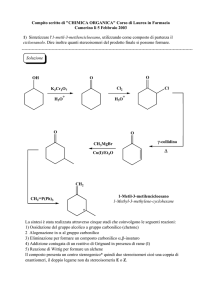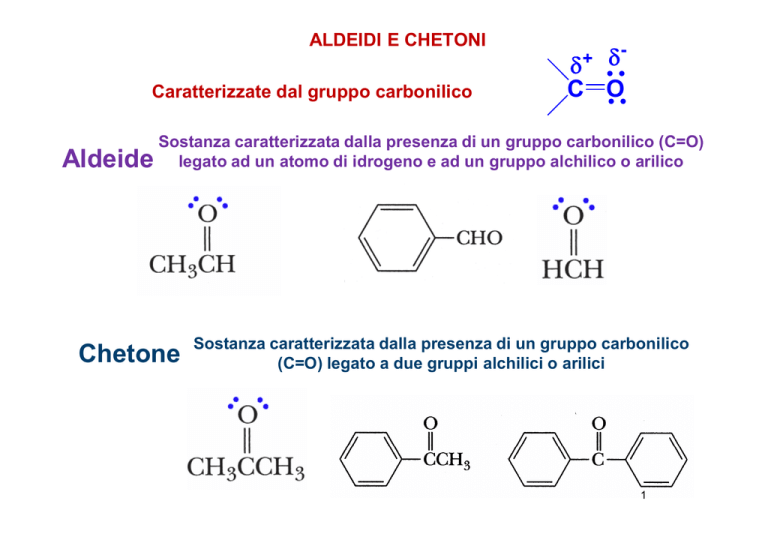
ALDEIDI E CHETONI
C O
+
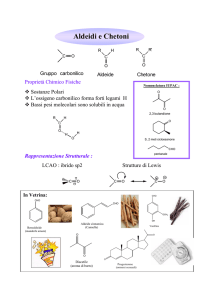
Caratterizzate dal gruppo carbonilico
Sostanza caratterizzata dalla presenza di un gruppo carbonilico (C=O)
Aldeide legato ad un atomo di idrogeno e ad un gruppo alchilico o arilico
Chetone
Sostanza caratterizzata dalla presenza di un gruppo carbonilico
(C=O) legato a due gruppi alchilici o arilici
1
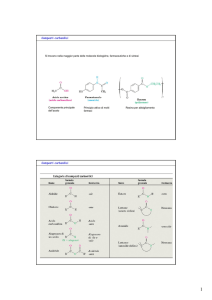
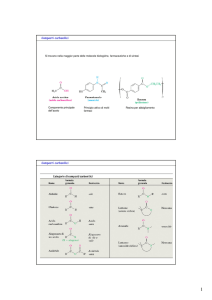
Nomenclatura delle Aldeidi e dei Chetoni
Il nome si ricava cambiando il suffisso –o dell’alcano in –ale per le
adeidi ed in –one per i chetoni:
metanale
(formaldeide)
Propanone
(acetone)
etanale
3-metilbutanale
(acetaldeide)
5-metil-3-esanone
benzaldeide
2-metilcicloesanone
2
Il gruppo carbonilico
R
120°
C
120°
R
p
O
R
120°
sp2
C
O sp2
R
R
R
C
p
O
3
Il gruppo carbonilico
+
R
120°
C
R
2
sp
O
120°
sp2
C
O
+
C O
La netta polarizzazione con una lacuna elettronica sul C, che lo rende
elettrofilo, indica che l'attacco deve essere condotto da reagenti nucleofili.
4
Proprietà fisiche
Il gruppo carbonilico è polarizzato. Ciò rende aldeidi e chetoni
molecole polari con punti di ebollizione maggiori di quelli dei
composti non polari di pari peso molecolare.
Il gruppo carbonilico è polarizzato a causa
della differenza di elettronegatività tra
Carbonio ed Ossigeno.
Anche le due strutture limite
di risonanza che descrivono
la struttura del gruppo
carbonilico rendono conto
della sua polarizzazione
5
Reattività
Il carbonio carbonilico, avente una parziale carica positiva (+) è
elettrofilo. Potrà quindi reagire con i nucleofili
+
-
planare, C sp2
tetraedrico, C sp3
ADDIZIONE NUCLEOFILA AL CARBONILE
Se il nucleofilo è molto efficiente l'addizione può avvenire sul
composto carbonilico direttamente, altrimenti esso deve essere
attivato mediante catalisi acida.
C
O
+ H
+
+
C
OH
+
C
OH
6
7
Composto organometallico
Un composto che contiene un legame carbonio-metallo
Carbonio NUCLEOFILO
R
Legame Carbonio-metallo
Legame polarizzato
Carbonio: elemento più
-
R
C
elettronegativo
Entità polarizzazione:
dipende dal metallo
R
+
M
Composto organometallico
Un composto che contiene un legame carbonio-metallo
Composti organomagnesiaci (reattivi di Grignard)
1-clorobutano
La differenza di elettronegatività tra il
C e il Mg è 1.3:
il legame è fortemente polarizzato.
Cloruro di n-butilmagnesio
carattere di CARBANIONE
(un C nucleofilo)
11
Reattivi di Grignard: R-Mg-X
+
- +
I reattivi di Grignard sono anche basi molto forti:
Base più forte
Acido più forte
Acido più debole
Base più debole
RNH2 ROH HOH ArOH RSH RCO2H
riescono a cedere un protone al reattivo di Grignard
13
Addizione dei reattivi di Grignard ai composti carbonilici
Addizione alla formaldeide
Alcol primario
Addizione ad una aldeide
Alcol secondario
Addizione ad un chetone
Alcol terziario
14
Reattivi di Grignard: R-Mg-X
R-Mg-X: NUCLEOFILO …. Reagisce con un ELETTROFILO!!
Porzione
fornita dal
Grignard
Aldeidi e Chetoni: Struttura e legami
Gruppo CARBONILICO:
doppio legame carbonio-ossigeno
legame σ: orbitale sp2 del carbonio e
dell’ossigeno
legame π, sovrapposizione di orbitali 2p
paralleli.
coppie di elettroni di non legame di O in
orbitali ibridi sp2
Sostituenti
Aldeide: un alchile e un Idrogeno
Chetone: due alchili
O
C
Proprietà fisiche
L’ossigeno è più elettronegativo del carbonio (3.5 contro 2.5)
Doppio legame carbonio-ossigeno è polare
Ossigeno con parziale carica negativa
Carbonio una parziale carica positiva.
Risonanza
Ossigeno carbonilico: base di Lewis
Carbonio carbonilico: acido di Lewis.
Momento dipolare: 2.3 D
Reazioni
Addizione nucleofila acilica
Nuovo legame tra il nucleofilo e l’atomo di carbonio carbonilico elettrofilo.
N.B.: carbonio carbonilico è molto elettrofilo
Nuovo legame trasformazione del legame π in una coppia solitaria
sull’ossigeno del composto tetraedrico di addizione al carbonile.
Reazioni
Reazione promossa da catalisi acida: aumenta reattività carbonio carbonilico
Addizione di nucleofili carboniosi
Addizione di reattivi di Grignard
Legame carbonio-magnesio di un reattivo di Grignard è covalente polare
Carbonio con parziale carica negativa
Magnesio: parziale carica positiva
reattivo di Grignard: buon nucleofilo
Prodotto di addizione: un alcolato di Mg
Addizione di nucleofili ossigenati
L’addizione nucleofila di acqua (idratazione) diolo geminale o gemdiolo.
Gem-diolo: forma idrata del corrispondente aldeide o chetone.
instabile e isolato raramente
Reazione catalizzata dagli acidi e dalle basi.
Idratazione: processo facilmente reversibile
Equilibrio spesso spostato verso il gruppo carbonilico.
Per alcune aldeidi semplici, equilibrio favorisce forma idrata
Formaldeide in acqua: forma idrata > 99%.
Addizione di nucleofili ossigenati
L’addizione nucleofila di acqua (idratazione) diolo geminale o gemdiolo.
Soluzione al 37% di formaldeide
in acqua: FORMALINA, usata
per la conservazione di campioni
biologici.
Acetone meno dello 0.1% di diolo all’equilibrio
Fattori elettronici
Fattori sterici
Addizione di alcoli (nucleofili all’ossigeno)
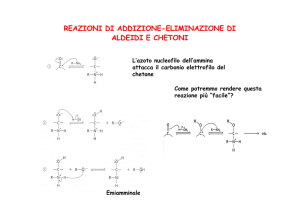
EMIACETALI
Il gruppo
funzionale di un
EMIACETALE
1° stadio: addizione al carbonile
+
2° stadio: trasferimento di protone
-
emiacetale
+
24
Gli emiacetali possono ulteriormente reagire con una molecola
di alcol per dare gli ACETALI ed una molecola di acqua.
E’ necessaria la catalisi acida !
ACETALE
Il gruppo
funzionale di un
acetale
da una aldeide
da un chetone
25
Meccanismo della formazione di acetali
Stadio 1: protonazione dell’emiacetale
Stadio 2: Eliminazione di una molecola d’acqua e formazione di
un carbocatione stabilizzato per risonanza
26
Meccanismo della formazione di acetali (continuazione)
Stadio 3: addizione nucleofila di una seconda molecola di alcol
al catione
Stadio 4: deprotonazione (eq. acido-base)
27
La reazione globale di formazione di acetali
Poiché si tratta di una reazione di equilibrio, si ha che:
un eccesso di alcol spinge
l’equilibrio verso la
formazione dell’acetale
la rimozione dell’acqua
favorisce la formazione
dell’acetale
28
Prochiralità del gruppo carbonilico
Quando il carbonio del gruppo carbonilico è sostituito da due gruppi diversi e il nucleofilo che
lo attacca è diverso da questi due gruppi esso diventa chirale nel prodotto di reazione. Per tale
motivo il carbonio carbonilico sp2 è detto prochirale
NC
C 2H5
HO
OH
C
O
C2H5 C
H
cianidrina
chirale(S)
H
C2H5
CN
C
H
cianidrina
chirale(R)
CN
Se nella molecola non ci sono altri centri chirali, come nel caso dell'esempio (propanale), i
due enantiomeri S e R si formano in quantità uguali perchè l'attacco sulle due facce del
carbonile avviene con uguale probabilità e quindi si ottiene una miscela racemica.
Gli enzimi sono in grado di distinguere gli attacchi sulle due facce
permettendo l'ottenimento di uno solo degli enantiomeri
29
Prochiralità del gruppo carbonilico
Se nella molecola è presente un altro centro chirale (supponiamo R), l' attacco sul carbonile
prochirale crea le due configurazioni R e S portando alla formazione di due molecole
diastereoisomeriche di cui una contiene i centri stereogenici (R,R) e l'altra i centri (R,S) per
cui non sono l'una l'immagine speculare dell'altra.
Pertanto si ottengono diastereoisomeri e non enantiomeri
NC
(S) OH
H
C
(R)
C
H
OH
HO
H
O
H
C
C
(R )
C
H
HOH2C
(R)
C
H
OH
CN
(R )
OH
HOH 2C
HOH2C
-
CN
diastereoisomeri
30