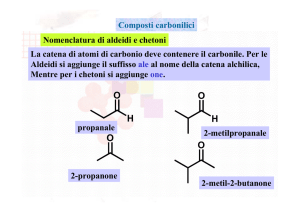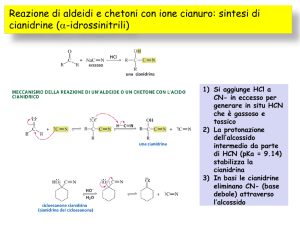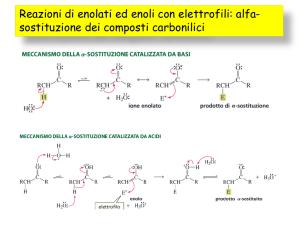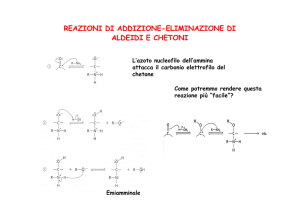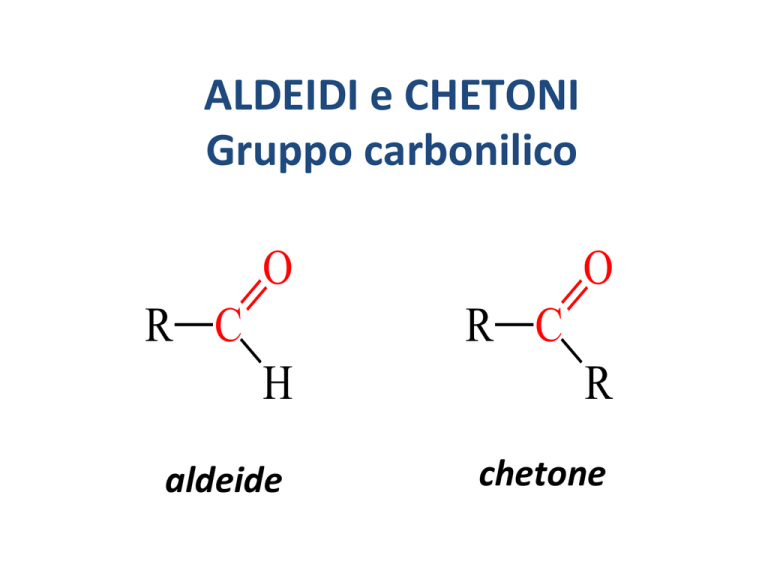
ALDEIDIeCHETONI
Gruppocarbonilico
O
R C
O
R C
H
R
aldeide
chetone
ALDEIDIeCHETONI
contengonoilgruppoCARBONILE
Nellealdeidièsuuncarbonioprimario
Neichetonièsuuncarboniosecondario
Reagen0eprodo2comuni
Ireagen0piucomuni:
• FormaldeideedAcetaldeide
• Acetone
Compos0naturali
Polarizzazionedelcarbonile
O
R C
O
R C
R
R
Risonanzafradueformelimite
δ-
δ+
Ilgruppocarbonile
IllegameC=Oèmoltopolarizzato:
Lapolaritàdellemolecolenediminuiscelavola0lità
rispeCoaglialcanicorrisponden0
legamiidrogeno:
Lemolecolenonpossono
darlimapossonoriceverli
(adesempiodall’acqua)
Proprietàfisichedialdeidisempliciechetoni
Reattività del gruppo carbonilico:
addizione nucleofila
PiùreaGvaunaldeideounchetone??
Nu:
LealdeidisonopiùreaGveperchéisos0tuen0alchilicisonogruppidonatoriche
diminuisconolaparzialecaricaposi0vasulcarboniocarbonilico.
Laminorerea2vitàdeichetoniderivaanchedaunmaggioringombrosterico.
Nu:
Addizionenucleofila
Gliacidicatalizzanol’addizionenucleofilaperprotonazione
dell’ossigeno
Addizionedialcoli:semiacetaliedacetali
Acetali
Inpresenzadiuneccessodialcolisemiacetalireagiscono
ulteriormentefornendogliacetali.
L'ossidriledelsemiacetalevienesos0tuitodaungruppoalcossile.Negliacetali
duefunzionietereesonopresen0sullostessoatomodicarbonio.
Ilmeccanismoconsisteneiduestadiseguen0:
Composti carbonilici
Stato fisico
Il gruppo carbonilico polare fa sì che le aldeidi e i chetoni siano composti
polari e hanno punti di ebollizione più alti dei composti apolari di P.M.
analogo. Essi non potendo dare legami H intermolecolari hanno punti di
ebollizione più bassi dei corrispondenti acidi carbossilici e alcooli.
Aldeidi alifatiche: ald. formica gassosa, acetaldeide liquida
Aldeidi aromatiche: benzaldeide liquida
Chetoni alifatici: primi termini liquidi poi solidi
Chetoni aromatici: tutti solidi
Solubilità
Le aldeidi e i chetoni sono poco solubili in H2O solo i primi termini, e molto
solubili nei solventi organici.
Laformaldeideèungas,polimerizzamoltofacilmenteedècommercializzatacometrimero
(triossano) o polimero (paraformaldeide) o come formalina (sol. acquosa al 37%)
disinfeCante e conservante. Viene u0lizzata per la produzione di materie plas0che,
materialiisolan0,legnosinte0co(formica)
Composti carbonilici
Caratteristiche chimiche delle aldeidi e dei chetoni.
Hanno proprietà chimiche molto simili eccetto:
1.
2.
3.
Le aldeidi si ossidano ad acido
Hanno potere riducente per la presenza del gruppo formilico
(l’acido formico è l’unico acido riducente)
Le aldeidi sono più reattive nei confronti della sostituzione
nucleofila per fattori elettronici e sterici
Addizione nucleofila
• Catalisi acida
Gli acidi catalizzano l’addizione nucleofila per protonazione dell’ossigeno
Addizionenucleofila
• Catalisibasica
NuH
+
OH
Nu
+ H2O
• Addizionediacqua
La reazione 0pica di aldeidi e chetoni è l’addizione nucleofila al carbonile.
Questa può essere meglio compresa esaminando con aCenzione il caso
piùelementare,l’addizionediacqua.
IfaCoricheinfluenzanol’addizionesonodidue0pi:eleCroniciesterici.
• I faNori eleNronici (donazioni di eleCroni) influenzano la stabilità del
doppiolegamecarbonio-ossigenoelaquan0tàdicaricaposi0vapresente
sulcarboniodelcarbonile.
• IfaNoristerici(ingombrosterico)condizionanosopraCuColastabilitàdel
prodoCo finale nel quale i sos0tuen0 sono più vicini tra loro visto che il
carboniodelcarboniledasp2diventasp3.
Percomprenderecomeagisconoques0faCoriconsideriamoleseguen0tre
molecole:
faNorieleNronici
O
H2O
H
O
H
H
OH2
HO
OH
H
H
H
formaldeide
formaldeideidrata
O
H2O
H3C
O
H3C
H
OH2
H
H3C
H2O
CH3
acetone
faNoristerici
H3C
OH
H
50%
acetaldeideidrata
acetaldeide
O
HO
99,9%
O
OH2
HO
H3C
CH3
H3C
OH
CH3
0,1%
acetoneidrato
gruppimeQliciCH3,piùingombranQdegliatomidiidrogeno
AldeidiaromaQche,comelabenzaldeide,sonomenoreaGvedellealdeidialifa0che.L’anello
aroma0costabilizzailcarboniledonandoeleCroniperrisonanza.
H
O
H
O
Labenzaldeide,comel’acetone,èidratatasoloallo0,1%inacqua.
Riconoscimento dei composti carbonilici
1. Formazione delle ossime
2. Formazione di 2,4-Dinitrofenilidrazoni
3. Reazione di Fehling
4. Reazione di Tollens
5. Reazione con dimedone
6. Formazione di composti bisolfitici
7. Saggio della fucsina (reazione di Schiff)
8. Reazione di Angeli e Rimini
9. Saggio dello iodoformio (reazione di Lieben)
Riconoscimento dei composti carbonilici
Formazione delle ossime
Saggio di riconoscimento per le aldeidi e per i chetoni. Il composto
carbonilico viene trattato con l’idrossilammina. La reazione può essere di
due tipi: catalisi acida e catalisi basica.
Catalisi acida
R
C
O
R
R
O
R
OH
R
NH2OH
R
NHOH
NH2OH
R
H+
R
OH2
NHOH
- H2O
R
NH-OH
R
R
-H+
R
N-OH
Riconoscimento dei composti carbonilici
• Formazione delle ossime: catalisi basica
NH2OH + OH
NHOH + H2O
R
C
R
O
R
NHOH
O + NHOH
R
H 2O R
R
OH2
-
NOH
- H2O
R
N-OH
R
+ OH
Ambientedireazione
Catalisi acida
Velocitàdireazione
Lareazioneèaduestadielavelocitàèinfluenzatadallostadiolento.
Il pH o2male deve essere circa 4,5; al disopra di tale valore l’addizione
dell’idrossilammina è rapida perché esiste nella forma libera ma la disidratazione,
secondo stadio è sfavorita. A pH più acido circa 2 l’idrossilammina è protonata e
l’aCaccosulcarboniocarbonilicoèlentomentreladisidratazioneèfavorita.
4,5
pH
Riconoscimento dei composti carbonilici
Formazione di 2,4-Dinitrofenilidrazoni
Saggio di riconoscimento per le aldeidi e per i chetoni. Il composto carbonilico viene
trattato con la 2,4-dinitrofenilidrazina in ambiente acido (HCl 2N) formando un
precipitato giallo o arancione, il 2,4-dinitrofenilidrazone che è un derivato cristallino.
R
O2N
NH
NH2 +
C
R
NO2
O
HCl
- H2O
R
O2N
NH
N
C
R
NO2
giallo
Formazione di 2,4-Dinitrofenilidrazoni
R
C
H+ R
O
R
R
C
OH
C
R
H2N-R
R
OH
R
R
C
R
-H2O R
R
OH2
C
NH2R
R
NHR
-H+ R
C
NHR
C
R
LareazioneèfavoritadaunabassaaciditàpH2
NHR
OH
Riconoscimento dei composti carbonilici
Reazione di Fehling
Saggio di riconoscimento per le aldeidi alifatiche, per gli α-ossichetoni, per gli
zuccheri riducenti. Il reattivo di Fehling è costituito da due soluzioni:
A (70 g/l CuSO4 in 1l di H2O)
B (364 g tartrato sodico potassico o sale di Seignette, 100g NaOH in 1l di H2O).
In questo reattivo viene aggiunta la sostanza in esame, si riscalda a b.m. e si forma
un pp. rosso-bruno di ossido di rameoso. Il reattivo ossidante è il Cu2+ che in
ambiente basico ossida le aldeidi ad acidi carbossilici. In ambiente basico il rame
potrebbe precipitare come idrossido ma viene mantenuto in soluzione dal tartrato
sodico potassico con cui forma un complesso
H
R
++
C
+ 2 Cu
O
-
+ 4 OH
T (b.m.)
R-COONa + 2 H2O + Cu2O
rosso bruno
Riconoscimento dei composti carbonilici
Reazione di Fehling
Complesso del tartrato con il Cu++ che lo mantiene in soluzione.
-
O-
OOC
O
-
O
O
O-
Cu
O
-
O
O
COO -
Riconoscimento dei composti carbonilici
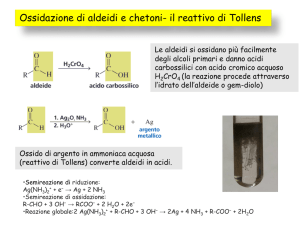
Reazione di Tollens
Saggio di riconoscimento per le aldeidi alifatiche, per gli α-ossichetoni, per
gli zuccheri riducenti, poliidrossifenoli, amminofenoli e diversi composti
riducenti. Il reattivo di Tollens è costituito da una miscela di volumi uguali
di AgNO3 e di NaOH che insieme danno un precipitato di AgOH. Il
precipitato viene ridisciolto con NH3 sotto forma di complesso ammoniacale.
Quest’ultimo reagisce con un’aldeide che si ossida mentre l’ Ag precipita
come argento metallico.
Reattivo di Tollens
AgNO3 + NaOH -> AgOH + NH3 -> [Ag(NH3 )2]OH
2 [Ag(NH3 )2]OH + RCHO -> RCOOH + 2Agâ+ 4 NH3 + H2O
specchio metallico
Riconoscimento dei composti carbonilici
Reazione con dimedone
Saggio di riconoscimento specifico solo per le aldeidi. Due molecole di
dimedone reagiscono con un’ aldeide mediante il processo di condensazione
ed eliminazione di H2O tra l’ossigeno del carbonile e due H dei gruppi
metilenici del dimedone. Il prodotto finale è un derivato delle aldeidi.
O
2
H3C
H3C
H
+ RCHO
O
O
R
O
H
CH
- H2O
H3C
H3C
CH3
O
O
la condensazione avviene nella posizione 2 più reattiva (malonica)
CH3
In ambiente acido con acido HCl diluito a caldo si ha disidratazione e
formazione di uno Xanten derivato
O
R
O
O
CH
H3C
H3C
O
O
R
O
CH
CH3
H3C
CH3
H3C
CH3
O
CH3
Anidride del Dimedone
Octaidro xanten derivato
Riconoscimento dei composti carbonilici
Formazione di composti bisolfitici
Saggio di riconoscimento per le aldeidi e per i metilchetoni che reagiscono con il
bisolfito (NaHSO3) mediante attacco nucleofilo da parte del doppietto elettronico dello
S al gruppo carbonilico.
R
H
C
O + NaHSO3
R
OH
R SO3Na Ac. α-idrossi solfonico
La presenza del gruppo carbonilico viene messo in evidenza dall’aggiunta della salda
d’amido colorata con iodio.
I2 + 2e -> 2ISO3= + H2O -> SO4= + 2e + 2H+
In assenza dell’aldeide la reazione avviene e lo iodio viene decolorato dal bisolfito.
Riconoscimento dei composti carbonilici
Saggio della fucsina (reazione di Schiff)
Saggio di riconoscimento specifico per le aldeidi.
La fucsina, di colore rosa, viene trattata con H2SO3 e diventa incolore per
perdita di delocalizzazione elettronica.
Se è presente un’aldeide reagisce con essa ottenendo un prodotto a
struttura chinoide con ripristinata delocalizzazione elettronica avente una
colorazione rosso-violetta.
Riconoscimento dei composti carbonilici
H2N
FUCSINA ROSA
NH2 Cl + 3 H2SO3
H2N
H2N
NHSO2H
HN
OH
SO3H
NHSO2CH
+ RCHO + HCl
INCOLORE
H2N
Ac.SolfonicoN-solfinico
ROSSO-VIOLA
H2N
+ SO2
+ H2Ol
R
Nonreagisconolavanillina,lapara-idrossibenzaldeide,lapara-amminobenzaldeide
elapara-dime0lamminobenzaldeideperchélapresenzadigruppiarilascio
disa2vailcarbonile
OH
NH2
CHO
CHO
OH
CHO
N
CHO
Alcunichetoni(me0lchetoni,ciclopentanone,cicloesanone)dannoleggeracolorazione
IlsaggiodeveessereeseguitoAFREDDOperevitarelaperditadiSO2ecomparsadi
colorazionegiàdalcompostointermedio
Riconoscimento dei composti carbonilici
Reazione di Angeli e Rimini
Saggio di riconoscimento valido per le aldeidi e per i benzilchetoni.
L’aldeide viene trattata con l’acido benzensolfonidrossamico (acido di
Piloty) in ambiente basico (NaOH) formando l’acido alchilidrossamico.
Quest’ultimo viene fatto reagire con FeCl3 in ambiente acido (HCl) per
dare l’idrossammato ferrico rosso.
R
SO2Ar
C
H
O +
R
O
N-OH
RCO-NHOH + ArSO2H
NOH
FeCl3
SO2Ar
R
N
H
O
R
N
O
+++
Fe
OH
O
N
O HO
R
Riconoscimento dei composti carbonilici
Saggio dello iodoformio (reazione di Lieben)
Saggio specifico per i metilchetoni, per l’etanolo, per l’acetaldeide e per gli
alcooli secondari. Il metilchetone reagisce con ipoiodito sodico per dare un αtriiododerivato che in ambiente basico (NaOH) si scinde in sale sodico
dell’acido e in iodoformio colorato in giallo (p. f. 128°C).
O
R
NaIO
C
R
C
CH3
R
CH2-I
C
NaIO
CHI2
O
O
R
O
O NaIO
R
C
-
CI3 + OH
C
OH
O
CI3
R
C
OH + CI3-
RCOO- + CHI3
La reazione è catalizzata dalle basi. L’H acido del metile in α viene strappato
dell’ambiente alcalino
O
O
R
CH2
R
CH2
OH
CH3
R
Stadio lento
O
Poi si ha l’attacco elettrofilo da parte dello iodio
I2
O
R
CH2I
+ I
Stadio veloce
La velocità della reazione è data dallo stadio lento ed è’ indipendente dalla concentrazione
dell’alogeno e dal tipo di alogeno.
La sostituzione degli atomi di iodio è favorita.
Saggio positivo per tutti i composti facilmente ossidati dallo iodio per dare metilchetoni.
Es: α-alcoli
La reazione non è data da composti del tipo CH3COCH2X, X= -NO2, -CN, COOR
→ Perché si usa l’ipoiodito e non ipoclorito o l’ipobromito di sodio?
La reazione avviene ugualmente ma il prodotto finale, cloroformio e bromoformio
rispettivamente, sono liquidi incolori e non facilmente caratterizzabili.
Saggio dello iodoformio (reazione di Lieben)
1- alcoli secondari
OH
R
NaIO
R
CH3
CH3
+ NaI + H2O
O
Ipoiodito è un leggero ossidante
chetone
2 NaIO + I2
NaIO + NaI + H2O
2- aldeide acetica
3- alcool etilico
OH
H2C
CH3
NaIO
ox
H
CH3
O
H
O
O
Anione formiato
+ CH3I
Reazione di Bayer-Villiger
Ossidazione dei chetoni con peracidi
R
F3C
R
O
R'
O
R
OH
O
+
R'
HO-O
O O C CF3
H
R'
O O C CF3
O
O
H+
F3C
O
HO
R
R
+
OH
R'-O
R'
OH
O O C CF3
OH
H+
R
O
R'-O
Si esegue poi il riconoscimento dell’estere con Angeli e Rimini
Fra R ed R’ migra il più nucleofilo cioè il più elettrondonatore
Reazione con 4-NH2-3-idrazino-5-mercapto-1,2,4- triazolo
Per aldeidi alifatiche ed aromatiche
NH2
NH2
N
NH
HS
+
N
N
O
HN
NH
N
N
N
NH
N
N
HS
R
H
- H2O
HS
N
N
R
R
N
N
N
S
S
N
N
aria
ox
Triazolo e tetra idro
idrazina
In ambiente alcalino
N
R
H
R
N
N
N
N
N
N
Vira al blu
N
N
Colorato in rosso
Derivati cristallini dei composti carbonilici
1. Azometine o basi di Schiff
2. Derivati idrazonici
3. Semicarbazoni o tiosemicarbazoni
4. Dimedon-derivati
5. Ossidazione delle aldeidi ad acido
Derivati cristallini dei composti carbonilici
Azometine o basi di Schiff
R'
R'
C
O + H2N-R"
C
N-R" + H2O
R
R
Derivati idrazonici (cristallizzabili)
R'
R'
C
R
O + H2N-NHR"
C
N-NHR" + H2O
R
R” = -C6H5
R” = -C6H4-NO2
R” = -C6H4(NO2)2
fenilidrazoni
p-nitro-fenilidrazoni
2,4 dinitro-fenilidrazoni
Semicarbazoni e tiosemicarbazoni
Per aldeidi a elevato PM
R'
O (S)
C
R
R'
O+
H2N NH
NH2
semi(tiosemi)carbazide
C
R
N-NH-CO(S)-NH2 + H2O
Dimedon-derivati (solo per le aldeidi)
La tautomeria chetoenolica, l’ambiente acido e il riscaldamento
portano alla eliminazione di acqua ovvero agli xantenderivati
O
R
O
O
CH
H3C
H3C
O
CH
CH3
O O
R
H3C
CH3
OH HO
H3C
CH3
Δ H+
O
R
CH3
-H2O
O
CH
H3C
H3C
CH3
O
CH3
Ossidazione delle aldeidi ad acido
5 R-CHO + H O
2
R-COOH + 2e + 2H+
2 MnO4 + 5e +8 H+
Mn+2 + 4 H2O
5 R-CHO + MnO4 + 6 H+
5 R-COOH + Mn+2 + 3 H2O
Aldeidecomereagente:Isoniazide