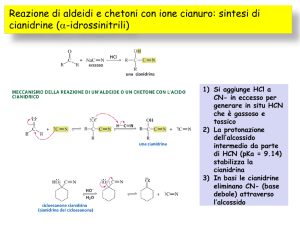
Aldeidi e chetoni
Struttura e proprietà
Nomenclatura e nomi comuni
Fonti
Reazioni
Principali aldeidi e chetoni
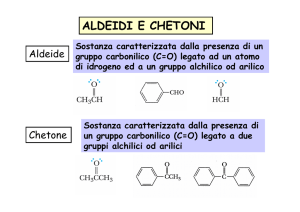
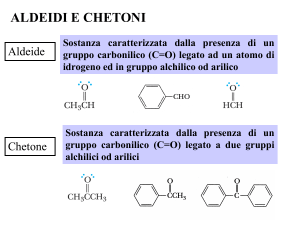
Aldeidi e chetoni
Aldeidi e chetoni
Aldeidi e chetoni
=O è costituito da un legame σ ed un legame
Il legame ⎯C
⏐
π, quindi il C del carbonile è ibridato sp2, con il legame π tra gli
orbitali p del Carbonio e dell'Ossigeno (lunghezza di legame
1.24 Å vs 1.43 Å dl legame singolo C⎯O).
R
o
HH
Aldeidi e chetoni
L'Ossigeno è molto elettronegativo e
conferisce una polarità al legame ⎯C=O.
δ+ δH3C
H3 C
H3C
O°°
°°
Forme di risonanza del carbonile
H3C
+
°°
O °°
°°
Per questa polarità, i composti carbonilici sono esposti all'attacco dei nucleofili sul C
del carbonile, a differenza di quanto accade con i C doppio legame (C=C) che, non
essendo polarizzato, si presta all'attacco degli elettrofili.
Polarizzazione del carbonile
O
R C
O
R C
R
R
Risonanza fra due forme limite
dd+
Il gruppo carbonile
Il legame C=O è molto polarizzato:
La polarità delle molecole ne diminuisce la
volatilità rispetto agli alcani corrispondenti
legami idrogeno:
Le molecole non possono
darli ma possono riceverli
(ad esempio dall’acqua)
Aldeidi
La polarizzazione del carbonile influenza la solubilità di aldeidi
e chetoni, ed infatti i composti a basso peso molecolare, pur
non potendo fare legami idrogeno tra loro, possono accettare
legami idrogeno da altri gruppi contenenti i gruppi OH o NH.
Aldeidi e chetoni
Aldeidi e chetoni
Aldeidi e chetoni
Proprietà fisiche di aldeidi semplici e
chetoni
Aldeidi e Chetoni
• Contengono il gruppo carbonilico
• Il gruppo carbonilico ha una geometria planare con
polarità inferiore al gruppo OH
• Vengono preparati in laboratorio principalmente per
ossidazione degli alcoli
• I nomi IUPAC delle aldeidi hanno il suffisso ALE
• I nomi IUPAC dei chietoni hanno il suffisso ONE
• L’aldeide più semplice è il metanale
CH2O o formaldeide (o aldeide formica),
un gas incolore, irritante, pungente e
solubile in acqua
• Il chetone più semplice è il propanone
CH3COCH3, o acetone, un liquido
incolore dall’odore gradevole, volatile e
infiammabile, utilizzato come solvente o
per la sintesi di materie plastiche,
vernici, esplosivi, etc.
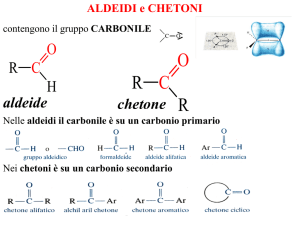
ALDEIDI e CHETONI
contengono il gruppo CARBONILE
Nelle aldeidi è su un carbonio primario
Nei chetoni è su un carbonio secondario
Il nome delle aldeidi si costruisce facendo seguire la
desinenza -ale al nome dell’idrocarburo saturo ad ugual
numero di atomi di carbonio.
O
H
O
H C
H3C C
H
metanale
aldeide formica
H H
H3C C C C
H H
butanale
aldeide butirrica
H
etanale
aldeide acetica
O
H3C C C
H
H CH3
O
H
propanale
aldeide propionica
O
H C C C
H
H H
H
metilpropanale
aldeide metilpropionica
La vecchia nomenclatura (ancora in uso) è riportata in corsivo sotto
la nomenclatura IUPAC.
Nomenclatura
Nelle aldeidi la desinenza e’ -ale
Per i chetoni il nome si costruisce facendo seguire la
desinenza -one al nome dell’idrocarburo saturo ad ugual
numero di atomi di carbonio.
O
H3C
C
CH3
propanone
O
H3C C
CH2CH3
butanone
O
H3C C
CH2CH2CH3
2-pentanone
Nomenclatura
Nei chetoni la desinenza e’
Il gruppo sostituente RCO- è chiamato alcanoile
-one
o acile
Nomenclatura
Quando un chetone è un sostituente in catena si riferisce ad esso
come gruppo osso.
O
O
5
1 H
esanale
5-ossoesanale
Mentre quando l’aldeide è il sostituente di un anello ci si riferisce
ad essa come carbaldeide
O
H
cicloesancarbaldeide
Nomenclatura
Se il gruppo carbonilico viene considerato il sostituente in una catena
ci si riferisce come gruppo acilico ed il nome è formato dal suffisso il.
O
O
H
Me
acetil
formil
O
benzoil
Composti naturali
Aldeidi e chetoni
Nomenclatura delle aldeidi
C Trovare la catena più lunga di
atomi di carbonio contenente il
gruppo aldeidico.
C Sostituire l’ultima lettera –o con
il suffisso –ale.
C Tutti i sostituenti ed i gruppi
seguono la nomenclatura IUPAC
standard.
Aldeidi e chetoni
Esempi
Butanale
3-bromopentanale
3,3-dimetilpentanale
3-iodo-3-metilbutanale
4-iodo-3-metilbutanale
Aldeidi e chetoni
?
Aldeidi e chetoni
Aldeidi e chetoni
Nomenclatura dei Chetoni
C Trovare la catena più lunga di atomi di
carbonio contenente il gruppo C=O (non
deve trovarsi ad una estremità altrimenti
si tratta di una aldeide).
C Sostituire l’ultima lettera –o con il
suffisso –one.
C Il carbonio più vicino al carbonile ha il
numero più basso.
C Tutti i sostituenti ed i gruppi seguono la
nomenclatura IUPAC standard.
Chetoni
Chetoni
Aldeidi e chetoni
Aldeidi e chetoni
Fissativo per istologia
Postumi dell’ubriacatura
Olio di mandorle
Semi di vaniglia
Aldeidi e chetoni
Aldeidi e chetoni
Aldeidi e chetoni
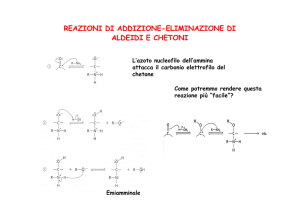
A causa della polarità del legame C=O, i composti carbonilici sono esposti all'attacco
dei nucleofili sul C del carbonile, a differenza di quanto accade con il doppio legame
C=C che, non essendo polarizzato, si presta all'attacco degli elettrofili.
Reazione di addizione nucleofila tra un’aldeide e un’ammina
che porta alla formazione di derivati metilenici secondo la
reazione:
La reazione descritta per una generica ammina è possibile pure nel
caso del collagene coinvolgendo i gruppi amminici laterali. Quando
l’aldeide introdotta reagisce con due catene polipeptidiche
diverse si avrà la reticolazione e quindi un effetto cross-linking.
Supponendo che si faccia reagire l’aldeide formica con il collagene
la reazione sarà del tipo:
La formula della glutaraldeide è
essa presenta due gruppi aldeidici ed è
quindi in grado di reagire con due gruppi
amminici secondo una reazione del tipo:
Preparazione delle aldeidi
ossidazione (deidrogenazione)
H
R
CH2
ALCOL
PRIMARIO
OH
OX
R
C
ALDEIDE
O
Preparazione dei chetoni
ossidazione (deidrogenazione)
R’
R
’
R
CH
OH
ALCOL
SECONDARIO
OX
R
C
CHETONE
O
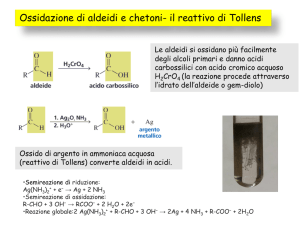
Le aldeidi si ossidano ad acidi carbossilici, mentre l’ossidazione dei
chetoni si produce soltanto in condizioni di reazione molto energiche
(con rottura di legami C-C).
Se è presente un gruppo alcolico primario in posizione a rispetto al
gruppo carbonilico, anche i chetoni possono essere ossidati, in ambiente
basico.
H
CH3CH2
C
H3C C
Cu2+
O
H
O
Ag+
NaOH, tartrato di sodio
H2O
NH3
H2O
O
CH3CH2
O
H3C C
OH
C
OH
Ag
Cu2O
Ossidazione di aldeidi
• L’ossidazione delle aldeidi
produce un acido carbossilico,
anche con ossidanti deboli (Ag+,
Cu2+)
H
R
C
O
ox
OH
R
C
O
Riduzione di aldeidi mediante
addizione di idrogeno al doppio legame
C=O
• Ad elevate P e T in presenza di un
catalizzatore e di un riducente, il
doppio legame viene trasformato in
legame semplice con l’aggiunta di atomi
di idrogeno
H
H
R
C
+ 2LiH
O
rid
P e T
elevate
Ni in
polvere
R
C
OH
H
ALCOL PRIMARIO
Ossidazione di chetoni
• Per ossidazione i chetoni si spezzano nel punto in cui
e’ presente il doppio legame formando acidi
carbossilici. Ciò avviene solo in presenza di un
ossidante molto energetico (acido nitrico, es.) e di un
catalizzatore
Cicloesanone à acido adipico (COOH-CH2CH2CH2CH2-COOH)
Riduzione di chetoni mediante addizione di
idrogeno al doppio legame C=O
• Ad elevate P e T in presenza di un
catalizzatore e di un riducente, il doppio
legame viene trasformato in legame semplice
con l’aggiunta di atomi di idrogeno
R’
R’
R
C
CHETONE
O
+ 2LiH
rid
P e T
elevate
Ni in
polvere
R
C
OH
H
ALCOL SECONDARIO
Reattività del gruppo carbonilico:
addizione nucleofila
Più reattiva un aldeide o un
chetone??
Nu:
Nu:
Le aldeidi sono più reattive perché nei chetoni i sostituenti alchilici sono
gruppi donatori che diminuiscono la parziale carica positiva
sul carbonio carbonilico.
La minore reattività dei chetoni deriva anche da un maggior ingombro sterico.
Addizione nucleofila
Gli acidi catalizzano l’addizione nucleofila per
protonazione dell’ossigeno
Semiacetali e acetali
Le reazioni che portano alla formazione di semiacetali
e acetali sono molto importanti, in quanto sono la
chiave di comprensione della chimica dei carboidrati.
Gli alcoli sono nucleofili all’ossigeno e possono
attaccare il C carbonilico delle aldeidi e dei chetoni
portando a prodotti saturi di addizione al legame C=O.
Semiacetali
I semiacetali sono ottenuti per addizione di un alcol con una
aldeide e poiché l’alcol è un nucleofilo debole, è necessario di
solito un catalizzatore acido.
Sono composti che hanno un C che porta sia l'ossidrile della
funzione alcolica (OH) che la funzione eterea (⎯OR).
R⎯OH
+
R'
⏐
C=O
⏐
H
H+
OR
⏐
R'⎯C⎯OH
⏐
H
Semiacetale
Addizione di alcoli:
semiacetali ed acetali
Semiacetali ciclici
Composti con un gruppo aldeidico e un ossidrile a distanza appropriata
all’interno della stessa molecola sono in equilibrio col semiacetale ciclico che
si forma per addizione nucleofíla intramolecolare.
L'ossidrile si trova in posizione favorevole per poter agire da nucleofilo
sul carbonio con un meccanismo specifico.
Semiacetali
L’addizione è un processo reversibile.
I semiacetali si formano con un meccanismo a 3 stadi:
+
R'
°°
O
°°
H
Aldeide
H
_
+
H
Catalizz.
R'
+
°°
OH
H
Aldeide protonata
+°° H
°°
ROH
°°
RO
R'
- ROH
H
+
°°
OH
°°
Semiacetale protonato
dal catalizzatore
La continuazione della reazione in eccesso di alcol
porta alla formazione di un ACETALE
H
_ H+
RO
R'
H
OH
°°
Semiacetale
Semiacetali
I semiacetali con gruppo aldeidico e ossidrile a distanza
appropriata sulla stessa molecola, sono in equilibrio con il
semiacetale ciclico prodotto per addizione nucleofila
intramolecolare.
H2
C
C
H
°°
OH
°°
H2C
C
H2
H2
C
O
C
H2
5-idrossipentanale
OH
CH
+
O
°°
H2C
C
H2
H
C
H2
Forma semiacetalica del 5-idrossipentanale
H2 OH
C CH
O
H2C
C C
H2 H2
Acetali
In presenza di un eccesso di alcol i semiacetali reagiscono
ulteriormente fornendo gli acetali.
L'ossidrile del semiacetale viene sostituito da un gruppo alcossile.
Negli acetali due funzioni eteree sono presenti sullo stesso
atomo di carbonio.
OH
O
O
C OH
C
O
H
H
H
R
C
si ottengono due emiacetali enantiomeri
C
C
O
OH
O
H
C H
OH
S
Acetali
Sono composti che hanno un C che porta su di se due funzioni eteree (⎯OR)
OR
⏐
R'⎯C⎯OH
⏐
H
Semiacetale
+ ROH
H+
OR
⏐
R'⎯C⎯OR + H2O
⏐
H
Acetale
Il meccanismo consiste nei due stadi
seguenti:
Acetali
Questo meccanismo avviene in due stadi:
RO
R'
H
°O° H
°°
S e m ia c e t a le
H +
-H +
RO
R'
H
+
°O° H
H
- H
+ H
2
2
R'
O
O
C a ta l iz z a t o r e
+
+
°°
RO
°°
RO
°°
H
R'
H
C a r b o c a t i o n e s t a b il i z z a t o p e r r i s o n a n z a
-R O H
RO
R'
H
°O° R
°°
-H +
H+
ROH
RO
R'
H
+
°O° R
H
A c e ta le
Ogni passaggio è reversibile.
La protonazione dell’Ossigeno dell’ossidrile porta alla
stabilizzazione per risonanza del carbocatione.
Il legame chimico alla base della polimerizzazione di
zuccheri semplici è un legame acetalico
O
R C
H
OH
R'OH
R C OR'
H
L’equilibrio della reazione di formazione
dell’emiacetale è quasi completamente spostato a
sinistra.
(In assenza di un catalizzatore acido non si può verificare la reazione
dell’emiacetale con la seconda molecola di alcole (che è una sostituzione
nucleofila) e quindi non si forma l’acetale.)
Tautomeria cheto-enolica
Aldeidi e chetoni possono esistere all’equilibrio nelle due forme chetonica ed
enolica, che differiscono per la posizione di un protone e per un doppio legame.
Questa isomeria si chiama tautomeria, le forme vengono dette tautomeri e sono due
particolari isomeri di struttura che si pongono in equilibrio tra loro.
Un composto carbonilico, per poter esistere in forma enolica, deve avere un atomo di
idrogeno legato all’atomo di carbonio adiacente al carbonile (carbonio α).
⏐
⎯Cα⎯C⎯
⏐ ║
Hα O
CH3-C-CH3
║
O
Forma Chetonica
H
H
O
CH2=C-CH3
⏐
OH
Forma Enolica
HO
Tautomerismo Cheto-Enolico
• un carbonio adiacente a un gruppo
carbonilico è chiamato carbonio-α, e
un idrogeno legato ad esso è un
idrogeno-α.
α- hydrogens
O
CH 3 - C- CH 2- CH 3
α- carbons
Tautomerismo Cheto-Enolico
Un composto carbonilico con un
idrogeno-α è in equilibrio con un
isomero chiamato enolo (en da
alchene + olo da alcohol)
• Può formare lo ione enolato
O
OH
C H3 - C - C H3
C H 3 - C =C H 2
Acetone
(keto form)
Acetone
(enol form)
O
H
H
C
C
H
H
C
H
H
OH
H
H
C
H
Tautomeria cheto-enolica
C
C
H
H
OH
O
H
C
C
H
H
H
H
C
Movimento concertato di elettroni e protoni intramolecolare
C
H
H
Tautomeria Cheto-Enolica
Aldeidi e chetoni possono esistere all'equilibrio come miscela di due
forme: chetonica ed enolica.
Le due forme differiscono per la posizione di un protone e di un doppio
legame e vengono dette tautomeri:
2,4-pentanedione: forma enolica
stabilizzata da H-bond
H
H
H
H
O
O
H
forma carbonilica
(etanale)
H
H
C C
H C C
H C C
H
H
OH
forma enolica
(alcol vinilico)
Tautomerismo Cheto-Enolico
Gli equilibri
per aldeidi
semplici
stanno
dalla parte
della
forma
chetonica
Keto form
O
CH 3 CH
% Enol at
Eno l form Equilibrium
OH
CH 2 =CH
6 x 10-5
OH
O
C H 3 CC H 3
O
CH 3 C =CH 2 6 x 10-7
OH
4 x 10-5
Tautomerismo Cheto-Enolico
• Il tautomerismo è catalizzato dagli
acidi. Step 1: trasferimento di
protone da H-A
+
••
••
O
••
O
H- A
C H 3 - C -C H 3 +
A-
••
C H 3 - C-C H 3 +
keto form
fast
H
the conjugate acid
of the ketone
Step 2: trasferimento di protone a A+ •• H
O
OH
••
+
A-
••
CH 3 - C-CH 2 - H
••
slow
CH 3 - C=CH 2
Enol form
+
H- A
Condensazione aldolica
L’acetaldeide reagisce con NaOH diluito a dare un dimero: il 3idrossibutanale, che è un aldolo (aldeide + alcol)
L’aldolo per riscaldamento si può disidratare a dare
un alchene, in cui il doppio legame è coniugato con
quello carbonilico
1)
H
Hα C
C
H
H
OH-
H
O
C
H2O
H
C
H
H
O
H
C
C
H
O
Nella prima tappa si produce un anione enolato ...
2)
H
H C
C
H
H
H
C
O
H
C
H H H
H
H C
O
C
C
H O H
…che nella tappa successiva compie un attacco nucleofilo su
una seconda molecola di aldeide.
H H H
3)
H C
C
C
H O H
C
H
O
H2O
OH-
H H H
H C
C
C
H OH H
Nell’ultima tappa della reazione si forma una β-idrossialdeide.
C
H
O
C
H
O