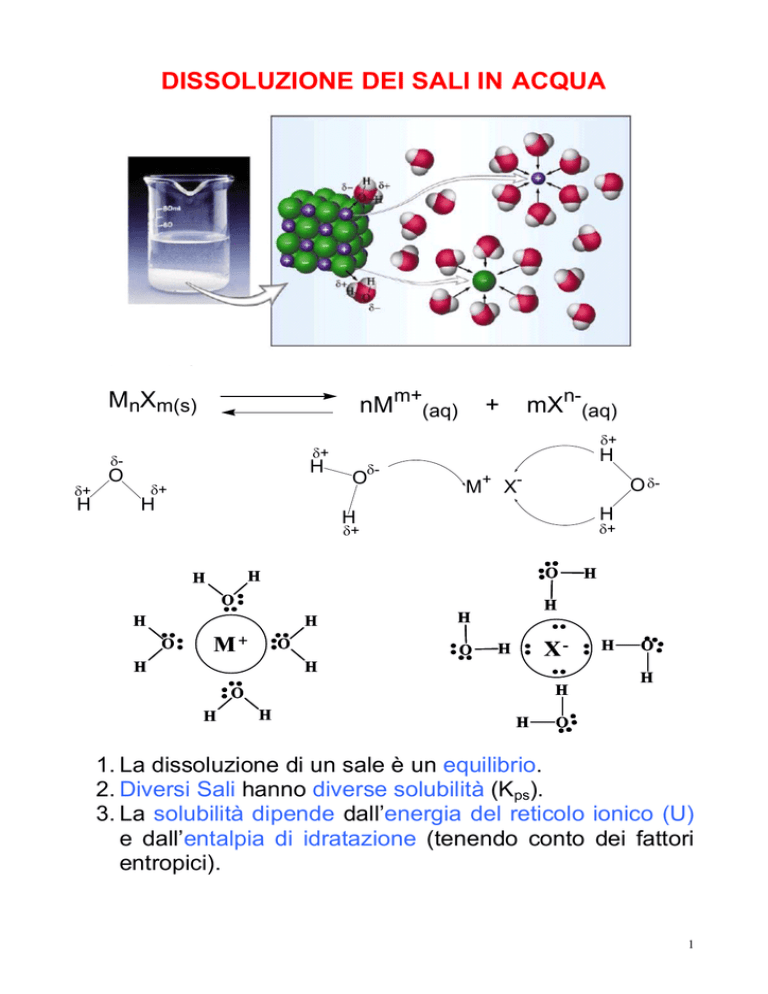
DISSOLUZIONE DEI SALI IN ACQUA
M+(aq)
MX(s)
nMm+(aq)
MnXm(s)
δ+
H
H
O
δ+
H
mXn-(aq)
+
δ+
δ+
δ-
X-(aq)
+
δ-
O
H
M+ X-
O δH
H
δ+
δ+
O
H
H
O
H
H
O
M+
O
H
H
O
X-
H
H
H
H
O
H
H
H
H
H
O
H
O
1. La dissoluzione di un sale è un equilibrio.
2. Diversi Sali hanno diverse solubilità (Kps).
3. La solubilità dipende dall’energia del reticolo ionico (U)
e dall’entalpia di idratazione (tenendo conto dei fattori
entropici).
1
Idratazione dei cationi
M+(aq)
O
O
H
H O
H
H
n = 6, 4
H
H
O H
M
O
[M(H2O)n]+
+
H
H
H
=
H
MX(s)
MX(s) + nH2O
H
O H
H
O
M
O
O
H
O
H
H
M+(aq)
+
+
H
H
H
X-(aq)
[M(H2O)n]+
+
X-(aq)
Le molecole di H2O direttamente coordinate allo ione
definiscono la sua prima sfera di coordinazione.
Altre molecole di H2O si dispongono attorno a questa
prima sfera, formando una seconda sfera di
coordinazione, poi una terza e così via. La forza di
interazione tra lo ione centrale e le molecole di H2O ha
natura coulombiana, e quindi decresce rapidamente con la
distanza. Di solito si considera solo la prima sfera di
coordinazione, che ha una geometria ben definita e
generale (vedi sopra).
2
ΔH di idratazione di un catione
Mn+(g) + H2O(l)
[M(H2O)x]n+
Dipende dalla carica ionica, dal raggio del catione e dalla
sua elettronegatività.
3
Eq. Latimer per metalli con elettronegatività moderata (χP<
1.5). La χP dei Mn+ si discosta al max di 2 unita’ rispetto
all’ossigeno (χP = 3.44).
60900Z 2
Δ H hyd = −
kJ /mol
(r + 50)
Z = carica catione
r = raggio cationico (in pm)
Per (χP > 1.5) a parità di Z e r, ΔH maggiori.
NaCl: Uret. = -788 KJ mol-1, p.f. = 801 °C, ΔHidr = -405 KJ
mol-1
4
I cationi sono più piccoli degli atomi da cui derivano.
Gli elettroni rimasti sono più attratti dal nucleo.
5
PROPRIETA’ ACIDO BASE DELL’ACQUA
H2O
H+(aq) + OH-(aq)
2H2O
H3O+(aq) + OH-(aq)
Kw = 10-14
pH = 7 in condizioni di neutralità (acqua pura)
pH sperimentale dell’acqua distillata è acido (ca. 5.5)
La causa è la CO2 disciolta che è sempre presente
nell’ambiente.
CO2(g)
CO2(aq) + 2H2O
KA1 =
HCO3-(aq) + H3O+(aq)
[HCO3-(aq)][H3O+(aq)]
[CO2(aq)]
HCO3-(aq) + H2O
KA2 =
CO2(aq)
= 4.16x10-7
pKA1 = 6.38
CO32-(aq) + H3O+(aq)
[CO32-(aq)][H3O+(aq)]
[HCO3-(aq)]
= 4.76x10-10
pKA2 = 9.32
6
IDROLISI DEI CATIONI
H
H
O
O
M+
H
H
H
O
H
+
H
O
H
M+
H
H
H
O
H
OH
O
H
H
M+
O
O
H
H
H
O
H
H
H
M+
O
H
+
H
H
O
H
O
O
H
M
H
H
O
O
+
H
H
H
H
La coordinazione al metallo fa aumentare l’acidità dei
protoni dell’acqua. Si ha quindi idrolisi acida con
conseguente abbassamento del pH. Nel caso di ioni a
carica multipla, si possono avere successive reazioni di
solvolisi e idrolisi, fino ad arrivare a precipitazione dei relativi
idrossidi.
M+(aq) + H2O
M(OH)(aq) + H+(aq)
Mn+(aq) + H2O
[M(OH)](n-1)+(aq) + H+(aq)
[M(OH)](n-1)+(aq) + H2O
[M(OH)2](n-2)+(aq) + H+(aq)
M(OH)n
7
Idrolisi: parziale rimozione di protoni da uno ione idratato;
aumenta all’aumentare della carica (Z),
aumenta all’aumentare dell’elettronegativita’ (χ)
aumenta al diminuire del raggio (r) dello ione metallico
[M(H2O)6]z+ + H2O
[M(H2O)5(OH)](z-1)+ + H3O+
es.: [Al(H2O)6]3+ + H2O
[Al(H2O)5OH]2+ +H3O+
pKa = 5 come l’acido acetico
8
9
z[M(aq)(OH)](z-1)+
M(OH)z(s) + (z-1)[M(aq)]z+
es.: 3[Al(aq)OH]2+
↓Al(OH)3(s)
+
K ≈ 105.6
2[Al(aq)]3+
precipitato gelatinoso
pH = pKa - (1/z)log[Mz+] - 5.6/z
Tanto più è basso il pKa di un dato ione metallico, tanto
meno la soluzione deve essere basica perchè l’idrossido
metallico cominci a precipitare.
10
Disidratazione degli idrossidi
Spesso gli idrossidi metallici perdono molecole d’acqua
dando ossidi insolubili:
M(OH)z(s)
MOz/2(s) + (z /2)H2O
2M(OH)z (s)
M2Oz(s) + zH2O
Spontanea nel caso di idrossidi contenenti cationi di
metalli pesanti (es. Ag+, Hg2+)
2Ag+(aq)
+2NaOH
2Ag(OH)(s)
- H2O
giallo
Ag2O(s)
bruno-scuro
Negli altri casi è richiesto riscaldamento (calcinazione)
2Al(OH)3(s)
2Fe(OH)3(s)
Δ
- 3H2O
Δ
Al2O3(s)
Allumina
Fe2O3(s)
- 3H2O
Si può pure avere una disidratazione parziale
Fe(OH)3(s)
- H2O
FeO(OH)(s)
Nel caso di Fe(III) è molto discusso se quello che precipita
sia Fe(OH)3 o FeO(OH).
11
Formazione di ossoanioni
Se l’attrazione dello ione metallico per la coppia di elettroni
sull’ ossigeno e’ sufficientemente forte, i gruppi idrossido
dell’idrossido metallico possono iniziare a perdere gli
idrogeni restanti sotto forma di ioni idrossonio:
M(OH)z + zH2O
MOzz- + zH3O+
Così l’idrossido metallico può reagire come un debole
ossoacido a formare un ossoanione.
12
- Effetti dell’elettronegatività sull’idrolisi
Se χP >1.5 i cationi diventano più acidi di altri ioni metallici
aventi Z e r simili. L’equazione
Se l’elettronegatività χP di uno ione metallico è ≥ 1.5 lo ione
va spostato di una categoria nell'acidità.
13
pKa 14-15 Cationi non-acidi: ioni +1 del blocco s. (Es:
Cs+, Rb+ idrolisi non misurabile: i loro idrossidi non
precipitano, sono deliquescenti all’aria umida, sottraendo
acqua all’aria per formare una soluzione).
pKa 11-14 Cationi debolmente acidi: ioni +2 dei blocchi
s (Es: Li+, Ba2+, Sr2+, Ca2+ idrossidi non precipitano ma sono
meno solibili di quelli dei cationi non acidi)
pKa 6-11
Cationi scarsamente acidi: Mg2+, M2+ del
blocco d. Gli idrossidi precipitano in soluzioni neutre o
debolmente basiche.
pKa 1-6
Cationi moderatamente acidi: Al3+, M3+ del
blocco d. Le soluzioni sono acide (valori di pKa simile
all’acido acetico). Gli idrossidi precipitano in soluzioni anche
a pH < 7.
pKa (-4)-1 Cationi fortemente acidi: Ti4+ (in realtà
TiO2+), questi cationi reagiscono violentemente con acqua
14
generando soluzioni fortemente acide e grosse quantità di
precipitato di ossido o idrossido di metallo insolubile che si
ridiscioglie solo in HCl conc.
pKa < (-4) Cationi molto fortemente acidi: Z2/r > 0.22
reagiscono irreversibilmente con l’acqua a formare idrossidi
o ossoanioni.
Z2/r di C4+ è 0.533 tuttavia la prevista reazione esplosiva tra
CCl4 e l’acqua in realtà non avviene.
L’atomo di carbonio è circondato dai quattro grandi atomi di
cloro; la molecola d’acqua non riesce ad entrare e dare il
via alla reazione. Anche se la velocità di reazione tra acqua
e tetracloruro di carbonio è trascurabile a temperatura
ambiente, è pur vero che i prodotti finali della loro
lentissima reazione (CO2 e 4HCl) sono più stabili dei
reagenti (CCl4 e H2O) di 52 kJ.
15
Riassumendo
Elementi del blocco s (metalli alcalini ed alcalino-terrosi): Il
rapporto carica/raggio è basso, quindi idrolisi trascurabile o
molto leggera. Fa eccezione il Be2+, che date le piccole
dimensioni ha una idrolisi notevole.
Metalli di transizione: Difficile generalizzare, data l’ampia
varietà di dimensioni e possibili stati di ossidazione (e quindi
cariche formali) degli elementi. Si va da ioni con idrolisi
leggera (es. Zn2+) ad alcuni che danno un’idrolisi così
estesa che non esistono mai come tali (es. Ti4+ che in
soluzione esiste per lo più come ione titanile [TiO]2+(aq)
anche se in concentrazioni molto basse, visto che esso in
prevalenza precipita a dare TiO2; oppure Mn7+ che esiste
come permanganato MnO4-).
Elementi del blocco p: Le cariche sono elevate quindi
l’idrolisi è quasi sempre molto forte (es. Al3+). Molto spesso
dato l’alto valore del rapporto carica/raggio, questi ioni non
esistono per niente come tali, ma sempre come ossanioni o,
più in generale, considerata l’elettronegativita’ elevata, in
composti contenenti forti legami covalenti (es. CO32-, NO3-,
SO42-, PO43-)
16