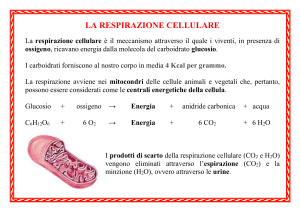
Soluzioni del compito del 16 Settembre 2014
Esercizio 1
A +2
1
Δy = x 2 dx =
x
A 1
A 2
Esercizio 2
1
d 1
=
dx x A
( x A) 2
x3
1
A2
ln x
( A 2) 3 ( A 1) 3 ln
3
3
A 1
A1
Esercizio 3
Nomenclatura di B, (B+1), (B+2):
0) Mg(HCO3)2 Bicarbonato di Magnesio
1) Mn3(PO4)2 Ortofosfato di Manganese
2) FeSO4
Solfato di Ferro (II)
3) NH4Br
Bromuro di Ammonio
4) Cu(OH)2 Idrossido di Rame (II)
5) ZnS
Solfuro di Zinco
6) NH4NO2 Nitrito di Ammonio
7) HPO3
Acido metafosforico
8) Cs2SO3
Solfito di Cesio
9) CF4
Tetrafloruro di Carbonio
10) NaClO3
Clorato di Sodio
11) K2Se
Seleniuro di Potassio
Esercizio 4
𝑚𝑡𝑜𝑡 = 𝑚𝐺 + 𝑚𝑊 ;
𝑛𝐺 =
𝑚𝐺
𝑀𝑀𝐺
; 𝑋𝐺 =
𝑚
𝑐% = 𝑚 𝐺 × 100 ;
𝑚𝐺
𝑀𝑀𝐺
𝑚𝐺
𝑚
+ 𝑊
𝑀𝑀𝐺 𝑀𝑀𝑊
𝑡𝑜𝑡
=
Ioni B, (B+1), (B+2): indicare formula e carica
0)
Solfuro
S21)
Metafosfato
PO32)
Ammonio
NH4+
3)
Ipoiodito
IO4)
Permanganato MnO45)
Bromato
BrO36)
Cianuro
CN7)
Solfito
SO328)
Ortofosfato
PO439)
Perclorato
ClO410) Floruro
F11) Idruro
H𝑐%
𝑚𝐺 = 𝑚𝑡𝑜𝑡 × 100 ;
1
100−𝑐% 𝑀𝑀𝐺
1+
×
𝑐%
𝑀𝑀𝑊
=
𝑐%
𝑚𝑊 = 𝑚𝑡𝑜𝑡 × [1 − 100]
𝑐%
1000−9𝑐%
Esercizio 5
𝑛
𝑛
𝑛
𝑝𝐻 = 𝑝𝐾𝑎 − 𝑙𝑜𝑔10 𝑛𝑎; 𝑙𝑜𝑔10 ( 𝑛𝑎)𝑖 = −( 7.5 − 6) = −1.5 ; 𝑙𝑜𝑔10 ( 𝑛𝑎)𝑓 = −( 9 − 6) = −3
𝑠
𝑠
𝑠
𝑛𝑠 = (𝐴 + 1) × 10𝑚𝐿 × 10−2 𝑀 = 0. (𝐴 + 1)𝑚𝑚𝑜𝑙𝑖; 𝑛𝑎,𝑖 = 𝑛𝑠 × 10−1.5 ; 𝑛𝑎,𝑓 = 𝑛𝑠 × 10−3
𝑛(𝐶𝑂2 ) = 𝑛𝑎,𝑖 − 𝑛𝑎,𝑓 = 0. (𝐴 + 1) × (10−1.5 − 10−3 ) = (𝐴 + 1) × 0.0031𝑚𝑚𝑜𝑙𝑖
Esercizio 6
0)
3 Cl2 + 2 Al(OH)3 Al(ClO)3 + AlCl3 + 3 H2O
1)
3 LiClO4 + 8 Au + 24 HCl 8 AuCl3 + 3 LiCl + 12 H2O
2)
2 Cl2 + 2 Ca(OH)2 Ca(ClO)2 + CaCl2 + 2 H2O
3)
3 CO + Na2Cr2O7 + 4 H2SO4 3 CO2 + Cr2(SO4)3 + Na2SO4 + 4 H2O
4)
S8 + 24 H2O2 8 H2SO4 + 16 H2O
5)
3 H2O2 + 2 KMnO4 + 2 HNO3 2 MnO2 + 3O2 + 2 KNO3 + 4 H2O
6)
N2O + 4 H2O2 + 2 KOH KNO3 + 5 H2O
7)
MnO2 + H2O2 + 2 KOH K2MnO4 + 2 H2O
8)
3 KCN + 10 K2CrO4 + 44 HCl 3 KNO3 + 3 K2CO3 + 10 CrCl3 + 14 KCl + 22 H2O
9)
CH4 + 4 H2O2 + 2 KOH K2CO3 + 7 H2O
10)
PH3 + 4 K2MnO4 + H2O 4 MnO2 + K3PO4 + 5 KOH
11)
Ca(OH)2 + 2 NO + 3 H2O2 Ca(NO3)2 + 4 H2O
Esercizio 7
𝑑Δ𝐻
Δ𝐻 = 𝐻(𝑙) − 𝐻(𝑠) ; 𝑑𝑇 = 𝐶𝑝 (𝑙) − 𝐶𝑝 (𝑠) ; Δ𝐻(𝑇) = Δ𝐻(𝑇1 ) + Δ𝐶𝑝 (𝑇 − 𝑇1 )
T1 = 0°C
Δ𝐻(𝑇) = [6.02 10−3 + 8.31(9.06 − 4.72) × (𝑇 − 0)]𝐽𝑜𝑢𝑙𝑒𝑠
Δ𝐻(𝑇) = [6.02 10−3 − 36.065 × (𝐴 + 2)]𝐽𝑜𝑢𝑙𝑒𝑠
Esercizio 8
𝑛𝐺 = 0.05 𝑚𝑜𝑙𝑖 ; 𝑛𝑁𝑎𝐶𝑙 = 0.05 𝑚𝑜𝑙𝑖
[𝑛𝐺 + 2𝑛𝑁𝑎𝐶𝑙 ]
0.15 × 8.31 × 298.15 𝐽𝑜𝑢𝑙𝑒𝑠
371.644
𝜋=
× 𝑅𝑇 =
≡
𝑀𝑃𝑎
𝑉
(A + 1) × 10−6 𝑚3
(𝐴 + 10)
Esercizio 9
A + B + C = A0= 100 mmoli
B + C = A0 – A
A = A0 exp(-k11 t)
B + C = A0[1- exp(-k11 t)] = 100 ×{1 –exp[- 0.05×(A+1)}mmoli
Esercizio 10
− ln(1 − 𝛼) = 𝑘 𝑡 ; 𝑘 =
−ln(1−𝛼)
𝑡
=
−ln(0.9)
(𝐴+1)
𝑚𝑖𝑛−1
Quiz
Un fluido supercritico si
forma
(dS/dT)p =
Il calore specifico molare ha
le stesse dimensioni di
Per condensazione di un gas
reale
Quando un gas reale viene
portato a p > pc e T > Tc
Per espansione di un
vapore saturo
H/T
G/T
Cp/T
U
H
S
p(H2O) p(H2O)*
p(H2O) = p(H2O)*
1
2
3 fasi
4 fasi
Una soluzione acquosa di
NaCl ha:
p(H2O) p(H2O)*
(* sta per composto puro)
Il punto triplo di un sistema
ad un solo componente ha
0
varianza:
Al punto eutettico di un
sistema a due componenti a
2 fasi
pressione costante, coesistono
La fase liquida di una miscela Ha la stessa composizione
azeotropica tra due composti della fase vapore in equilibrio
volatili
È più ricca nel componente
meno volatile rispetto alla
fase vapore in equilibrio
In presenza di un enzima
specifico
L’equazione di Clapeyron
esprime
Una reazione impossibile
diventa spontanea
H di transizione di fase per
un sistema ad un componente
Una reazione lenta assume
maggiore velocità
La velocità di transizione di
fase per un sistema ad un
componente
Perché l’acqua forma bolle a
p = 0.1 MPa e T = 100°C,
mentre, alla stessa pressione,
essa evapora senza bollire?
La formazione di vapore
interessa anche l’interno della
massa liquida formando le
bolle
Al punto di ebollizione
l’acqua intrappola aria che
forma le bolle
È più ricca nel
componente più volatile
rispetto alla fase vapore
in equilibrio
Una reazione esotermica
diventa endotermica
La condizione di
equilibrio di fase per un
sistema ad un
componente
Le bolle sono formate
da anidride carbonica
che viene rilasciata dal
liquido a 100°C