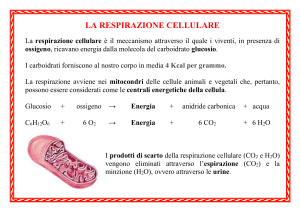
Soluzioni 30 Settembre
Esercizio 1
𝚫𝒚 =
Esercizio 2
(𝐴 + 1)𝑥 𝐴 ∙ 𝑙𝑛𝑥 + 𝑥 𝐴
(𝑨+𝟏)𝟒
𝟒
Esercizio 3
Nomenclatura di B, (B+1), (B+2):
0) Bromuro di Bario
1) Metafosfato di Sodio
2) Floruro di Boro
3) Idrossido di Berillio
4) Idruro di Azoto (ammoniaca)
5) Acido Borico
6) Solfuro di Sodio
7) Solfato di Magnesio
8) Idrosolfuro di Potassio
9) Solfito di Potassio
10) Tetracloruro di Carbonio
11) Solfuro di Calcio
Ioni B, (B+1), (B+2): formula e carica
0. H-1
1. S-2
2. PO3-1
3. F-1
4. IO3-1
5. ClO-1
6. MnO4-1
7. SO3-2
8. ClO4-1
9. PO3-3
10. CrO4-2
11. NH4+1
Esercizio 4
Se il volume della soluzione è 1 L, la sua massa totale è
mtot = (1+0.1 × A) grammi; mtot = (mG + mW) grammi = nG × MMG +nW× MMW
Siccome MMG = 10 MMW, mtot = [10 nG +nW]× MMW
𝑛
𝑋
D’altra parte 𝑛 𝐺 = 1−𝑋
𝑊
Quindi mtot = nG × MMW [10 +(1-X)/X]] = [nG × 18 × (9X+1)/X ] grammi = (1 + 0.1 ×A)grammi
(1+0.1 𝐴)×0.01𝐴
dove nG è il numero di moli di G in un litro di soluzione, cioè [𝐺] =
mol/L.
18×(0.09 𝐴+1)
Esercizio 5
𝑛(𝑁𝐻4 𝑂𝐻) = (𝐴 + 2) × 50 × 10−3 𝑚𝑚𝑜𝑙𝑖
𝑛(𝐻𝐶𝑙) = 50 𝑚𝐿 × [HCl] 𝑚𝑚𝑜𝑙𝑖
𝑛(𝑏𝑎𝑠𝑒)−𝑛(𝑎𝑐𝑖𝑑𝑜)
pH = 14 –pOH = 8; pOH = 6 = 4 – 𝑙𝑜𝑔10
𝑛(𝑎𝑐𝑖𝑑𝑜)
𝑛(𝑏𝑎𝑠𝑒)−𝑛(𝑎𝑐𝑖𝑑𝑜)
𝑛(𝑎𝑐𝑖𝑑𝑜)
= 10−2
n(acido) = n(base)/(1 + 10-2) = (𝐴 + 2) × 0.05/1.01 mmoli
(𝐴+2)
0.05
(𝐴+2)
[HCl] = n(acido) / V(HCl) = [ 50 × 1.01] = 1.01 10−3 moli/L
Esercizio 6
0)
MnO2 + H2O2 + 2 KOH K2MnO4 + 2 H2O
1)
3 Cl2 + 2 Al(OH)3 Al(ClO)3 + AlCl3 + 3 H2O
2)
3 CO + Na2Cr2O7 + 4 H2SO4 3 CO2 + Cr2(SO4)3 + Na2SO4 + 4 H2O
3)
CH4 + 4 H2O2 + 2 KOH K2CO3 + 7 H2O
4)
S8 + 24 H2O2 8 H2SO4 + 16 H2O
5)
N2O + 4 H2O2 + 2 KOH 2 KNO3 + 5 H2O
6)
2 Cl2 + 2 Ca(OH)2 Ca(ClO)2 + CaCl2 + 2 H2O
7)
Ca(OH)2 + 2 NO + 3 H2O2 Ca(NO3)2 + 4 H2O
8)
3 KCN + 10 K2CrO4 + 44 HCl 3 KNO3 + 3 K2CO3+ 10 CrCl3 + 14 KCl + 22 H2O
9)
10)
11)
3 LiClO4 + 8 Au + 24 HCl 8 AuCl3 + 3 LiCl + 12 H2O
PH3 + 4 K2MnO4 + H2O 4 MnO2 + K3PO4 + 5 KOH
3 H2O2 + 2 KMnO4 + 2 HNO3 2 MnO2 + 3 O2 + 2 KNO3 + 4 H2O
Esercizio 7
rH (T2) = rH (T1) + rCp (T2 – T1) = [-250 ×103 – ½Cp(O2) × (A+1) ×100] Jmol-1
Cp(O2) = 5/2 R
rH (T2) = [-250 - 5/4 × 8.31 × (A+1) ×100 ×10-3] kJmol-1
Esercizio 8
La prima goccia di liquido compare a -35°C, qualunque sia la composizione del sistema, ad
esclusione dei composti puri che fondono al rispettivo punto di fusione.
Esercizio 9
𝐴 + 𝐵 + 𝐶 = 𝐴0 = 100 𝑚𝑚𝑜𝑙𝑖 ; = (B+C)/A0
𝑑𝛼
= (𝑘11 + 𝑘12 )(1 − 𝛼) ; − ln(1 − 𝑎) = (𝑘11 + 𝑘12 ) × 𝑡
𝑑𝑡
𝛼 = 1 − exp[−(𝑘11 + 𝑘12 ) × 𝑡] ; (𝐵 + 𝐶) = 𝐴0 × {1 − exp[−(𝑘11 + 𝑘12 ) × 𝑡]}
Esercizio 10
=kt
k = 0.1/(A+1)
Quiz
Il punto di Boyle di un gas reale La T alla quale si osserva un La p alla quale si osserva
è la
comportamento ideale per p un comportamento ideale
= 0.1 MPa
per T = 25°C.
Il punto in cui il rapporto
(pV/RT) = 1
(dH/dT)p =
S
G
Cp
H e S hanno
Le stesse dimensioni
[H] = [T]×[S]
[H] = [S]/[T]
aW < 1
aW = 1
aW > 1
drH/dT = rCp
rH(T) = rH(25)×(T-25)
drH = rCp/T
In una soluzione acquosa di
NaCl
La variazione dell’entalpia di
reazione a pressione costante è
Perché la Teb dell’acqua
aumenta per p > 0.1 MPa?
Qual è l’espressione corretta?
f indica la fugacità; * sta per
composto puro
L’enzima è
La velocità di reazione dipende
dalla temperatura
Il tempo di dimezzamento di
una reazione del primo ordine
ebV
eb
aW = fW/f*W
aW = fW × f*W
aW = XW × f*W
Un catalizzatore
Una molecola inerte
Una molecola piccola
Poiché l’ordine di reazione
varia con T
Aumenta all’aumentare
della temperatura
Poiché la velocità
specifica varia con T
Non dipende dalla
temperatura
ebV
Poiché il grado di
avanzamento varia con T
Diminuisce all’aumentare
della temperatura