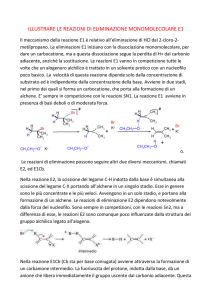
REAZIONI DI ELIMINAZIONE MONOMOLECOLARE E1
Gli alogenuri alchilici, essendo elettrofili, quando reagiscono con nucleofili/basi,
vanno incontro a una di queste due possibilità: o subiscono la sostituzione del
gruppo X da parte del nucleofilo o l’eliminazione di HX per dare un alchene.
L’eliminazione di HX dagli alogenuri alchilici è un metodo molto utile di
preparazione degli alcheni, ma il processo è complicato per vari motivi. Quasi
invariabilmente le reazioni di eliminazione portano a miscele di alcheni. Secondo
la regola di Zaitsev, formulata dal chimico russo Alexander Zaitsev nel 1875, le
reazioni di eliminazione, indotte dalle basi, generalmente danno come prodotto
l’alchene più sostituito (quello, cioè, con il maggior numero di sostituenti alchilici
sul doppio legame).
In chimica per reazione di eliminazione si intende una reazione chimica nella
quale due gruppi sostituenti sono rimossi da una molecola o altra entità
molecolare portando alla formazione di un doppio legame, un triplo legame o
un anello.
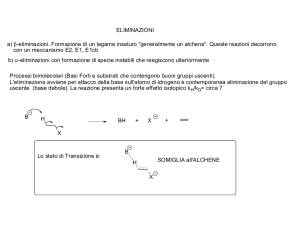
Le reazioni di eliminazione prevedono l'attacco di una base in posizione beta
al gruppo uscente. Il substrato deve possedere qui un atomo o un gruppo di
atomi (solitamente l'idrogeno) che può essere attaccato dalla base, lasciando
indietro la sua coppia di elettroni che andrà a formare il doppio legame. Il
substrato inoltre deve contenere un gruppo uscente in grado di staccarsi dalla
molecola prendendo con sé la propria coppia di elettroni.
La base utilizzata solitamente è un anione fortemente basico (ione alcossido o
idrossido); anche specie neutre possono agire formando lo stesso prodotto,
seppur utilizzando un meccanismo differente. I substrati classici su cui si
eseguono le reazioni di eliminazione sono quelli in cui è presente un ottimo
gruppo uscente (debolmente basico ed un cattivo nucleofilo) quindi tosilati,
triflati, mesilati e alogenuri alchilici.
Le eliminazioni, come le sostituzioni, possono decorrere con meccanismi diversi.
Le reazioni E1, E2, E1cB, i tre meccanismi più comuni, differiscono nei tempi di
rottura dei legami C-H e C-X.
Nella reazione E1 il legame C-X si rompe per dare prima un carbocatione
intermedio
che
subisce
poi
l’estrazione
di
H+
da
parte
della
base.
Nella reazione E2 la scissione del legame C-H indotta dalla base è simultanea alla
scissione
del
legame
C-X
portando
all’alchene
in
un
singolo
stadio.
Nella reazione E1cB l’estrazione del protone da parte della base avviene prima, si
forma un carbocatione intermedio (R:-) che perde X- nello stadio successivo.
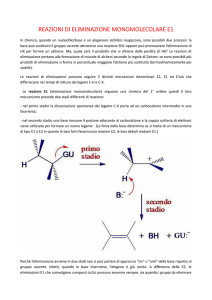
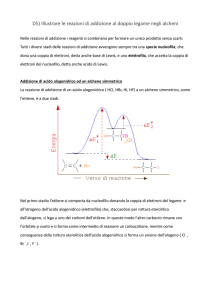
La E1 è una reazione di eliminazione unimolecolare o monomolecolare
in cui
la velocità della reazione dipende unicamente dalla concentrazione del substrato
(alogenuro alchilico) ed è indipendente dalla concentrazione della base (cinetica
del primo ordine).
La legge cinetica di tale reazione è dunque del tipo: v = k · [R-Lg].
La reazione avviene in due stadi:
Nel primo stadio della reazione (stadio lento) si ha il distacco del gruppo
uscente con formazione di un carbocatione:
Nel secondo stadio della reazione (stadio veloce) la base B- rimuove un
atomo di idrogeno in ß dal carbocatione per formare un alchene.
Lo stadio determinante la velocità di reazione è la ionizzazione dell'alogenuro per
formare il carbocatione. Tale stadio determina e limita la velocità dell'intero
processo (è il Rate Determining Step RDS).
Lo ione B-, oltre a funzionare da base, può anche comportarsi da nucleofilo e
attaccare il centro carbocationico per dare reazione di sostituzione SN1. La
condizione di reazione che è usata principalmente per variare la quantità relativa
dei prodotti nelle due reazioni competitive (E1 ed SN1) è la temperatura: in
genere, aumentando la temperatura la reazione di eliminazione risulta favorita.
Nella eliminazione E1 lo stadio determinante la velocità di reazione è quello che
porta alla formazione del carbocatione intermedio di reazione. Più stabile è il
carbocatione intermedio di reazione più veloce è la reazione. L'ordine di reattività
della reazione E1 segue dunque l'ordine di stabilità dei carbocationi:
terziario > secondario > primario > metilico
La reazione E1 presenta analogie con la reazione SN1.
Le eliminazioni E1 iniziano con la medesima dissociazione monomolecolare, per
dare un carbocatione, ma a questa dissociazione segue la perdita di H+ dal
carbonio adiacente.
Le reazioni E1 e SN1 normalmente decorrono in competizione tutte le volte che
un alogenuro alchilico è trattato in un solvente protico con un nucleofilo poco
basico. Pertanto i migliori substrati delle E1 sono anche i migliori substrati delle
SN1 e di regola si ottengono miscele di prodotti di sostituzione e di eliminazione.
MECCANISMO DELLA REAZIONE E1
1) La dissociazione spontanea del
cloruro alchilico terziario porta
a un carbocatione intermedio
in uno stadio lento, che
determina la velocità della
reazione.
2) La perdita di un H+ adiacente,
nello stadio veloce, fornisce
come prodotto l’alchene
neutro. La coppia di elettroni
del legame C-H viene utilizzata
per formare il legame π
dell’alchene.