D5) Illustrare le reazioni di addizione al doppio legame negli alcheni
Nelle reazioni di addizione i reagenti si combinano per formare un unico prodotto senza scarti.
Tutti i diversi stadi delle reazioni di addizione avvengono sempre tra una specie nucleofila, che
dona una coppia di elettroni, detta anche base di Lewis, e una elettrofila, che accetta la coppia di
elettroni del nucleofilo, detta anche acido di Lewis.
Addizione di acido alogenidrico ad un alchene simmetrico
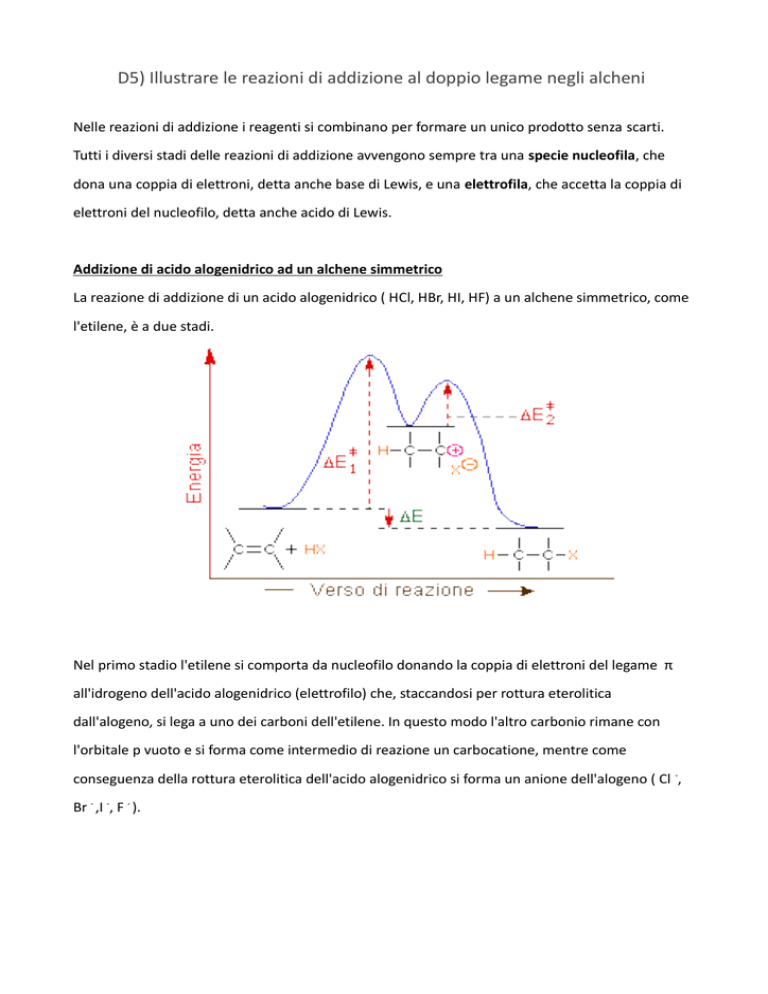
La reazione di addizione di un acido alogenidrico ( HCl, HBr, HI, HF) a un alchene simmetrico, come
l'etilene, è a due stadi.
Nel primo stadio l'etilene si comporta da nucleofilo donando la coppia di elettroni del legame π
all'idrogeno dell'acido alogenidrico (elettrofilo) che, staccandosi per rottura eterolitica
dall'alogeno, si lega a uno dei carboni dell'etilene. In questo modo l'altro carbonio rimane con
l'orbitale p vuoto e si forma come intermedio di reazione un carbocatione, mentre come
conseguenza della rottura eterolitica dell'acido alogenidrico si forma un anione dell'alogeno ( Cl -,
Br - ,I -, F - ).
Nel secondo stadio a fungere da necleofilo è l'anione dell'alogeno che dona una coppia di elettroni
al carbocatione (elettrofilo). Il prodotto finale è un alogenuro alchilico.
Affinchè la reazione avvenga i reagenti devo urtarsi e riconbinare i loro atomi per formare una
nuova specie chimica, in questo caso l'idrogeno deve staccarsi all'alogeno e iniziare a formare il
legame C---H. Per raggiungere questo stato di transizione è necessaria un'energia di attivazione
molto più alta rispetto a quella che serve al carbocatione per reagire con l'anione dell'alogeno. Ciò
significa che il primo stadio di reazione è più lento del secondo. Il protone H + ha la stessa
probabilità di legarsi ai due carboni uniti dal doppio legame e, se come prodotto di reazione si
avesse un alogenuro alchilico con un carbonio chirale (non è il caso dell'aloalcano derivato
dall'etilene), non si otterebbe come prodotto un solo enantiomero ma una miscela racemica (50%
di un enantiomero e 50% dell'altro).
Addizione di acido alogenidrico ad un alchene asimmetrico
Se l'acido alogenidrico si legasse a un alchene asimmetrico non si otterebbe una miscela racemica,
come ci si aspetterebbe,ma un unico prodotto, per questo si dice che la reazione è regiospecifica.
Ciò è dovuto alla struttura e alla stabilità dei carbocationi che si formano come intermedi di
reazione. Più sostituzioni alchiliche ha un carbocatione più è stabile poichè i gruppi alchilici, a
differenza di H+, sono elettron-donatori e tendono a ridurre la sua carica positiva.
Come intermedio di reazione tenderà a formasi il carbocatione più stabile. Per esempio
nell'adizione dell'acido cloridrico al 1-propene, come intermedio di reazione, si forma solo il
carbocatione secondario poichè più stabile di quello primario e si ottiene come unico prodotto 2cloropropano e non 1-cloropropano.
Tutto ciò può essere sintetizzato dicendo che l'idrogeno si lega al carbonio meno sostituito e
l'alogeno al carbonio più sostituito. Questa proposizione è nota come regola di Markovnikov.
Idratazione
Una particolare reazione di addizione è quella di idratazioine dove L'acqua si addiziona a un
achene per dare un alcol. Questo tipo di reazione a tre stadi è acido-catalizzata.
•
Il catalizzatore (acido forte) in acqua si dissocia generando H3O+ il quale funge da
elettrofilo, mentre il legame π dell'alchene si comporta da nucleofilo. L'atomo d'idrogeno,
attaccato dagli elettroni del legamane π, si stacca con rottura eterolitica da H3O+ formando
un nuovo legame C---H nell'alchene. I prodotti del primo stadio di reazione sono un
carbocatione (quello più stabile) e acqua.
•
Nel secondo stadio l'acqua funge da nucleofilo cedendo una coppia di elettroni al
carbocatione (elettrofilo) e attaccandosi ad esso formando il legame C---O. L'ossigeno ha
ora una carica positiva. Il prodotto di questo secondo stadio è un alcol protonato.
•
Nel terzo stadio l'acqua si comporta ancora da nucleofilo stappando H+ dall' alcol protonato
e rigenerando il catalizzatore H3O+ e un alcol neutro.
Addizione di acidi alogenidrici a dieni coniugati
Molti alcheni non presentano solo un' insaturazione ma molte. Nei dieni (alcheni con 2
insaturazioni), in cui i doppi legami e i singoli sono alternati, la reazione di addizione avvine con un
meccanismo diverso. A differenza della reazione di addizione ad alcheni con una solo insaturazione
essa non porta alla formazione di un solo prodotto ma a una miscela di prodotti.
Un prodotto, quello formatosi secondo un'addizione 1,2 è tipico di una reazione secondo
Markovnikov in quanto l'alogeno si lega al carbonio con più sostituenti alchilici, il secondo, quello
formatosi secondo un' addizione 1,4, per la regola di Markovnikon non dovrebbe formarsi, ma le
evidenze sperimentali dimostrano il contrario. Come si può spiegare ciò?
Come nelle reazioni di addizioni ad alcheni mono-insaturi bisogna analizzare la stabilità e la
struttura dei carbocationi che si formano come intermedi di reazione.
Nella reazione di addizione ai dieni non si forma come intermedio di reazione un carbocatione
come quello della reazione ad alcheni con una sola insaturazione ma un carbocatione che ha delle
diverse proprietà dovute alla vicinanza al doppio legame. Esso è detto carbocatione allilico e
strutturalmente ha tutti e tre gli atomi di carbonio ibridati sp 2, per questo motivo esso può essere
rappresentato sia con l'orbitale vuoto a destra sia con l'orbitale vuoto a sinistra dell'atomo centrale
di carbonio. In realtà esso è un ibrido di risonanza, una struttura intermedia dalle due. La risonanza
lo rende più stabile rispetto a un carbocatione non allilico.
Nel primo stadio di reazione, quando il diene viene protonato da H+, si forma il carbocatione
allilico, che nel secondo stadio reagisce con l'anione dell'alogeno. L'attacco può avvenire sia sul
carbonio C1 che sul C3 del carbocatione allilico producendo, perciò, una miscela.
Addizione di alogeni agli alcheni
Una reazione di addizione molto importante è l'alogenazione in cui un alchene viene addizionato
ad un alogeno per ottenere 1,2-dialogenoalcani. Il meccanismo di reazione potrebbe essere uguale
a quello di addizione degli acidi alogenidrici con la formazione di un carbocatione intermedio.
Questo meccanismo però non riesce a spigare il perchè si formino come prodotti isomeri trans.
Questa reazione, in realtà, avvine con stereochimica anti: i due atomi di alogeno si addizionano
all'achene provenendo da parti oppose. Come intermedio di reazione non si forma un
carbocatione ma uno ione in cui una faccia della molecola è schermata dal catione dell'alogeno che
"obbliga" l'anione dell'alogeno ad addizionarsi dalla parte opposta.
Idrogenazione
Un'altra particolare reazione di addizione è quella di idrogenazione che avvine sulla superfice di un
catalizzatore solido con stereochimica sin secondo cui i due atomi di idrogeno si addizionano dalla
stessa parte del doppio legame.