Illustrare le reazioni di eliminazione monomolecolare E1
Gli alogenuri alchilici, in quanto elettrofili, quando reagiscono con nucleofili/basi
possono essere protagonisti di due processi:
- una reazione SN1 o SN2, in cui il nucleofilo/base sostituisce il gruppo uscente X
oppure
- una reazione di eliminazione di HX per formare un alchene.
Una reazione di eliminazione è una reazione chimica che si verifica quando due
gruppi sostituenti vengono rimossi da una molecola e si forma un doppio o un
triplo legame o un anello.
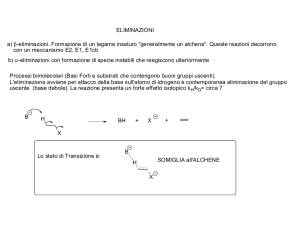
Generalmente in questo tipo di reazione la base è un anione fortemente basico,
come uno ione idrossido o alcossido, mentre il substrato ha un gruppo uscente che
è, al contrario della base, debolmente basico ed un cattivo nucleofilo, come gli
alogenuri alchilici.
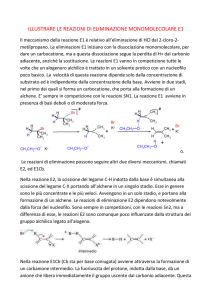
Dalle reazioni di eliminazione si ottengono per lo più miscele di alcheni, ma è
possibile trovare il prodotto presente in prevalenza. Infatti la regola di Zaitsev
afferma che nelle reazioni di eliminazione di HX da alogenuri alchilici, indotte
dalle basi, predomina come prodotto l'alchene più sostituito, ovvero quello che
ha il maggior numero di sostituenti alchilici sul doppio legame, come illustrato nei
due esempi sotto riportati.
Le reazioni di eliminazione possono avvenire in tre meccanismi:
le reazioni E1, E2, E1cB, diverse tra loro per i tempi di rottura dei legami C-H e C-X.
- Reazione E1: (eliminazione monomolecolare) prima si rompe il legame C-X, si
forma un carbocatione intermedio, dal quale poi viene strappato un protone H+ da
parte della base per dare infine come prodotto l'alchene.
- Reazione E2: (eliminazione bimolecolare) i legami C-H e C-X si rompono nello
stesso momento per dare come prodotto l'alchene, in un solo stadio e senza
intermedi.
- Reazione E1cB: (eliminazione monomolecolare con base coniugata) prima si
rompe il legame C-H a causa dell'estrazione del protone da parte della base, si
forma un carbocatione intermedio con carica negativa, quindi un anione, che poi
perde X- per dare come prodotto l'alchene.
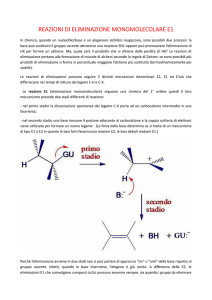
La reazione E1
In questo tipo di eliminazione la reazione procede in due stadi:
– nel primo stadio il gruppo uscente si dissocia da carbonio e si viene a formare
un carbocatione planare. Ciò avviene in uno stadio lento e cineticamente
determinante. La stabilità del carbocatione dipende dal numero dei gruppi
alchilici a sé lagati : più sono i gruppi alchilici più è stabile; di conseguenza
l'energia di attivazione della reazione sarà più bassa e la reazione più veloce.
– nel secondo stadio, lo stadio veloce, la base sottrae un idrogeno, H+, ad un
carbonio adiacente al carbocatione e la coppia di elettroni di questo legame
C-H appena scisso è utilizzata per formare il legame pi-greco dell'alchene, il
prodotto della reazione.
La forza della base deterima il tipo di meccanismo di reazione: l'eliminazione sarà
di tipo E2 se le basi sono forti (esempio OH- o RO-), l'eliminazione sarà di tipo E1 se
le basi sono deboli (esempio H2O o ROH).
La reazione di eliminazione E1 ha analogie con la reazione di sostituzione SN1, in
quanto nel primo stadio dell'eliminazione, in seguito alla rottura del legame C-X, si
forma un carbocatione intermedio, proprio come nella sostituzione SN1. Inoltre
se un alogenuro alchiloco è trattato in un solvente protico con un nucleofilo poco
basico le reazioni E1 e SN1 concorrono tra loro; infatti i substrati delle reazioni E1
possono essere anche substrati delle reazioni SN1 e si ottengono come prodotti
miscele di entrambe le reazioni.
Invece la reazione E1 ha delle differenze con la reazione di eliminazione E2:
nella E1 si forma un carbocatione intermedio, assente nella E2, e le E1 che
interessano composti ciclici possono verificarsi sempre, sia quando i gruppi uscenti
(H e X) hanno orientamento trans sia quando hanno orientamento cis e non si
trovano sullo stesso piano. Inoltre, poiché quando la base interviene l'alogeno è già
uscito, nella E1 non c'è un approccio sin o anti della base rispetto al gruppo
uscente.