Digestione e
assorbimento delle
proteine
Metabolismo delle proteine
Le proteine sono formate da catene di αaminoacidi della serie L uniti tra loro dal
legame peptidico
Le proteine sono composte da 20
aminoacidi
Durante la sintesi proteica è necessario
che gli amino acidi siano tutti
contemporaneamente presenti
Equilibrio dinamico tra aminoacidi e proteine
Proteine corporee
Proteine alimentari
Pool
degli aminoacidi
Pool di escrezione
Equilibrio proteine-aminoacidi
a+b=c+d
condizione di mantenimento
a+d>b+c
accrescimento
a+d<b+c
perdita di massa proteica
Turnover proteico
Indica la peculiarità delle proteine di andare
incontro ad un continuo processo di
degradazione e sintesi.
Caratteristiche del turnover
proteico
È esteso: tutte le proteine sono soggette
al turnover
È eterogeneo: avviene a velocità diversa
per le diverse proteine
È intracellulare: sintesi e degradazione
avvengono all’interno della cellula
È regolato da fattori nutrizionali,
ormonali…
Comportamento del turnover
Varia nelle diverse specie animali in rapporto
alla taglia
Negli organismi umani la velocità del turnover
cala dalla nascita all’età adulta
Varia per i diversi organi e tessuti
Richiede energia
Quantitativamente coinvolge circa 3-4 volte
l’abituale introduzione di proteine con la dieta
Turnover proteico
Eritrociti
8g
Globuli bianchi
20 g
Muscoli scheletrici
50 g
Turnover proteico
dell’organismo
250 g
Fegato
25 g
Tratto gastrointestinale
70 g
Aminoacidi liberi
100 g
Esempi di turnover proteici
nell’organismo
Proteina
Velocità di turnover
Enzimi
7-10 minuti
Fegato
10 giorni
Plasma
10 giorni
Emoglobina
120 giorni
Muscoli
180 giorni
Collagene
1000 giorni
Regolazione del turnover
proteico
Avviene attraverso la coregolazione della fase di
sintesi e degradazione
Sintesi e degradazione sono influenzate dallo
stato di nutrizione proteica ed energetica e da
alcuni ormoni
I diversi fattori influenzanti possono portare ad
uno stesso risultato (aumento o diminuzione
della massa proteica) agendo in maniera
contraria ed indipendente sulle due componenti
del turnover
Digestione delle proteine
L’intestino digerisce e assorbe ogni giorno
una notevole quantità di proteine, alcune
di provenienza alimentare, altre segrete
nel tratto gastroenterico (enzimi digestivi,
mucoproteine, sieralbumina, ..).
Valutando in 100 g le proteine assunte
con la dieta si può valutare in 170 g la qtà
di proteine assorbite e in 10 g quelle
perse con le feci
Classi di enzimi coinvolti nella
digestione delle proteine
Endopeptidasi
Pepsina
Tripisina
Chimotripsina
Elastasi
Esopeptidasi
Carbossipeptidasi
Amminopeptidasi
Dipeptidasi
Endopeptidasi
Enzimi proteolitici, appartenenti alla classe
delle idrolasi, che catalizzano l'idrolisi dei
legami peptidici interni alla catena delle
proteine o dei peptidi. Le endopeptidasi
sono presenti nel canale alimentare, a
livello gastrico e duodenale, ove svolgono la
loro azione idrolitica nei confronti delle
proteine alimentari.
Esopeptidasi
Enzimi proteolitici che catalizzano l'idrolisi
dei legami peptidici in corrispondenza delle
estremità delle catene proteiche.
Appartengono alle esopeptidasi le
carbossipeptidasi, le aminopeptidasi e le
dipeptidasi
Endopeptidasi
Enzima
Presenza
Pepsina
Stomaco
pH
ottimale
1,5 – 2,5
Tripsina
Intestino
7,5 – 8,5
Chimotripsina
Intestino
7,5 – 8,5
Elastasi
Intestino
7,5 – 8,5
Specificità
Tyr, Phe, Leu
-NH
Arg, Lys
-COOH
Trp, Phe, Tyr,
Met, Leu
-COOH
Ala, Gly, Ser
-COOH
Esopeptidasi
Enzima
Presenza
Carbossipeptidasi
Lume
intestinale
pH del
Mucosa
succo
intestinale intestinale
Aminopeptidasi
Dipeptidasi e
tripeptidasi
Mucosa
intestinale
pH
ottimale
Specificità
-COOH
Terminale
-NH3
Terminale
Dipeptidi e
tripeptidi
Digestione: stomaco
Ha inizio la digestione delle proteine ad opera
dell'enzima pepsina, un'idrolasi secreta dalle cellule
parietali delle ghiandole gastriche, che scinde i
legami peptidici (peptidasi) con pH ottimale intorno a
2.
L'organismo si difende dall'azione idrolitica delle
peptidasi: esse vengono secrete in forma inattiva
(zimogeni o proenzimi) e attivate solo all'esterno delle
cellule che le hanno prodotte e in presenza del cibo
da digerire.
La pepsina, una endopeptidasi, effettua sulle proteine
alimentari una prima efficace idrolisi, tagliando le
catene proteiche in frammenti più corti o peptidi.
Pepsina
pepsina
pepsinogeno
tripsina
chimotripsin
a
elastasi
tripsinogen chimotripsinoge
no
o
proelastasi
Digestione: intestino
I peptidi provenienti dalla parziale digestione delle
proteine nello stomaco vengono idrolizzati da una
serie di enzimi di origine pancreatica che li
trasformano in oligopeptidi, tripeptidi e dipeptidi:
- tripsina (endopeptidasi),
- chimotripsina (endopeptidasi),
- elastasi (endopeptidasi)
anch'essi secreti in forma inattiva e attivati
successivamente.
Digestione: intestino
p ep sina
p ep sinog eno
trip sina
chim otrip sina
trip sino g eno
chim o trip sino g eno
elastasi
p ro elastasi
Degradazione proteolitica delle
proteine (ultima fase)
Aminopeptidasi
Dipeptidasi
Questi enzimi sono metalloproteine e tipicamente
richiedono Mn2+ e Zn2+
Attivazione enzimatica
tripsina
chimotripsina
elastasi
tripsinogeno chimotripsinogeno proelastasi
Carbossipeptidasi A
Carbossipeptidasi B
Procarbossipeptidasi
Procarbossipeptidasi B
A
Attivazione delle proteasi
La maggior parte delle proteasi sono
sintetizzate come pre-proteine più grandi
La proteine viene attivata rimuovendo un
segmento inibitorio dalla preproteina
L’attivazione piò avvenire dopo che la
proteasi è stata rilasciata in un particolare
compatimento cellulare o in un ambiente
extracellulare
Attivazione degli enzimi
pancreatici
Patologie associate alla
digestione delle proteine
Morbo celiaco
gli enzimi intestinali non sono in grado di
digerire alcune proteine insolubili in acqua
del grano (gliadina)
Pancreatite acuta
gli zimogeni sono convertiti nella forma
attiva nelle cellule pancreatiche
Malattia celiaca
Intolleranza permanente alla gliadina del
frumento e alle corrispondenti proteine (dette
prolamine) di segale, orzo e avena.
Queste ultime sono responsabili, negli individui
geneticamente predisposti, di profonde
alterazioni della mucosa intestinale.
Si crede sia conseguenza di una risposta
immunologica abnorme nei confronti della
gliadina e delle corrispondenti prolamine
tossiche che porta ad un’atrofia dei villi
intestinali
La dieta del celiaco
Alimenti permessi:
riso, mais, grano saraceno, soia, miglio,
patate, tapioca
Alimenti vietati:
glutine di grano, segale, orzo, avena e
derivati
malto
Proteine
Pepsina
Proteasi
pacreatiche
Oligopeptidi
Aminoacidi liberi
Neutri
Peptidasi
Piccoli
peptidi
Basici
Acidi
Trasporto mediato
Aminoacidi
Peptidasi intracellulari
Aminoacidi
Capillari
Assorbimento protidi
Assorbiti sotto forma di aminoacidi (in
piccolissime quantità anche come dipeptidi)
Velocità dell’assorbimento superiore a quella
della digestione
Il trasporto a livello dell’enterocita avviene in
modo analogo al trasporto del glucosio, si ha un
simporto con Na+
Si conoscono 4 sistemi di trasporto:
aa neutri, aa basici, aa acidi, prolina ed
idrossiprolina
Trasporto degli aminoacidi
Metabolismo degli aminoacidi
Chetogenico
Proteine dietetiche
g
Acidi grassi, steroli
Acetil-CoA
g
Proteine
corporee
ENERGIA
Aminoacidi
Carboidrati
intermedi
Neurotrasmettitori
Purine
Fosfolipidi
Pirimidine
Coenzimi
Porfirine
Altri composti azotati
Tiroxine
Riserve di
glicogeno
Glucogenico
Metabolismo degli aminoacidi
Circa il 75 % degli aminoacidi utilizzati per la
sintesi proteica
Gli aminoacidi derivano sia dalle proteine
introdotte con la dieta sia da quelle degradate
nell’organismo
Questa degradazione è un processo che
avviene con continuità poiché le proteine
nell’organismo vengono costantemente
rimpiazzate
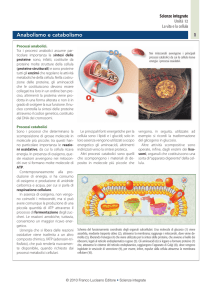
Catabolismo degli aminoacidi
Dopo l’assorbimento attraverso l’intestino gli
aminoacidi sono trasportati al fegato attraverso il
sistema portale
Il fegato è il sito principale sia del metabolismo
dello scheletro carbonioso che dell’azoto ed è
l’organo più attivo sia per la sintesi che per il
catabolismo
La maggior parte dell’azoto è rimosso dagli
aminoacidi tramite l’azione di enzimi epatici per
ossidazione o transaminazione
Altri usi degli aminoacidi
Sono utilizzati come fonte di azoto per la sintesi di altri composti:
Basi azotate del DNA ed RNA
Eme e strutture simili di mioglobina, emoglobina, citocromi,
enzimi,..
Acetilcolina ed altri neurotrasmettitori
Ormoni e fosfolipidi
Possono essere utilizzati anche come fonte energetica dopo la
rimozione dell’azoto
Vie metaboliche degli aminoacidi
Proteine
corporee
Proteine
dietetiche
digestione
Sintesi nel
fegato
Ciclo
acido citrico
Pool di
aminoacidi
catabolismo
Composti
azotati
Scheletro
carbonioso
Ciclo
urea
Degradazione ossidativa degli aa
Durante il turnover proteico: vengono
ossidati gli aminoacidi che non vengono
utilizzati per una nuova sintesi
In presenza di una dieta troppo ricca di
proteine: l’eccesso viene ossidato
Durante il digiuno e in caso di diabete
mellito
Catabolismo degli aminoacidi
Gli aminoacidi non possono essere
immagazzinati dall’organismo
Se c’è un eccesso di aminoacidi o una
mancanza di altre fonti di energia, l’organismo li
utilizza per la produzione di energia
Diversarmente da grassi e carboidrati, gli
aminoacidi richiedono la rimozione del gruppo
amminico
Scheletro carbonioso degli aa
Gli amino acidi, quando vengono deaminati,
producono un α-cheto acido che, direttamente
o attraverso reazioni addizionali, entrano nelle
principali vie metaboliche (e.g., Ciclo di Krebs).
Gli amino acidi sono raggrupati in 2 classi in
nase alla capacità o meno dello scheletro
carbonioso di essere convertito in glucoso
glucogenici
chetogenici
Amino acidi glucogenici
Lo scheletro carbonioso degli aminoacidi
glucogenici è degradato a:
piruvato, or
a intermedi del ciclo di Krebs a 4-C or 5-C.
Questi sono precursori della gluconeogenesi.
Gli aminoacidi glucogenici sono la maggior fonte di
carbonio per la gluconeogenesi quando i livelli di
glucosio sono bassi.
Possono essere anche catabolizzati per la
produzione di energia, o convertiti in glicogeno o
acidi grassi come deposito energetico.
Amino Acidi chetogenici
Lo scheletro carbonioso degli aa chetogenici è
degradato a:
acetil-CoA
acetoacetate
L’Acetil Coa e il suo precursore, acetoacetate, non
può essere convertito a ossalacetato, il precursore
della gluconeogenesi.
Per ogni residuo a 2-C di acetile che entra nel ciclo di
Krebs, 2 C escono come CO2. Lo scheletro carbonioso
degli aminoacidi chetogenici può essere catabolizzato
per produrre energia nel ciclo di Krebs o essere
convertito a corpi chetonici o acidi grassi. Non può
essere convertito in glucosio.
Catabolismo degli aminoacidi
Rimozione di α-amino gruppi
Processo di due fasi
Reazione di transaminazione
L’aminotransferasi trasferisce il gruppo
amminico all’α-chetoglutarato producendo
glutammato o all’ossalacetato con formazione di
aspartato
Deamminazione ossidativa
Rimozione dell’amino gruppo dal glutammato
con produzione di uno ione ammonio
Esempio di transaminazione
alanina
α-chetoglutarato
L’enzima utilizzato
è l’analina aminotransferasi
piruvato
Ciclo dell’
acido citrico
glutammato
Al passo
successivo
Esempio di deamminazione
ossidativa
Energia
glutammato
α-chetoglutarato
Al ciclo
dell’urea
Sommario
Transaminazione
α-aminoacido
α-chetoglutarato
glutammato
ossalacetato
α-cheto acido
Deaminazione
ossidativa
aspartato
Al ciclo dell’urea
Dove gli aminoacidi entrano
nel ciclo di Krebs
Il ciclo dell’urea
Tutti gli eccessi di aminoacidi sono
deaminati
Il risultato è la produzione di ammonio che
è tossico e deve essere eliminato. Il ciclo
dell’urea ha questo scopo:
avviene nel fegato
produce urea
l’urea è eliminata con le urine
Tipi di escrezione dell’azoto nelle
diverse forme di vita
Animali ammonotelici (ammoniaca):
la maggior parte dei vertebrati acquatici,
specialmente i pesci con scheletro osseo
e le larve degli anfibi
Animali urotelici (urea):
molti vertebrati terrestri; anche gli squali
Animali uricotelici (acido urico):
ucceli, rettili
Il ciclo dell’urea
Un blocco completo di qualsiasi step del
ciclo dell’urea è incompatibile con la vita
Non esiste una via alternativa per
l’eliminazione di NH4+
Escrezione dell’azoto
Metaboliti
urinari
Urea
Ione ammonio
g/24 h
% totali
30
0.7
86
2.8
Creatinina
1.0 –1.8
4-5
Acido urico
0.6 – 1.0
2-3