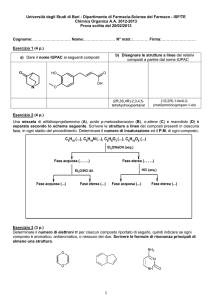
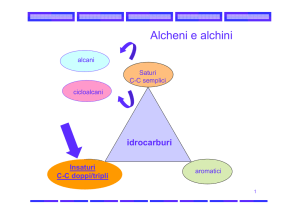
Chimica Organica
Informazione Scientifica sul Farmaco
Capitolo 4
Reazioni degli alcheni
Organic Chemistry, 5th Edition
L. G. Wade, Jr.
In questa lezione:
• richiami generali sulle reazioni chimice
• reattività del doppio legame C=C
• reazioni di addizione elettrofila
2
Reazioni chimiche:
aspetti fondamentali
•
•
•
•
•
Una reazione chimica viene rappresentata mediante una
equazione stechiometrica
L’equazione identifica reagenti, prodotti e rapporti stechiometrici
La descrizione stadio per stadio del decorso della reazione (“come
avviene”) prende il nome di meccanismo della reazione
Le reazioni chimiche avvengono con rottura e/o formazione di
legami.
Durante la reazione chimica possono formarsi intermedi di
reazione, che poi si trasformano nei prodotti della reazione
3
Omolisi ed eterolisi dei legami
•
•
Le reazioni dei composti organici riguardano di solito rotture e/o
formazione di legami covalenti
Considerando una generica molecola A-B possiamo
immaginare tre diversi modi per la rottura del legame:
A. + B.
A
B
A+ + BA- +
•
•
Scissione omolitica
B+
Scissione eterolitica
La scissione omolitica determina la formazioni di radicali
La scissione eterolitica determina la formazione di ioni
4
Intermedi nelle reazioni organiche
•
Nelle reazioni organiche che avvengono in due o più stadi si
formano intermedi radicalici o ionici
C
Z
C.
Scissione omolitica
Z.
+
Radicale carbonio
C+
C
+
Z-
Z
Scissione eterolitica
carbocatione
C
-
+
Z+
carbanione
5
Reattività del C=C
•
•
•
•
•
•
•
Quali caratteristiche elettroniche ha il gruppo funzionale degli
alcheni?
Il doppio legame è “circondato” dalla nube elettronica p, per cui si
presenta come una specie ricca di elettroni, cioè un nucleofilo
Gli elettrofili sono attratti dagli elettroni p
Il legame p è più debole del s, è quello che si rompe più facilmente.
Si forma un carbocatione intermedio.
E-Nu
Il nucleofilo attacca il carbocatione.
Il risultato è una addizione al doppio legame.
E+ + :NuE+
H3C
H3C
E
C
CH3
CH3
H3C
H3C C
Nu
:Nu-
E
CH3
CH3
6
Addizione elettrofila
•
1: gli elettroni p attaccano l’elettrofilo: si forma un carbocatione.
E
C
C
+
+
E
C
C +
• 2: il nucleofilo attacca il carbocatione: si forma il prodotto
E
C C+
+
_
Nuc:
E Nuc
C C
7
Varie possibilità di addizione
8
Carbocationi
•
•
•
•
Sono molto instabili, ma si formano come intermedi in numerose
reazioni
Il carbonio carico positivo è ibridizzato sp2
La struttura è trigonale planare
I gruppi alchilici sono elettron donatori, per cui stabilizzano la carica
positiva
9
Effetto induttivo
• Gli effetti elettronici trasmessi lungo i
legami s sono detti effetti induttivi
• Il carbonio positivo attira gli elettroni dei
legami s (è più elettronegativo)
+
• La carica positiva viene dispersa
sugli atomi legati al carbonio
carico
• I gruppi alchili hanno un effetto di
rilascio elettronico, per cui tendono a
stabilizzare la carica positiva (il
legame C-C si polarizza meglio del
C-H)
10
Iperconiugazione
• Gli orbitali s dei gruppi alchilici si sovrappongono con
l’orbitale p vuoto del carbonio positivo
iperconiugazione
• All’aumentare del numero
di gruppi alchilici legati al
carbonio positivo aumenta
l’effetto iperconiugativo
11
Regola di Markovnikov
• Dove si lega l’elettrofilo? Regola di Markovnikov: il protone di un
acido alogenidrico attacca il carbonio del doppio legame meno
sostituito. Esempio dell’acido alogenidrico (HX)
• La protonazione del doppio legame porta alla formazione del
carbocatione più stabile; la carica positiva va sul carbonio più
sostituito (reazione regiospecifica)
CH3
CH3 C CH CH3
+
H
CH3
CH3 C CH CH3
H Br
X
+ Br
_
CH3
CH3 C CH CH3
+
H
12
Quindi:
CH3
CH3 C CH CH3
H Br
CH3
CH3 C CH CH3
+
H
_
Br
CH3
CH3 C CH CH3
+
H
+ Br
_
CH3
CH3 C CH CH3
Br H
13
Idratazione degli alcheni
•
Si usano soluzioni diluite di H2SO4 o H3PO4 per spostare
l’equilibrio verso l’idratazione.
+
H
C C
+ H2O
C C
alchene
nucleofilo
H OH
alcol
H
H
C C
+
elettrofilo
+
H2O
H
+
H O H
C C
+
H2O
H
+
H O H
H
+
C C
+
C C
+
H O H
C C
H
H O
+
H2O
C C
+
H3O
+
14
Orientamento
•
Si forma il prodotto di Markovnikov
H
CH3
CH3 C CH CH3 + H O+ H
CH3
CH3
CH3 C CH CH3
H
CH3
CH3 C CH CH3 + H2O
+
H
H2O
CH3 C CH CH3
+O H
H
H
H2O
O H
15
Addizione di alogeni
• Cl2, Br2, e raramente I2 si addizionano al doppio legame
formando dialogenuri vicinali.
• Addizione anti, reazione stereospecifica.
Br
C C
+
Br2
C C
Br
Esempio
CH2 CH CH3 + Br2
CCl4
CH2 CH CH3
Br
Br
16
Meccanismo dell’alogenazione
• Gli elettroni p attaccano il bromo.
• Uno ione bromuro esce.
• L’intermedio è lo ione bromonio ciclico.
Br:
: :
+ :Br
: :
: :
C C
Br
C C
+ :Br:
• Lo ione bromuro attacca l’intermedio dalla parte opposta rispetto al
primo atomo di bromo.
Br
C C
: :
Br
C C
:Br:
Br
17
Esempi
18
Idrogenazione
• Alchene + H2 Alcano
• È necessario un catalizzatore: Pt, Pd, o Ni.
• Addizione sin
+ H2
Pt
19
Fine del Capitolo 8
20