Dovute a
Processi di trasformazione
degli alimenti
Processi di degradazione
Sono legati prevalentemente
all’azione di temperatura e
pH
Sono legati prevalentemente
all’azione di enzimi e
microorganismi
Non sempre sono sfavorevoli dal
punto di vista nutrizionale ed
organolettico, anzi, spesso sono
volute (es. cottura degli alimenti)
Generalmente sono processi non
desiderati, salvo alcune eccezioni (es.
maturazione dei formaggi, di alcuni
insaccati ed altri alimenti stagionati)
Processi di
trasformazione degli
alimenti
Processi di
degradazione
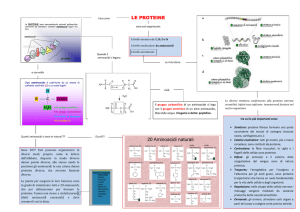
Denaturazione proteica
Idrolisi proteica
Modificazione delle catene
laterali degli aminoacidi
Demolizione enzimatica
degli aminoacidi
(putrefazione)
Reazione di Maillard
Denaturazione proteica
Si definisce tale ogni modifica della struttura secondaria, terziaria,
quaternaria delle proteine che non implichi rottura dei legami
peptidici (in cui quindi la struttura primaria rimanga integra)
Denaturandosi, la proteina passa da uno stato
organizzato ad uno più disordinato, ma energeticamente
più stabile alle nuove condizioni ambientali
• AGGREGAZIONE E COAGULAZIONE
• PERDITA DELL’ATTIVITA’ BIOLOGICA
• VARIAZIONE DELLE PROPRIETA’ ELETTROCHIMICHE,
OTTICHE E DELLA CAPACITA’ DI IDRATAZIONE
DENATURAZIONE
Avvolgimento
causale
Forma nativa
• DIMINUZIONE DELLA SOLUBILITA’
• AUMENTO
DELLA
PROTEOLITICI
SENSIBILITA’
AGLI
ENZIMI
Generalmente la denaturazione è un processo irreversibile
Il calore rompe i ponti disolfuro (-S - S-) causando liberazione
di solfuro di idrogeno che conferisce, ad esempio, il tipico odore
al latte bollito.
SCOTTATURA
COTTURA
PASTORIZZAZIONE
STERILIZZAZIONE
Il calore rompe i legami che stabilizzano la forma nativa
1
Pochissime proteine sopportano temperature maggiori di 60°C
per un tempo prolungato; vi sono comunque vari fattori che
contribuiscono ad alzare o abbassare la sensibilità al calore, tra
cui:
ALTRE CAUSE DI DENATURAZIONE
• natura stessa delle proteine
• concentrazione delle proteine nel mezzo
• presenza di ioni nel mezzo
• pH (la sensibilità aumenta allontanandosi dalla neutralità)
• aw (la sensibilità diminuisce per bassi valori di aw )
Modificazione delle catene laterali degli aminoacidi
Principale agente:
Principali modifiche: • desulfidrilazione dei residui di cisteina e
cistina con liberazione di solfuro di idrogeno
• deaminazione dei residui di glutammina e
asparagina con liberazione di ammoniaca e
possibile formazione di nuovi legami
covalenti
• disidratazione dei residui di serina
• formazione di derivati ciclici dotati, taluni,
di potere mutageno; sono noti quelli del
triptofano che originano durante la cottura
delle carni alla griglia a temperatura maggiore
di 200°C.
2