CHIMICA ORGANICA APPLICATA II
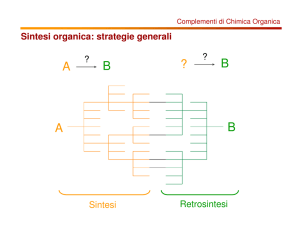
1. Progettare una sintesi organica; analisi retrosintetica
trasformazione dei gruppi funzionali;
1a. Semplici applicazioni retrosintetiche
PRIMO COMPITINO (Fine novembre)
2. Nuovi metodi di sintesi
2a. Formazione del legame C-C;
2b. Controllo della stereochimica;
2c. Reazioni pericicliche
2d. Applicazioni retrosintetiche complesse
SECONDO COMPITINO (Dopo la fine del corso)
1
Modalità di accertamento:
-1° Compitino. Retrosintesi e sintesi di tre semplici
composti organici usando principalmente (ma non
esclusivamente la chimica dei carbanioni). Ognuno dei
tre composti vale 10 punti.
-2° Compitino. 10 domande di teoria (10 punti) e due
retrosintesi e sintesi (10 ciscuna).
Ogni compitino è seguito da una prova di recupero.
La partecipazione al secondo compitino non è legata al
superamento del primo.
2
Requisiti/informazioni/problemi
Materiale di lavoro
Fotocopie delle diapositive utilizzate dal docente durante le lezioni.
Disponibili in rete come files .pdf al sito
http://www.chimica.unipd.it/paolo.scrimin/pubblica/didattica.html
Testi di riferimento
a) P. Wyatt, S. Warren, Organic Synthesi: strategy and control, Wiley
2007;
b) J. March, Advanced Organic Chemistry, Reactions, Mechanisms,
Structure, J. Wiley;
Orario di ricevimento
Durante il semestre: ogni mattina dalle 9,30 alle 10,30 presso lo studio del
docente (Dipartimento di Scienze Chimiche-Direzione edificio, 1° piano
chiedere in portineria per entrare) oppure per appuntamento;
Negli altri periodi dell'anno: per appuntamento telefonando al numero 0498275276 oppure inviando un e-mail a: [email protected]
3
PRINCIPI GENERALI DELL’ANALISI RETROSINTETICA
Disconnessione: processo che comporta la rottura di uno o più legami per
dare dei reagenti di partenza verosimili; il simbolo è
Equivalente sintetico o sintone:
un reagente che presenta una funzione
diversa da quella che sarà presente nel
prodotto (o intermedio) ma che è facilmente
convertibile in quest’ultima
Molecola target (prodotto): la molecola che si vuol sintetizzare
Retrosintesi:
il processo a ritroso che, utilizzando diverse disconnessioni,
porta alla molecola target
4
Esempi:
a
b
COOEt
b
COOEt
+
COOEt
COOEt
Br
P1
COOEt
EtO-
COOEt
P1
COOEt
COOEt
O
O
O
P2
O
+
O
O
5
PARTE 1: DISCONNESSIONE DI UN SOLO GRUPPO FUNZIONALE
Un caso classico di facile disconnessione è quella che coinvolge un gruppo
alcolico:
R1
R1
OH
R2 X
O
+
X-
R2
Questi sono alcuni esempi reali:
H3C
OH
H3C
CN
H3C
O
+
H3C
catalisi acida!
CN-
P3
H3C
H3C
OH
O
+
H
P4
H3C
-C CH
OH
CH2CH3
H3C
O
+
CH3CH2
-
P5
Una volta individuata la disconnessione bisogna poi scrivere la
reazione vera!
6
Non sempre le cose sono ovvie; vi possono essere più strade.
Ad esempio:
H3C
a
b
O
b
+ CH3MgI
OH
P6
a
H3C
H3C
MgBr
O
+
In questo caso bisogna saper scegliere la migliore.
Due criteri: reagenti più facilmente disponibili o migliore reattività.
In questo caso probabilmente la scelta migliore è a in quanto tutti
i reagenti sono disponibili commercialmente; nel caso della scelta b si
dovrebbe pensare ad una strategia per sintetizzare il chetone.
P6 può però essere sintetizzato in maniera alternativa a partire da
reagenti diversi.....
7
Per esempio questo:
O
OR
Sono necessarie due disconnessioni:
H3C
O
O
OH
+ CH3MgI
OR
P6
Si tratta di un’alternativa della via b che abbiamo scartato prima. Anche
questo approccio, quindi, non è conveniente ma introduce una possibilità
alternativa ogniqualvolta un alcol ha due sostituenti uguali.
Per esempio:
Et
Et
OH
P7
8
Esercizio. Proporre una serie di disconnessioni plausibili che portino a reagenti
semplici per ottenere il prodotto P8.
OH
P8
Un aiuto può venire dall’analisi retrosintetica a partire da P9
OH
tgf
O
O
H
H
+
P9
Ma c’è un’altra strada anche se la differenza non è poi così grande. Quale?
9
Gli esempi che abbiamo visto fino ad ora ci portano ad individuare una serie di
composti che possiamo ottenere dagli alcoli attraverso operazioni sintetiche
che non sono vere e proprie disconnessioni. Si tratta piuttosto di:
INTERCONVERSIONI TRA GRUPPI FUNZIONALI
RX
ROR
H+
eliminazione
Alcheni
PX3
o
HX
ROH
RCOH o RCOR’
[O]
[O]
R’COCl
RCOOH
R’COOR
10
Nel progettare una retrosintesi nella quale il prodotto sia ottenibile
mediante interconversione con un alcol conviene partire da questo.
Così la prima operazione da fare nel progettare la retrosintesi di P10
è quella di trasformare l’estere nell’alcol.
O
OH
O
P10
OH
MgBr
+
O
BrMg
OEt
H
+
Dopo aver scritto la sintesi ci accorgiamo di aver bisogno di questo bromuro:
Br
11
Br
MgBr
OH
O
+
H
H
Questa strada però non funziona perchè:
Br
MgBr
+
Bisogna pensare ad una via alternativa:
OH
MgBr
+
Quali sono le limitazioni per una applicazione generale di
questo approccio?
O
12
Esercizio. Eseguire l’analisi retrosintetica e proporre una via di sintesi di P11
OH
P11
Retrosintesi
OH
+
BrMg
MgBr
+
O
tgf
OH
H
CH2O
Sintesi
MgBr
1. Mg, Et2O
Br
2. CH2O
OH HCl, CrO
3
priridina
O
H
P11
13
Esercizio. Eseguire l’analisi retrosintetica e proporre una via di sintesi di P12
O
O
P12
Retrosintesi
O
O
H3C
H3C
O
HO
O
+
O
HO
H
H
H
H
+
H
H
Sintesi
H
H
HO
1. Base, CH2O
H2, Pd-C
BaSO4
2. Base, CH2O
HO
HO
HO
cis!
H3C
O
H3C
H+
O
O
14
pKa di molecole organiche
(riferimento H2O)
15
La disconnessione di un alchene è più complicata di quella di un alcol
Un’ ovvia possibilità è quella di sfruttare la reazione di disidratazione
di un alcol (con le limitazioni che questo comporta).
Se il nostro target è P13 vi sono almeno due possibilità:
OH
MgBr
O
+
P13
BrMg
OH
!
O
La seconda però non è particolarmente interessante!
Inoltre c’è un problema per l’alcol intermedio: non dà esclusivamente P13
per disidratazione. Quale altro alchene si può ottenere?
16
Proporre una retrosintesi per P14
P14
non da solo P14 per disidratazione!
OH
H3C
P14
H3C
OH
O
+
MgBr
Ci sono ambiguità per quanto riguarda la disidratazione dell’alcol per questa via?
Esiste però un’altra possibilità per ottenere l’alchene: ....Wittig (discuteremo la
reazione di Wittig in dettaglio nella seconda parte)
H3C
H3C
O
+
PPh3
+
PPh3
Quali sono i vantaggi (rispetto alla disidratazione di un alcol)?
+
Br
17
Progettare una retrosintesi di P15.
a
P15
+
CHO
b
H
O
+
Ph3P
Br
+
PPh3
+
Br
L’aldeide della via b l’abbiamo già sintetizzata via Diels-Alder!
Scrivere ora la sintesi di P15.
18
Un’altra disconnessione importante è quella degli aril chetoni attraverso
una reazione di Friedel-Crafts. Un caso banale è la retrosintesi di P16.
O
CH3
O
+
Cl
H3CO
H3CO
CH3
P16
Questa disconnessione ci fa preferire la rottura tra un anello aromatico
e un gruppo acilico piuttosto che uno alchilico se si pone questa alternativa.
Nel scegliere le disconnessioni bisogna ricordare il meccanismo della
Friedel-Crafts. Ad esempio nella sintesi di P17 è preferibile la disconnessione
a o b?.
CH3
NO2
CH3O
a
O
P17
b
19
Nel progettare una disconnessione molto spesso conviene prendere in considerazione: a) la protezione di gruppi funzionali che non si vuole reagiscano
b) l’attivazione di un gruppo funzionale non particolarmente attivo
c) protezione e attivazione (di due gruppi funzionali diversi
nella stessa molecola)
a)
O
OH
O
CO2Et
2PhMgBr
deve essere protetto!
P18
O
b)
+
O
O
CO2Et
O
+
Br
(in presenza di base)
P19
ma...
Br
O
O
O
+
base
deve essere attivato!!
O
CO2Et
20
c)
tgf
O
O
O
+
-
P20
Br
O
-
1. EtO2.
MeI
O
CO2Et
O
O
OH
HO
Br
CO2Et
NaNH2
+
CO2Et
Sintesi:
O
MeI
HCl
H2O
O
O
H+
O
H2 Pd/C
BaSO4
O
P20
21
Disconnessioni di acidi carbossilici e chetoni
Proporre una via di sintesi di P21 alternativa a quella di P19.
tgf
O
OH
BrMg
O
+
H
P21
Se si volesse ottenere l’acido P22:
O
HO
P22
BrMg
+
CO2
Una volta sintetizzato l’acido carbossilico, l’ottenimento dei derivati (cloruri,
anidridi, esteri, ammidi) è banale.
22
Proporre una retrosintesi per l’ammide P23:
P23
N
O
NH
N
O
CO2
+ HO
+
BrMg
O
P23
tgf
+
HO
O
H
MgBr
Sintesi: .....
23
In fine la lista dei composti accessibili mediante semplice disconnessione
deve necessariamente includere gli idrocarburi.
Per esempio proporre una retrosintesi di P24 (ricordando che un idrocarburo
può essere ottenuto per idrogenazione di un alchene!)
P24
+
tgf
PPhe3
P24
+
O
H
Vi sono ovviamente altre possibilità collocando il doppio legame in un’altra
posizione. Il più vicino possibile ad un anello aromatico e/o ad una ramificazione
è, in genere, una scelta da preferire. Così nel caso di P25 ...
MgBr
OH
P25
O
+
24
Esercizi di riepilogo. Proporre una retrosintesi accettabile per ciascuno dei
composti P26 e P27.
OCH3
OCH3
Intermedio nella sintesi di alcaloidi
H3CO
H3CO
HN
O
P26
CO2H
“Brufen”, antiinfiammatorio
P27
25
PARTE 2: DISCONNESSIONE DI DUE GRUPPI FUNZIONALI
In genere, se la cosa è possibile, in presenza di due gruppi funzionali la cosa
migliore è di considerarli ambedue nella disconnessione. Un esempio banale
è costituito da P28. Chi è il precursore?
Derivati -idrossicarbonilici
OH
CHO
P28
E nel caso di P29?
OH
P29
CHO
Un pò più complesso è P30:
P30
26
Derivati carbonilici , insaturi
(Conviene ricordare la relazione alchene : alcol)
P31
In generale:
O
R
O
+
H2C
O
R
27
Derivati 1,3 dicarbonilici
O
O
O
+
+
O-
O
L’equivalente sintetico di un catione acilico è RCOX con X buon gruppo uscente
Nei casi simmetrici non ci sono problemi ma se la molecola non è simmetrica?
Per es: P32
P32
28
Tuttavia nel caso di P33 l’uso dell’etil carbonato è conveniente
a
CO2Et
a
b CO2Et
P33
O
+
-
EtO
CO2Et
OEt
La disconnessione b è accettabile?
Proporre una retrosintesi accettabile per P34:
O
O
H3C
O
H
H3C
O
+
P34
EtO
H
Per P35 però non conviene seguire la stessa strada….
O
O
OEt
P35
OEt
Questa è la strategia migliore!
O
O
OEt
29
Esercizi: proporre una retrosintesi accettabile per i prodotti P36 e P37
O
O
P36
O
HO
O
P37
N(CH3)2
30
Derivati 1,5 dicarbonilici
Un approccio possibile è quello di una addizione di Michael; ad es.:
O
O
EtOCHO
Così P38 può essere disconnesso in questo modo:
O
CO2Et
O
P38
O
CO2Et
-
H
O
O
+
Ma P39?
P39
31
Un buon esercizio è la retrosintesi di P39
O
O
O
OEt
O
O
OEt
O
+
O
P39
O
O
CH3
O
OEt
H
+
Proporne una per P40
P40
conviene usare un
sistema attivato
(vedi P19)
32
La disconnessione di un doppio legame di un sistema ,-insaturo del tipo
O
richiede di procedere attraverso la reazione di Mannich:
O
+
CH2O
CH2O
+
R2NH
H+
+ R2NH
R2NCH2OH
O
MeI
O
NR2
+
R2N
+
NR2
NR2
O
H+
H
+
O
O
NR2
H
base
O
Un esempio è P41
O
O
O
O
O
+
P41
O
+
CH2O
33
Esercizi: Proporre una retrosintesi per i due composti P42 e P43
CO2Et
O
P42
O
P43
34
PARTE 3: DISCONNESSIONI DI DUE GRUPPI FUNZIONALI
APPARENTEMENTE PRIVE DI LOGICA
Immaginiamo di voler sintetizzare P44. E’ un alcol, possiamo disconnettere
il legame C-C in ?
OH
OH
?
O
+
O
-COOH
P44
Sembra un paradosso ma non lo è se ricordiamo la relazione tra gruppi funzionali
CN- COO-. Quindi....ha senso ma la sintesi sarà:
O
OH
1. CN2. H+
CN
NaOH
H2O
P44
35
Vediamo allora come fare nel caso di P45:
OH
OH
OH
P45
H
O
EtO
O
+ CH2O
OH
OH
2
CN-
H
+
OH
O
La disconnessione 2 comprende anche
la conversione di un gruppo funzionale
Nella sintesi c’è un problema quando si è arrivati all’estere:
O
EtO
La reazione successiva prevede l’uso di due equivalenti di PhMgBr.
Come si può fare?
OH
OH
L’equivalenza sintetica tra CN- e COO- ci può permettere di sintetizzare
anche -ammino acidi:
HOOC
NH2
NH
+ CN-
+
O
NH3
36
(sintesi di Strecker: v M-6-50)
L’addizione di CN- ad un chetone può dare un intermedio reattivo e
prodotti che NON incorporano il gruppo –CN, come nel caso della sintesi
del benzoino: (M- 6-54)
O
NC
H
+
CN-
O
O-
NC
H
H
O
H
O
- CN-
OH
OH
benzoino
Questo approccio può essere utilizzato nella sintesi di P46:
O
O
O
MgBr
O
O
+
Cl
Cl
occhio!
t.g.f.
P46
H
O
H
OH
37
Un analogo problema di approccio “illogico” lo abbiamo nella sintesi di una
funzione alcolica in a un chetone (v. la via a nella disconnessione di P30)
come nel caso di P47:
OH
P47
O
?
O
+ O
Anche in questo caso dobbiamo ricorrere ad un sintone! Un sintone dell’anione
acilico è un alchino terminale che si idrata per trattamento con HgSO4
in ambiente acquoso. (v. M-5-3)
Allora la sintesi di P47 sarà:
P47
38
Applicazione alla retrosintesi di P48:
O
O
t.g.f.
t.g.f.
OH
OH
O
O
+
H
H
+
O
OHOH
P48
funziona solo se è
una reazione simmetrica
E alla disconnessione di P49
O
OH
P49
O
O
O
H
furfurale
OH
+
O
già visto prima!
Nella sintesi è necessario proteggere la funzione alcolica?
39
Un altro esempio di disconnessione di alcoli che richiede la conversione di
un gruppo funzionale è quella degli 1,2-dioli
La strategia è questa:
OH
t.g.f.
+
O + Ph3P
OH
Il reagente per convertire un doppio legame in un 1,2 diolo può essere o
KMnO4 o OsO4. Si tratta di una addizione cis!
Proporre una disconnessione per P50
CO2CH3
O
O
t.g.f.
HO
HO
CO2CH3
t.g.f.
CO2CH3
CO2CH
3
+
P50
40
Un altro problema che spesso si incontra è la necessità di far avvenire
un attacco nucleofilo all’atomo di carbonio in di un derivato carbonilico.
Cerchiamo cioè un sintone di
O
+
È un sintone
di questo catione
La cosa più semplice è alogenare questa posizione:
O
O
Br2
Br
La retrosintesi di P51 è banale:
O
COOH
OH
O
+ Br
Cl
COOH
Cl
P51
41
Si possono ottenere derivati formalmente legati a 1,2-dioli anche per
reazione di un alcolato con un epossido. Lo si vede nella retrosintesi di P52
O
OH
P52
O-
O
O
t.g.f.
+
+
+ Ph3PCH3
Un epossido è un sintone di: +
OH
Proporre una retrosintesi per P53 e P54.
O
O
P53
COOH
O
O
P54
42
Proporre una disconnessione di P55:
O
O
Br
-
CO2CH3
+
P55
CO2CH3
Questa strada non va bene! Quale prodotto si ottiene invece?
NR2
Bisogna prima convertire il cicloesanone in una enammina:
Solo dopo si può far avvenire la reazione con il bromoacetato.
Così nella retrosintesi di P56….
O
N
O
O
O
Br
O
P56
43
Proporre una disconnessione per P57. Ci sono almeno due strade:
O
OH
P57
O
+
CN-
O
O
OH
Br
+
COOEt2
COOEt2
Quale retrosintesi proponete per questo composto (P58)?
HO
OH
OH
P58
44
Abbiamo già visto che un cicloesene può essere sintetizzato attraverso la
reazione di Diels-Alder. Per ozonolisi un cicloesene può essere convertito
in un composto 1,6-dicarbonilico. Allora come si può fare P59?
O
t.g.f.
O
OH
O
MgBr
OH
P59
M-9-9
Sintesi:
Br 1. Mg, Et2O
OH
H3PO4
O3
P59
H2O2
2. O
Un altro modo di ottenere cicloeseni è la riduzione di Birch (M-5-10):
Na
NH3 liquida
45
Per esempio nel caso di P60:
OCH3
OCH3
OCH3
O
t.g.f.
OCH3
O
OH
O
P60
Quello che segue è un bell’esempio di disconnessione dove la sintesi
ci porta da un ciclo a 6 ad un prodotto (P61) con un ciclo a 5.
O
O
O
P61
Sintesi:
peracido
NaIO4
H2O
O
OH
H+
O
O
N
H
P61
OH
46
Esercizi: proporre una retrosintesi per i composti P62, P63 e P64
OH
O
P62
O
AcO
P63
O
O
OCH3
P64
OCH3
O
47
RIASSUNTO DELLE DISCONNESSIONI DI DERIVATI 1,-DICARBONILICI
1,2
1,3
1,4
1,5
1,6
48
In molti casi si è vista la necessità di introdurre un gruppo protettore...
Caratteristiche di un gruppo protettore:
•
•
Deve poter essere introdotto e rimosso senza modificare altri gruppi
funzionali presenti nella molecola;
Deve sopportare le condizioni di reazione che portano alla
modifica di altre parti della molecola.
Di conseguenza: NON ESISTE UN SOLO GRUPPO PROTETTORE
PER UN CERTO GRUPPO FUNZIONALE!
La scelta del gruppo protettore dipende:
•
dalle condizioni di reazione cui il gruppo funzionale protetto
deve essere sottoposto;
•
dalla presenza di altri gruppi funzionali analoghi;
•
dalla necessità di deproteggere la funzione in maniera selettiva
(protezione ortogonale).
Un gruppo protettore può anche essere utilizzato per alterare la reattività
di altre funzioni presenti nella molecola.
49
ROH
TsOH,
CH2Cl2
20°C
1,5 h 100%
O
O
H3C
O
OR
O
H3C
R
O
Cl
NaH, THF, 80%
AcOH, THF
H2O (4:2:1)
45°C, 3,5 h
Stabile in condizioni
basiche;
MOM è stabile
nello sblocco
HCl conc., tracce
MeOH, 60°C,
15 min
Stabile in condizioni
basiche
HgCl2, CH3CN
25°C, 1-2h
88-95%
Stabile in condizioni
acide;
qualche difficoltà
ad introdurlo
Bu4N+F-, THF
condizioni aprotiche
Può essere
sensibile sia a
condizioni acide
che basiche
MOM (metossimetil-)
H3C
S
O
R
MTM (metiltiometil-)
Si O
R
TMS-OR
H3C
S
Cl
NaH, DME, NaI,
0°C, 1h poi 25°C
86%
Me3SiCl, Et3N
THF, 25°C
8h, 90%
50
R2NH
O
NR2
O
(BOC)2O, NaOH
H2O, 25°C
10-30 min, 75-95%
3M HCl, EtOAc,
25°C, 30’, 96%
oppure CF3COOH,
PhSH, 20°C, 1h,
100%
Resiste a
condizioni basiche
e all’attacco di
molti nucleofili
H2/Pd-C
Sensibile anche a
condizioni acide
Anidride ftalica
CHCl3, 70° C
4h, 85-93%
NH2NH2, EtOH,
25°C, 12h poi
H3O+, 76%
Resiste a condiz.
acide e a nucleofili
tradizionali
Fmoc-Cl. NaHCO3,
diossano acquoso,
88-98%
Ammina
secondaria, pochi
minuti
Molto stabile in
condizioni acide
BOC
O
O
PhCH2OCOCl,
NR2 Na2CO3, H2O, 0°C,
30’, 72%
Cbz- o Z-
O
NR
O
O
Fmoc-
NR2
O
51
C=O
O
R'
nO
R
S
R'
nS
R
n=1,2; R’=H, R
HOCH2(CH2)nOH
TsOH, Benzene,
riflusso (DeanStark)
Acetone, acido
(cat), H2O, reflux,
100%
Ordine di reattività
di sblocco:
R’=R: n=2>n=1
R’=H; n=1>n=2
HSCH2(CH2)nSH,
BF3-Et2O, CH2Cl2,
25°C, 12h,
quantitativo
Hg(ClO4)2, MeOH,
CHCl3, 25°C, 5’,
93%
Si possono
proteggere
selettivamente
aldeidi in presenza
di chetoni
10% NaOH, 25°C,
30’, 80%
Può permettere di
proteggere
ortogonalmente
l’altro C=O
HgCl2, CdCO3,
acetone, H2O,
25°C, 55-65%
Protezione selettiva
del gruppo
aldeidico di un
derivato 1,3dicarbonilico
n=1,2; R’=H, R
O
OAc
O
O
Ac2O, risc, 1h,
94%
R
O
O
H
BuSH, MgSO4,
TsOH, benzene,
25°C, 8h, quantit.
52
4. PERICICLICHE
Abbiamo già visto esempi di reazioni pericicliche, in particolare la reazione
di Diels Alder. Nel progettare una Diels Alder bisogna ricordare che le
condizioni migliori richiedono un diene “ricco di elettroni” ed un dienofilo
“povero di elettroni”. Questa disconnessione va bene:
CO2CH3
CO2CH3
O
O
Co2CH3
Co2CH3
Come si può disconnettere P65?
H
O
O
H
H
H3CO
P65
O
H3CO
P65A
O
Siamo sicuri che la stereochimica dei 3 idrogeni sarà corretta?
(v. M-5-47)
53
Come si può fare P65A?
t.g.f.
O
OH
H
+
H3CO
P65A
H3CO
H3CO
H
Vediamo ora una retrosintesi di P66:
CO2Me
CO2Me
CO2Me
+
CO2Me
CO2Me
CO2Me
Br
OMe
P66
OMe
OMe
CHO
OMe
54
PARTE 5: DISCONNESSIONI IN COMPOSTI CONTENENTI ETEROATOMI
La presenza di un eteroatomo in una catena idrocarburica individua un punto di
facile disconnessione. Ad esempio nel caso di P67:
P67
Quella che segue è una buona strategia?
NH2
+
Br
NO! Perché si può avere
polialchilazione
N
H
Questa sintesi invece funziona:
O
NH2
Cl
+
O
N
H
LiAlH4
N
H
55
Una buona strategia per sintetizzare ammine variamente sostituite è,
in generale, la riduzione di una serie di gruppi funzionali:
O
R
LiAlH4
NHR'
RCN
LiAlH4
(o H2-Pd)
R1
R
NHR'
RCH2NH2
R2
NOH
RNO 2
LiAlH4
R1
(o Na in EtOH)R2
LiAlH4
(o H2-Pd)
NH2
RNH2
Quale strategia si può seguire per P68?
P68
56
Suggerire due vie alternative per la retrosintesi di P69
(suggerimento: CN o NO2)
P69
Se l’eteroatomo è parte di un ciclo e se l’anello è di 5 o 6 atomi la chiusura
dello stesso a partire dalla molecola lineare è altamente favorita. Es. P70
EtOOC
O
N
O
HN
EtO
O
Br
+
+
O
EtO
CH3NH2
57
In questo caso non ci si deve preoccupare della plurialchilazione dell’ammina!
Un altro esempio è costituito dal primo passaggio della retrosintesi di P70
O
O
HN
O
P70
H2N
NH2
NH2
O
O
O
+
O
O
O
O
O
H3CO
H3CO
O
H3CO
N
O
via
enammina
La formazione di enammine può portare a eterocicli azotati insaturi come
in questo caso:
O
NH
H+
N
58
Esempio di P71
O
N
+
O
O
P71
O
O
O
O
O
O
O
Per il prodotto furanico P72 ovviamente non serve ammina:
EtO
O
Cl
O
+
O O
O
O
P72
59
Esercizi: proporre retrosintesi accettabili a partire dai prodotti P73 e P74
COOMe
S
O
H
P73
O
P74
O
O
H
H
H
HN
60
6. SINTESI DI PICCOLI ANELLI (3 o 4 MEMBRI)
La sostituzione nucleofila intramolecolare è un approccio possibile:
O
O
X
Per motivi entropici questa strategia
è molto meno usata per i cicli a 4
Un altro approccio importante ad anelli a tre atomi è la reazione di un
alchene con un opportuno reagente.
X
X
H O
X può essere un carbene o “ossigeno”;
in questo caso per esempio si può usare
H
un peracido
O
OCH3
H
RCO3H
+
+
OCH3
61
H3CO
PPh3
Se invece l’olefina è elettrofila allora come sorgente di ossigeno si deve usare
acqua ossigenata in ambiente basico (HOO-) come nel caso di P75
O
O
O
O
O
O
O
+
O
EtO
P75
O
2x
Vi sono poi approcci alternativi:
R
O
RCH
O
R
O
+
O
+
O
(reazione di Darzens: vedi P55)
Cl
O
O
S+ CH2- +
zolfo ilide
O
62
Un esempio è la disconnessione di P76:
CH3
CH3
CH3
H3C
+
H
O
H
attenzione!O
H
O
P76
O
analogo a P75
Una strategia importante per gli anelli a quattro membri è una cicloaddizione
2+2 di due alcheni. La reazione non avviene per via termica ma per via fotochimica.
Un modo di ottenere P77 è quello di irradiare il norbornene:
2X
P77
63
Nel 1964 Corey ha proposto la sintesi di P78:
H H
HO
O
HO
O
+
H3C H
Zn
P78
HBr
Br
Na-Hg
Br
Questa reazione rappresnta
una via alternativa alla sintesi
di 1,2-dioli simmetrici che non
si è discussa. (v. M-9-62)
Un altro esempio è la sintesi di P79:
O O
O
O O
OCH3
OCH3
2X
OCH3
+
H3C
O O
OCH3
O O
P79
64
Come esercizio ora la sintesi di P80:
a
O
P80
O
O
O
O
O
=
b
O
+
O
O
O
Per la via a il passaggio successivo è quello di cominciare a disconnettere
i due doppi legami. Si tratta ovviamente di una via più lunga!
65
Esercizi di riepilogo
P81
P82
COOH
P83
N
Cl
P84
H
H
O
66
Parte 7. STRATEGIE di SINTESI
A. Una sintesi convergente è da preferirsi rispetto ad una lineare!
Una sintesi in 5 passaggi consecutivi ciascuno con resa del 90% dà il prodotto
finale con resa del 59%.
Se sintetizziamo due intermedi in due passaggi ciascuno con resa sempre del
90% per passaggio e poi li accoppiamo (sintesi convergente) la resa totale sarà
del 73% (ho fatto comunque 5 reazioni)
Progettiamo una sintesi convergente di P85:
HO
N
P85
67
Ci sono tre modi di disconnettere la molecola a partire dalla funzione
alcolica:
a
MgX
O
N
a
HO c
b
b
MgX
O
N
N
c
XMg
N
O
Tra queste tre vie a e c sembrano più interessanti perchè l’anello aromatico
68
può essere funzionalizzato via Friedel-Craft.....
...via a:
O
Mannich
O
CH2O
N
N
O
Cl
...via c:
Cl
O
X
O
N
O
N
Scrivere ora le due sintesi e vedere se una delle due si presta ad un
approccio convergente
69
Una buona filosofia per una sintesi convergente è:
- cercare la semplificazione maggiore
- utilizzare punti di ramificazione
B. UTILIZZO DI “TRUCCHI”
1. Conversione di un legame C-eteroatomo in un legame C-C
OH
Come sintetizzare P86?
base
OH
Br
O
P86
riscald.
P86
riarrangiamento di Claisen
70
Come si può sintetizzare P87?
O
O
O
+
P87
O
OH
O
O
OEt
2. Individuare atomi in comune in composti policiclici
Esempio P88:
H
O
a
=
O
a
b
P88
O
H
b
O
H
O
P88A
Quello che si deve fare
è ora trasformare uno
dei due atomi marcati in
nucleofilo e l’altro in
elettrofilo....per esempio:
=
H
H
= atomi in comune
TsO
H
O
71
3. Prendere in esame tutte le disconnessioni possibili.
Prendiamo in esame questo lattone come semplice esempio:
+
HOCH2
-
HOCH2
oppure
COOH
+
COOH
a
O
O
b
t.g.f.
HO a
c
OH
b
O
-
OH
O
O
c
+
HO
- COOH
oppure
HO
+COOH
Dobbiamo ora verificare la disponibilità (e convenienza) dei sintoni dei frammenti
72
cui siamo arrivati!
4. Aggiunta di un gruppo funzionale in una posizione strategica
Un buon esempio è costituito da P89:
P89
Sarebbe utile ora introdurre dei gruppi che facilitino la retrosintesi
e che poi possano essere facilmente utilizzati per introdurre il nuovo
legame (attenzione alla polarità degli atomi di carbonio marcati!).
L’esempio di P88 è una buona guida...
A o B come punti di partenza?
Ricordate questo dichetone?
73
Sintesi....
P89
74