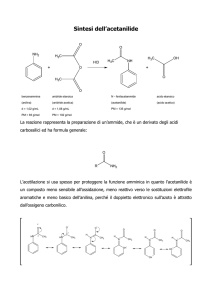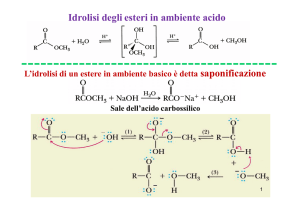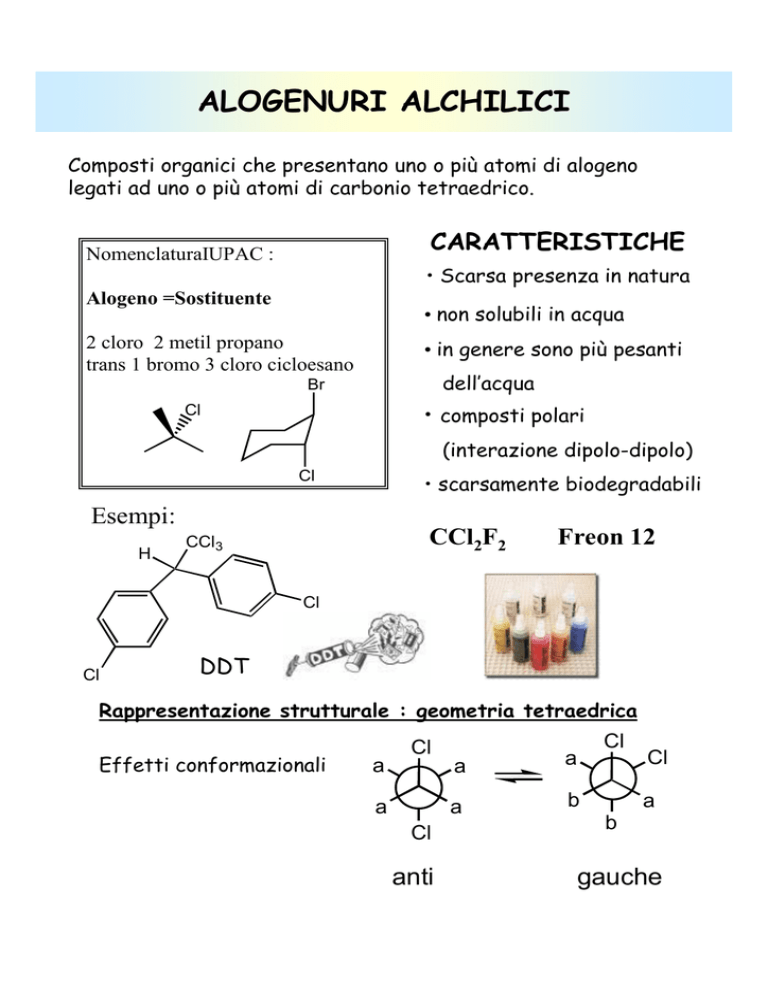
ALOGENURI ALCHILICI
Composti organici che presentano uno o più atomi di alogeno
legati ad uno o più atomi di carbonio tetraedrico.
CARATTERISTICHE
NomenclaturaIUPAC :
• Scarsa presenza in natura
Alogeno =Sostituente
• non solubili in acqua
2 cloro 2 metil propano
trans 1 bromo 3 cloro cicloesano
• in genere sono più pesanti
dell’acqua
Br
• composti polari
Cl
(interazione dipolo-dipolo)
• scarsamente biodegradabili
Cl
Esempi:
H
CCl2F2
CCl3
Freon 12
Cl
Cl
DDT
Rappresentazione strutturale : geometria tetraedrica
Effetti conformazionali
a
Cl
a
Cl
anti
Cl
a
a
a
b
Cl
a
b
gauche
IN VETRINA
Gli alogenuri alchilici e lo strato di ozono.
I propellenti volatili utilizzati negli spray sono un
gruppo di alogenuri alchilici detti freon .
Vantaggi: non infiammabilità, chimicamente inerti,
non tossici, non lasciano residuo.
Svantaggi: raggiungono l’atmosfera.
CCl2F2
Cl • +O3
hλ
• CClF2 + Cl •
O2 + ClO
Lo strato di Ozono fa da filtro
per le radiazioni ultraviolette
più energetiche, proteggendo
la vita sulla terra.
Oggi i CloroFluoro carburi
(CFC) sono banditi.
STRUTTURA e REATTIVITA’
δ+
regione
nucleofila
X
C
δ−
X
regione
elettrofila
SOSTITUZIONE NUCLEOFILA
-
X
R
X'
R
OH
-
OH
R
X
+X
-
CN
R
CN
-
R = alchile
x = Cl, Br, I..
SH
R
Reattività Crescente per Cl < Br < I
ELIMINAZIONE
R
R''
R'''
C
C
H
X
base
''R
R'''
C
R'
R
C
R'
β eliminazione o 1 , 2 eliminazione
+
H
X
-
SOSTITUZIONE : Fatti Sperimentali
R
Br
acetone
+ NaI
R
+ NaBr
I
velocità : R = CH 3-> CH3CH2- > (CH 3)2CH- >(CH 3)3C1000
1
0,01
velocità = k2 [ C2H5Br ] . [ NaI ]
reazione del 1° ordine in ciascun reagente ; del 2° ordine globale
k2 rappresenta l’ Eatt e l’ Orientazione ( fattore entropico)
Una Spiegazione plausibile :
Più bassa elettro negatività dei radicali
alchilici rispetto al H
Maggiore ingombro sterico
R
Br
+ H 2O
velocità :
acetone acquoso
R
OH
+ HBr
(CH3)3C- >> (CH 3)2CH- > CH3CH24000
1
velocità = k1 [ (CH3)3CBr ]
reazione del 1° ordine globale
STUDI sulla VELOCITA’ di REZIONE hanno evidenziato,
per i due tipi di reazioni due percorsi, ovvero,
DUE MECCANISMI DIVERSI :
SN2 (sostituzione nucleofila bimolecolare)
SN1 (sostituzione nucleofila monomolecolare)
Ener.
Il meccanismo SN 2
*
La formazione e la rottura dei
legami avviene simultaneamente:
Eatt
reazione ad un unico stadio,
uno solo stato di transizione
C. R
∗ Stato di Transizione: il punto di massima energia che il
sistema raggiunge per arrivare ai prodotti.
I
I
C
C
oppure
Br
Br
Configurazione dello stato di transizione:
INVERSIONE O RITENZIONE?
Br
H
H
I
I
-
cis
trans
H
CH 3
H
H
CH 3
I
Br
H
Itrans
cis
H
CH 3
H
CH 3
La velocità diminuisce all’aumentare dell’ingombro sterico.
NUCLEOFILICITA’
La velocità della reazione SN2 è fortemente dipendente dal
nucleofilo usato:
MeOH
CH3J + NuCH3-Nu + J-
CH3COO- Cl1
Br-
1.1
30
CH3O- SCN93
210
CN240
J-
SH-
1270 4800
• Differenti Nucleofili, a parità di atomo attaccante, seguono:
la Base di Bronsted più Forte è anche il Nucleofilo più forte.
• Nucleofili che appartengono allo stesso Gruppo (Cl, Br, J
oppure O, S) seguono: la Polarizzabilità aumenta scendendo
(atomi più grandi sono più polarizzabili).
EFFETTO SOLVENTE
L’effetto generalmente è scarso per i solventi APOLARI (i più usati).
I solventi polari protici con nucleofili Anionici, stabilizzandoli,
diminuiscono la velocità.
GRUPPO USCENTE
J > Br > Cl
C – Cl
81
perchè segue l’energia di legame
>
C – Br
68
>
ma anche la stabilità dell’ anione :
C–J
51
J- > Br- > Cl-
Il migliore gruppo uscente risulta essere la base coniugata
dell’acido di Bronsted più forte.
Il meccanismo SN 1
Si può postulare un meccanismo alternativo a due stadi :
• Formazione del legame antecedente la rottura ⇒ inverosimile
• Rottura del legame che precede la rottura ⇒ verosimile
1° stadio: rottura eterolitica
C
+ X
C
X
2° stadio: formazione del legame fra il nucleofilo e il Carbocatione
C
+ Nu -
C
Nu
Il 1° stadio risulta essere fortemente ENDOTERMICO: ∆H = + 227 Kcal/ mol
( separazione di cariche di segno opposto).
Forte effetto del SOLVENTE
• Costante dielettrica ε (capacità di tenere separate le cariche)
H2O
81
CH3OH
33
CH3SOCH3
45
HCOOH
58
HCON(CH3)2
38
• Solvatazione
O
H
H
H
H
O
H
C
O
X
H
O
H
H
H
O
H
H
H
O
Ad Es. la ionizzazione del CH3–J in H2O mostra un ∆H = + 63 Kcal/mol.
Quindi abbiamo un effetto stabilizzante di 164 Kcal/mol.
Energia
E2*
C
E1*
C
X
C
Nu
Coordinata d i Reazione
1° stadio fortemente endotermico; 2° stadio fortemente esotermico
Stereochimica della SN 1
Il CARBOCATIONE INTERMEDIO ha geometria trigonale planare.
Quindi subisce l’attacco del nucleofilo da entrambe le facce dando origine
a ISOMERI al 50 % (RACEMIZZAZIONE se si parte da un alogenuro
otticamente attivo).
X
Nu
CH 3
H3C
CH 3
C
H3C
H3C
C
H3C
CH 3
Nu
-
H3C
H3C
C
X
H3C
CH 3
H3C
Nu
H3C
H3C
H3C
C
C
H3C
H3C
H3C
H3C
Ionizzazione (lenta)
CH 3
veloce
Stabilità dei CARBOCATIONI
R
R
R
3º
R
R
R
2º
H
>
1º
H
H
H
H
>
H
>
super 1º
Effetto Induttivo : diseguale condivisione degli e- di legame fra atomi
di diversa elettronegatività
L’ H è più elettronegativo del C
Il Carbonio del Carbocatione ibridato SP2 è più
elettronegativo del carbonio SP3 del radicale R
avendo maggior carattere S
Postulato di Hammond
Lo stato di transizione di una reazione fortemente endotermica
rifletterà la situazione energetica e strutturale dei prodotti in
grado maggiore che non dei reagenti.
Questo comporta che ogni sostituente che tende a stabilizzare il
prodotto di questa reazione stabilizzerà anche lo stato di
transizione che porta ad esso.
Viceversa per le reazioni fortemente esotermiche.
Attraverso questo postulato possiamo spiegare la competizione tra i due
percorsi ( SN2 e SN1) per un alogenuro 1°, 2°, 3° : il CH3- J avrebbe uno
stato di transizione troppo elevato con la SN1, essendo un carbocatione
molto instabile, mentre ha uno stato di transizione più basso nella SN2.
Il Postulato di Hammond lo dobbiamo avere presente in TUTTI i
meccanismi di reazione che vedremo.
Riarrangiamenti molecolari
CH 3
H3C
C
CH 2
H3C
Br
CH 3
CH 3
ROH , H 2O
C
CH 2
OR
+ H3C
normale
CH 3
C
CH 3
riarrangiato
CH 3
+
C 1º H C
3
CH 2
OR
CH 3
CH 3
C
CH 2
H3C
C
CH 2
CH 3
+
C 3º
CH 3
Quando per trasposizione si può ottenere un Carbocatione più stabile,
si possono osservare prodotti di riarrangiamento.
• Effetto Solvente : Notevole
(stabilizzazione o destabilizzazione dell’intermedio carbocationico)
• Gruppo Uscente : J > Br > Cl - come nella SN2
• Nucleofilicità : essendo il Carbocatione molto “energetico” reagisce con
qualsiasi Nucleofilo presente, indipendentemente dalla diversa nucleofilicità.
REAZIONI di ELIMINAZIONE
R'' R'''
R
C
C
H
X
base
''R
R'''
C
R'
+
C
R
H
X
R'
β eliminazione o 1 , 2 eliminazione
Fatti sperimentali: la facilità di questa reazione varia con la
struttura dell’alogenuro della Base di Bronsted e del Solvente,
è sempre in competizione con le reazioni di Sostituzione.
CH 3 CH 2CH 2Br
+ KOH
H3C
CHBr
+ KOH
H3C
C2H5OH
CH 3 CH 2CH 2OC 2H5
70%
H
CH 2
+ KBr
30%
H3C
C2H5OH
lenta
H3C
CH 2
C
+
H
100%
H3C
H3C
+ KOH
CBr
H3C
C2H5OH
H3C
veloce
H3C
+ KBr
CH 2
100%
Regola di SAYTZEFF
Quando un alogenuro alchilico può dare più di un
alchene predomina l’alchene più sostituito.
H3C
H3CH 2C
C
Br
C2H5OH
KOH
CH 3
H3C
C
H
+
C
CH 3
CH 3
75%
H
H3C
C
H2C
CH 3
Lo stato di transizione riflette la stabilità
dell’alchene finale (il più sostituito).
C
H
25%
Il Meccanismo di Eliminazione Bimolecolare E2
V = k2 ( R – X ) ( Base )
CH 3
H3C H
Cl
H
Alchene più
sostituito
C2H5OH
KOH
H3C
H3C H
H
H
Cl
H
H
H
C2H5OH
KOH
Alchene meno
sostituito
H
Configurazione dello stato di transizione:
B
Trans Coplanare
H
X
Il Meccanismo monomolecolare E 1
Con solvente fortemente ionizzante e scaldando si osserva :
V = k1 ( R – X )
H3C
H3C
C - Br
H2O - DMSO
∆
H3C
H3C
H3C
+ HBr
CH 2
100%
CH 3
H3C
CH 2
H
H2O
Competizione tra Sostituzione ed Eliminazione
Di fondamentale importanza risulta essere la Basicità
secondo Bronsted del Nucleofilo :
J- < Br- < Cl- << F- < CH3COO- < SH- < CN-- << OH- < RO- << NH2- < CH3Basi
Molto deboli
deboli
forti
molto forti
V ariabile
SN 2
E 2
X
J > Br > Cl
J > Br > Cl
G ruppo alchilico
1°>2°>3°
3 °> 2 ° > 1 °
N ucleofilo
-
A um ento della velocità
all’aum entare della
nucleofilia
A um ento della velocità
all’aum entare della
basicità
Composti Organometallici
Legame fra un Atomo di C ed un atomo Metallico
Tale legame può essere visto
O quasi totalmente COVALENTE (ad es. con il Silicio Si )
O quasi totalmente IONICO (ad es. con il Litio Li )
Li
Si (CH 3 )3
Reattivi di Grignard : rivestono un ruolo importante nella
sintesi organica perché facili da preparare.
δ+
δ−
Mg
X
δ−
δ+
MgX
Etere Etilico
anidro
I composti Organo metallici sono sorgenti di
CARBANIONI ovvero di nucleofili al Carbonio