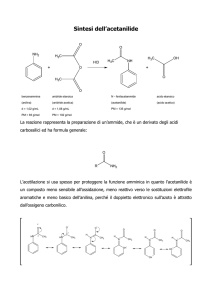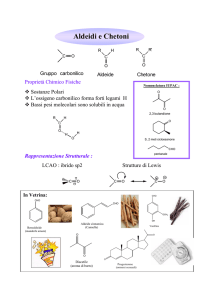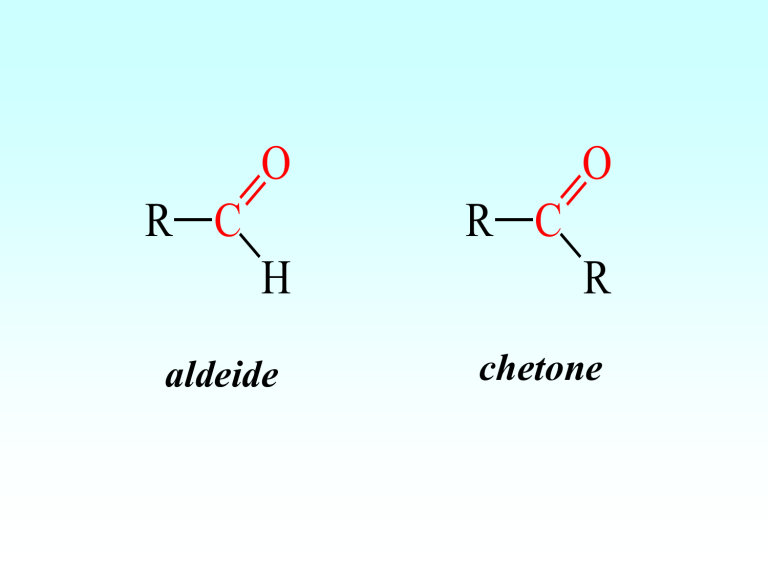
O
R C
O
R C
H
aldeide
R
chetone
Il nome delle aldeidi si costruisce facendo seguire la
desinenza -ale al nome dell’idrocarburo saturo ad ugual
numero di atomi di carbonio.
O
H
O
H C
H3C
H
H3C C C
C
H
metanale
aldeide formica
H H
O
H3C C C C
H H
O
H
H
etanale
propanale
aldeide acetica
aldeide propionica
H CH3
O
H C C C
H
H H
H
butanale
metilpropanale
aldeide butirrica
aldeide metilpropionica
La vecchia nomenclatura (ancora in uso) è riportata in corsivo sotto
la nomenclatura IUPAC.
Per i chetoni il nome si costruisce facendo seguire la
desinenza -one al nome dell’idrocarburo saturo ad ugual
numero di atomi di carbonio.
O
H3C C
O
H3C C
CH3
propanone
O
H3C C
CH2CH3
butanone
CH2CH2CH3
2-pentanone
p
R
s
H
xy
R
H
C
O
p
R2
s
R1
xy
R2
R1
C
O
dd+
O
R C
O
R C
R
R
Risonanza fra due forme limite
O
H
H
OH
C
C
H
C
H
H
H
H
C
C
H
H
C
H
H
Tautomeria cheto-enolica
OH
O
H
C
C
H
H
H
H
C
C
H
Movimento concertato di elettroni e protoni intramolecolare
H
Reattività del gruppo carbonilico:
addizione nucleofila
L’addizione nucleofila di acqua ad un’aldeide in ambiente
alcalino, il cui meccanismo è questo :
H
R
-
OH
H
R C OH
C
O
O
H
H2O
R C OH
OH-
OH
aldeide idrata
porta alla formazione di una aldeide idrata (gem-diolo)
Meccanismo attraverso il quale una aldeide addiziona
acqua per formare un’aldeide idrata, ma in ambiente acido.
H
H
H H+
R C O H
R C
R C
O
O H
H H
OH
OH
H+
H
R C OH
OH
aldeide idrata
La forma idrata delle aldeidi viene anche chiamata
gem-diolo.
H
H
R
H+
2 R'OH
C
R
O
R
H+
2 R'OH
C
O
OR'
OR'
R
R
C
R
C
OR'
OR'
La reazione dei composti carbonilici con gli alcoli, nel
rapporto stechiometrico di 1:2, porta alla formazione degli
acetali. Il meccanismo della reazione è il seguente :
H
+
H
H
H
R
R C
O
O R
H H
R C O R
C
OH
OH
H+
H
R
C OR
OH
emiacetale
L’addizione nucleofila di una molecola di alcole ad un’aldeide
o ad un chetone porta alla formazione di un emiacetale.
H
R
C OR
H+
H
H
R
OH
OH
emiacetale
R
C OR
C OR
H2O
ROH
H
H
R
C OR
OR
H+
H
R
R
C OR
O
H
acetale
Dalla reazione dell’emiacetale con una seconda molecola di
alcole si ottiene un acetale, con meccanismo di sostituzione
nucleofila.
OH
O
R'OH
R C
H
R C OR'
H
L’equilibrio della reazione di formazione
dell’emiacetale è quasi completamente spostato a
sinistra.
(In assenza di un catalizzatore acido non si può verificare la reazione
dell’emiacetale con la seconda molecola di alcole (che è una sostituzione
nucleofila) e quindi non si forma l’acetale.)
H
H
O
C
O
H
O
O
C O
C
H
H
Le g- e le d-ossialdeidi possono invece
formare emiacetali ciclici stabili
OH
OH
O
O
C OH
C
O
H
H
C
R
H
Data la possibilità di rotazione del
gruppo carbonilico intorno al legame
C1-C2 si possono ottenere i due
emiacetali enantiomeri
C
OH
O
H
C
C H
O
OH
S
Il legame chimico alla base della polimerizzazione di zuccheri
semplici è un legame acetalico
Quando si fa reagire un’aldeide o un chetone con tioli
si ottiene la formazione di un emitioacetale.
L’emitioacetale reagisce successivamente con una
seconda molecola di tiolo per formare un tioacetale.
O
R C
H
OH
R'SH
R C
R'SH
R C
SR'
H
emitioacetale
SR'
H2O
SR'
H
tioacetale
H
H
R
R' NH2
C
H2O
C
N R'
O
Aldeide
R
+ ammina
aldimmina
(Base di Schiff)
+ acqua
H
H H
CH3
H3C C N CH3
H N H
H3C C
O
O H
Per
L’ammina
trasposizione
conduce
di due
un attacco
protoni ed
eliminazione
nucleofilo suldicarbonio
una molecola
carbonilico
di
acqua si forma l’aldimmina (base di Schiff)
C N CH3
H3C
H
H
H
aldimmina
H3C C N CH3
H3C C N CH3
H2O
O
H
H
H
H
C
H3 C
C
H
H
H
H
N
H3 C
O
C H
C
N
OH
L’ammina secondaria compie
Per eliminazione di una molecola
un attacco nucleofilo sul carbonio
di acqua si forma l’enammina
carbonilico
H
H
H
C H
C
H3C
C
H3C
N
enammina
H2O
H
C
N
O
H
Per reazione di un’aldeide con HCN si ottengono due
cianidrine stereoisomere, essendo possibile l’attacco
dello ione CN- su ambedue le facce del piano di
ibridazione sp2 del carbonio carbonilico.
C N
C N
H
H3C
C
O
H+
H
H3C C
O
C N
H+
C
H3C H OH
Sinister
OH
H
H3C
C
C N
Rectus
H
H
H
O
forma carbonilica
(etanale)
H
H
H
C C
H C C
H C C
H
H
O
H
OH
forma enolica
(alcol vinilico)
La tautomerizzazione di un’aldeide è favorita
dall’ambiente basico.
H
H
C
H
OH-
H
C
C
OH
H
H2O
C
C
O
H
H
H
C
O
H
H2O
forma enolica
OH-
H
H
H C
H C C
H
H
O
forma carbonilica
H
H
C
O
Condensazione aldolica
a)
H
H C
H
OH-
H
C
C
O
H
H2O
H
H
H
H
C
C
O
C
O
H
Nella prima tappa si produce un anione enolato ...
b)
H
H C
H
H
H
C
C
O
H
H H H
H
H C
C
O
C
C
H O H
H
C
O
… che nella seconda tappa compie un attacco nucleofilo su
una seconda molecola di aldeide
c)
H H H
H C
C
C
H O H
H
C
O
H H H
H2O
OH-
H C
C
C
H OH H
H
C
O
Nell’ultima tappa della reazione si forma una b-idrossialdeide.
H
H H
-
OH
1
2
H
H2O H3C
O
H
C C
H3C C C C
2 H3C C
3
O
OH H
H
C H
O
3-idrossibutanale
(aldolo)
etanale
trans-2-butenale
(aldeide crotonica)
Nello stesso ambiente che ha portato alla loro sintesi,
dalle b-idrossialdeidi e dai b-idrossichetoni, per eliminazione
interna di acqua, si ottengono aldeidi e chetoni a,b-insaturi
-
CH3 OH
2 H3C
C
O
CH3 H
H2O H C
3
CH3
H3C C C C
OH H
O
H3C
H
C C
C CH3
O
4-metil-4-idrossi-2-pentanone
(aldolo)
4-metil-3-pentene-2-one
La eliminazione interna di acqua si ottiene aumentando
la temperatura del sistema , ad es. riscaldandolo o irradiandolo con UV
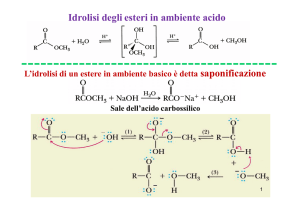
Le aldeidi si ossidano ad acidi carbossilici, mentre l’ossidazione dei
chetoni si produce soltanto in condizioni di reazione molto energiche
(con rottura di legami C-C).
Se è presente un gruppo alcolico primario in posizione a rispetto al
gruppo carbonilico, anche i chetoni possono essere ossidati, in ambiente
basico.
H
CH3CH2
C
O
Cu2+
O
H
H3C
C
O
NaOH, tartrato di sodio
H2O
CH3CH2
OH
O
Ag+
NH3
H2O
Cu2O
C
H3C
C
OH
Ag
Dosaggio chimico del glucosio