Lavoro(2)
Ø Il lavoro totale effettuato da un gas quando il suo volume varia da un volume
iniziale Vi ad un volume finale Vf è dato dall’integrale:
Vf
L = ∫ PdV
Vi
Attenzione: durante la variazione di volume possono cambiare anche T e P =>
L’integrale dipende da come varia P in funzione di V
Si può passare dallo stato i allo stato f in vari modi, ad ognuno dei quali sarà associato un
lavoro diverso
Se la pressione ed il volume sono noti in ogni punto della trasformazione, questi possono essere
riportati in un diagramma PV
Espansione di un gas ( processo quasi-statico) dallo stato
iniziale i allo stato finale f.
Il lavoro è pari all’area sottesa dalla curva nell’intervallo di
volume tra Vi e Vf
P
Pi
i
Pf
Il lavoro svolto su un gas in una trasformazioni quasistatica da uno stato iniziale i ad uno stato finale f è
l’area sotto la curva del diagramma PV calcolata tra
lo stato iniziale e lo stato finale
f
L>0
Vi
Vf
V
Il lavoro dipende dal cammino effettuato!
Lavoro(3)
(a)
P
P
Vf
i
Pi
L( a ) = ∫ P(V )dV
Pi
Vi
f
Pf
L( b ) = Pi (V f − Vi )
i
Pf
L>0
(b)
P
Pi
f
L>0
Pf
L( c ) = Pf (V f − Vi )
(c)
i
f
L>0
Vf
V
Vi
Vf
Vf
V
V
Vi
Vi
(b) Il cambiamento avviene in due fasi:
1)Espansione a pressione costante (isobara) => Si aumenta la temperatura della sorgente e si lascia che il volume aumenti l
2) Diminuzione di pressione a volume costante (isocora)=> Si fissa il pistone e si diminuisce la temperatura (la pressione
diminuisce fino ad arrivare a Pf
L(c ) < L( a ) < L(b)
(c) Il cambiamento avviene in due fasi:
1) Diminuzione della pressione a volume costante (isocora)
2)Espansione a pressione costante (isobara)
P
Pi
L( d ) = Pm (V f − Vi )
(d)
i
Pi
f
Pf
Pm
Vi
P
Pm
Vf
L( d ) = Pm (V f − Vi )
i
f
Pf
V
(e)
Vi
Vf
V
La trasformazione può avvenire compiendo un lavoro tanto
piccolo (d) o tanto grande (e), quanto si vuole
Lavoro(4)
Consideriamo le due trasformazioni in figura, entrambe partono da uno stesso stato iniziale
definito da Ti, Vi, Pi ed arrivano ad uno stesso stato finale.
(a) In questa trasformazione il gas è in contatto con un serbatoio di
energia a temperatura Ti ed il volume è mantenuto costante da una
forza esterna che preme sul pistone.
Ad un certo punto la forza comincia a diminuire molto lentamente
Il gas si espande lentamente fino a raggiungere il volume finale
ΔV>0 => L>0 ( il gas compie il lavoro)
Q≠ 0 =>Durante questa espansione viene fornito calore dall’ambiente
per mantenere T costante
(b)Espansione libera
In questa trasformazione il sistema è completamente isolato
Il gas è mantenuto al volume iniziale da una membrana, ed al di là della
membrana c’è il vuoto.
Quando si rompe la membrana il gas si espande velocemente a riempire la
regione di vuoto fino ad occupare tutto il volume finale Vf
La pressione finale è Pf
La temperatura finale risulterà essere uguale a quella iniziale
L=0
=>in quanto nessuna forza agisce sul gas
Q=0
L’energia trasferita sotto forma di calore, analogamente al lavoro compiuto dipende
dalla trasformazione avvenuta per andare dallo stato iniziale a quello finale del
sistema
Ciclo termodinamico
Ciclo termodinamico: Serie di trasformazioni termodinamiche durante le quali
sistema viene portato da uno stato i a degli stati intermedi per poi tornare di
nuovo allo stato i.
P
P
Pi
i
Pi
P
i
P
i
i
ΔV>0
Lif >0
Pf
Vi
f
Vf
Pf
V
ΔV<0
Lfi <0
Vi
f
Lnet >0
f
P
f
Vf
V
Vi
Vf
V
Il lavoro in un ciclo termodinamico è la somma dei lavori effettuati durante le
trasformazioni ( lavori che possono essere positivi se la trasformazione prevede
un’espansione o negativi se prevede una compressione)
Lnet= Lif + Lfi
Il lavoro in un ciclo termodinamico è l’area racchiusa dal cammino della
trasformazione
Esempio
Un gas perfetto compie due trasformazioni, nelle quali stato iniziale e stato finale sono gli stessi:
(f)
Pf=1.00·105 Pa
P
(1)
Vf=2.00m3
f
Pf
(i)
T=costante
Pi=0.20·105 Pa
Vi=10.0m3
i
Pi
Nella trasformazione (1) la temperatura rimane costante
ΔV<0
Lif <0
Nella trasformazione (2) prima la pressione, poi il volume rimangono costanti
Vi
V
Vf
Qual è il rapporto tra il lavoro compiuto dal gas nelle due trasformazioni?
• Per determinare il lavoro ricordiamo che:
L=
∫
Vf
Vi
(2)
P
nRT
P=
V
P dVe che PV = nRT
Pf
f
ΔV<0
Pi
• Poiché la trasformazione (1) avviene a T costante →P∝1/V
L<0
Vf
L1 =
()
∫
Vf
Vi
P dV =
∫
Vf
Vi
nRT
dV = nRT
V
∫
Vf
Vi
i
Vf
Vf
dV
= nRT ⋅ lnV = nRT ⋅ ln
Vi
V
Vi
Vi
• Nella trasformazione (2) si ha prima la compressione a pressione costante per la quale L=PiΔV
poi un aumento di pressione a volume costante ( lavoro nullo), quindi:
(
L 2 = Pi Vf − Vi
()
)
Vf
Vf
Vf
2.00
PiVi ln
Vi ln
10.0
⋅
ln
L 1 nRT ln V
Vi
Vi
()
10.0 = 2.01
i
R=
=
=
=
=
L 2 Pi Vf − Vi
Vf − Vi
2.00 −10.0
Pi Vf − Vi
()
(
)
(
)
V
Primo principio della termodinamica
Abbiamo visto che quando un sistema termodinamico passa da uno stato iniziale i ad uno
stato finale f , sia il lavoro che il calore dipendono dal tipo di trasformazione utilizzata
Sperimentalmente si trova però che la quantità (Q – L) è sempre la stessa indipendentemente
dal tipo di trasformazione
La quantità Q-L è proprio la variazione di energia interna del sistema quando passa dallo
stato i allo stato f ( ricordiamoci che L e Q sono funzioni di trasferimento di Energia)
Primo principio della termodinamica:
ΔEint = Eint, f − Eint,i = Q − L
ΔE Dipende solo dagli
stati iniziali e finali
Dove: Q >0 quando il calore è fornito al sistema
L >0 quando il lavoro è effettuato dal sistema ( es: durante un’espansione)
NB: in molti testi ( anche nel Serway) il primo principio si enuncia come:
ΔEint = Q + L
in questo caso viene usata la convezione che:
Q>0 quando il calore è fornito al sistema
L>0 quando il lavoro è compiuto sul sistema (es: durante una compressione)
NB: Il valore finale di ΔE sarà comunque lo stesso poiché il lavoro compiuto sul sistema è
sempre uguale al lavoro compiuto dal sistema cambiato di segno
Primo principio della termodinamica
ΔEint = Q − L
Il primo principio della termodinamica è un’estensione della legge della
conservazione dell’energia meccanica (valida solo per un sistema isolato) ai sistemi
non isolati ed afferma che:
la variazione dell’energia interna di un sistema è uguale alla somma
dell’energia trasferita mediante scambio di calore e mediante il lavoro
In forma differenziale:
dEint = ∂Q − ∂L
Dove il simbolo adottato per i differenziali di Q e L indicano che essi non sono differenziali
esatti, in quanto non è possibile scrivere funzioni del tipo Q(p,V) o L(p,V), dipendenti solo dallo
stato del sistema, noi li tratteremo solo come trasferimenti infinitesimi di energia
Il segno – adottato nella formulazione presentata della I legge della Termodinamica è
consistente con il fatto che l’ energia interna tende ad aumentare se nel sistema viene
trasferita energia sotto forma di calore e tende a diminuire se al sistema viene sottratta
energia sotto forma di lavoro compiuto dal sistema.
Applicazioni del primo principio della termodinamica
Analizziamo ora alcune trasformazioni termodinamiche di base e vediamo quali
conseguenze si trovano dall’applicazione del primo principio della termodinamica
Trasformazione
Caratteristica
Adiabatica
Q=0
Espansione Libera
Q=L=0
Isocora
Ciclo Chiuso
V = costante
ΔEint =0
Isoterma
T = costante
Isobara
P = costante
Trasformazione Adiabatica: Q = 0
Una trasformazione in cui il sistema risulta termicamente isolato dall’ambiente
viene chiamata Trasformazione adiabatica.
Durante una trasformazione adiabatica non c’è scambio di energia termica con
l’esterno e quindi Q = 0
Q=0
Trasformazione adiabatica
Q=0
ΔEint = − L
ΔEint = Q − L
3
ΔEint = nRΔT
2
Se L >0 (gas compie lavoro:espansione)
=>
ΔEint <0
=> T diminuisce
Se L <0 (gas subisce lavoro:compressione)
=>
ΔEint >0
=> T aumenta
L’equazione di stato la vedremo dopo
Esempio: Un gas contenuto in un cilindro isolato termicamente con un pistone tenuto fermo da
una certa quantità di pallini di piombo. Se si tolgono man mano i pallini di piombo il gas si
espanderà lentamente senza scambio di calore con l’esterno
Le trasformazioni adiabatiche sono alla base di molti cicli di motori a combustione interna
( sono la fase di compressione nei motori diesel)
Trasformazioni isocore: V = costante
Nelle trasformazioni isocore il volume rimane costante e quindi il lavoro del gas è
nullo:
dL = P dV
! =0
L=0
0
P
Pf
f
i
Pi
ΔV=0
L=0
V
V
La variazione di energia interna sarà quindi dovuta al solo scambio di calore
con l’ambiente
ΔE int = Q − L = Q
L=0
ΔEint = Q
Trasformazioni
isocore
Se Q> 0 (gas assorbe energia) => ΔEint>0 => ΔT>0 (la temperatura aumenta)
Se Q<0 (gas cede energia)
=> ΔEint<0 => ΔT<0
(la temperatura diminuisce)
Espansione libera
Ø L’espansione libera è un caso particolare di trasformazione adiabatica.
Ø Il sistema è isolato termicamente e quindi non c’è scambio di calore con l’esterno (Q=0)
Ø Il gas espandendosi non compie lavoro in quanto si espande in uno spazio vuoto ed il suo
moto non è contrastato da nessuna pressione (L =0 )
Ø Questa trasformazione non può avvenire lentamente
Ø Non c’è equilibrio termico durante il processo di espansione (ma solo allo stato iniziale ed a
quello finale)
Ø P,T,V non sono definiti negli stati intermedi e non è possibile tracciare un grafico della
trasformazione
Q=0
L=0
Per il primo principio della termodinamica si ha che:
ΔEint = Q − L = 0
Quindi, per una trasformazione libera si ha:
Q=0
L=0
ΔEint = 0
trasformazione libera
In un’espansione libera l’energia interna iniziale e quella finale di un gas sono
uguali
Poiché l’energia interna è direttamente proporzionale alla temperatura del gas, la
temperatura nelle espansioni libere non varia (T=costante) (sperimentalmente
dimostrato per espansioni a pressioni basse, per i gas reali si riscontra una leggera
variazione di temperatura)
Trasformazione isobara: P = costante
Se consideriamo un cilindro contenente gas con un pistone libero di muoversi, la pressione
all’interno del gas è legata alla pressione atmosferica ed al peso del pistone e quindi rimarrà
costante durante una trasformazione.
dL = PdV
ΔEint = Q − PΔV
L = PΔV
P
Pi
i
f
Trasformazione isobara
Vi
Vf
V
Trasformazione Isoterma: T = costante
Se la temperatura durante una trasformazione rimane costante la variazione di
energia interna è nulla poiché Eint ∝ T quindi anche Eint è costante
1
PV = nRT = costante
P∝
V
1
NB: y =
è l’equazione di un’iperbole
x
Sul diagramma PV la curva della trasformazione isoterma è
un’iperbole e su di essa giacciono i punti PV per i quali il sistema ha
la stessa temperatura
L=
∫
Vf
Vi
P dV
Vf
=
∫
Vi
ΔEint = Q − L = 0
Vf
nRT
dV = nRT ln
V
Vi
ΔE = 0
Q = L = nrT ln
Vf
Vi
Trasformazione
Isoterma
Durante un’espansione isoterma l’energia Q assorbita dal sistema viene
trasformata in Lavoro meccanico compiuto dal sistema
Durante una compressione isoterma il sistema subisce un lavoro
meccanico ed emette una quantità di energia Q pari a tale lavoro
Esempio
Esercizio:
Un cilindro metallico con un pistone mobile a tenuta, contiene 0.24 moli di gas N2 (Azoto) ad
una pressione iniziale di 140 kPa. Il pistone viene spostato lentamente nel cilindro fino a far
raddoppiare il volume occupato dal gas. Il cilindro rimane durante la trasformazione, in
contatto termico con l’ambiente a 310 K. Quanto calore viene ceduto al gas in questa
trasformazione?
T = 310 K = cost.
ΔE int = 0
⇒ Q-L = 0
Q = L
Pi = 140 kPa
Vf = 2Vi
Q = ?
Vf
Vf
2Vi
Q = L = ∫ pdV = nRT ln
= nRT ln
= nRT ln 2
Vi
Vi
Vi
(
)
= (0.24 mol ) 8.31 J ⋅ mol −1 ⋅ K −1 ⋅ (310 K ) ⋅ ln 2 = 428 J
Trasformazioni cicliche
Ø Le trasformazioni cicliche sono trasformazioni che iniziano e finiscono nello stesso
stato
Ø La variazione dell’energia interna deve essere nulla perché l’energia interna è
una variabile di stato e gli stati iniziali e finali coincidono
Ø L’energia trasferita mediante il calore deve essere quindi uguale al lavoro svolto
dal gas
ΔEint = Q − L = 0
ΔEint = 0
Q=L
Trasformazioni
cicliche
P
P
i
i
Lnet >0
f
P
f
Vi
Vf
V
Il lavoro compiuto dal gas per ciclo è pari all’area racchiusa dal cammino che
rappresenta la trasformazione nel diagramma PV
Le trasformazioni cicliche sono alla base della termodinamica che regola i motori
termici ( dispositivi termici per i quali una frazione dell’energia assorbita dal
sistema come calore viene convertita in lavoro meccanico)
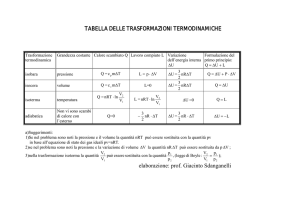
Tabella Riassuntiva
Trasformazione
Caratteristica
Vincolo
Conseguenza
Del primo principio
della
termodinamica
Adiabatica
Q=0
Q=0
ΔEint = -L
Espansione Libera
Q=L=0
Q=L=0
ΔEint = 0
Isocora
V = costante
L=0
ΔEint = Q
Ciclo Chiuso
ΔEint =0
ΔEint =0
Q=L
Isoterma
T = costante
ΔEint =0
Q = L = nrT ln(Vf/Vi)
Isobara
P = costante
ΔEint = Q - PΔV
Calori Specifici molari dei gas
Abbiamo visto che l’energia interna di un gas monoatomico è legato alla temperatura dalla
relazione:
Eint
3
= nRT
2
Da questa relazione è possibile ricavare due espressioni per il calore specifico molare del gas
(calore specifico molare =quantità di calore necessaria a far aumentare di 1 kelvin la
temperatura di una mole del gas)
Ø Calore specifico a volume costante cv ( la variazione di temperatura avviene durante una
trasformazione a volume costante)
Ø Calore specifico a pressione costante cp ( la variazione di temperatura avviene durante una
trasformazione a pressione costante)
NB:si hanno due espressioni diverse per il calore specifico di un gas poiché esso
dipende dalla trasformazione termodinamica durante la quale avviene lo scambio di
calore
Calore specifico molare a volume costante
Stato iniziale i: (n,P,T,V)
n moli di gas perfetto a pressione P racchiuso in un cilindro di volume fisso V in contatto
termico con una sorgente di calore a temperatura T
Supponiamo di fornire una piccola quantità di calore Q al gas aumentando la temperatura
della sorgente di calore: T→ T + ΔT
La pressione aumenta di una quantità ΔP : P → P + ΔP
Stato finale f: (n, P + ΔP , T + ΔT, V)
Il calore in questa trasformazione isocora sarà dato da:
Q = ncv ΔT
Ma in una trasformazione isocora la variazione di energia interna è pari proprio a Q in quanto
il lavoro meccanico è nullo:
ΔEint = Q = ncv ΔT
cv =
( )
1 ΔEint 1 3 2 nRΔT
cv =
=
n ΔT
n
ΔT
1 ΔEint
n ΔT
Calore specifico
molare a volume
costante
cv =
3
R
2
(
cv = 12,5J mol ⋅ K
)
R = costante universale dei gas = 8,314 J/(mole·K)
I valori sperimentali di cv per i gas monoatomici sono in buon accordo con il valore atteso
Energia interna di un gas
Poiché la variazione di energia interna è una funzione di stato che quindi dipende solo dallo
stato iniziale i e dallo stato finale f, essa sarà uguale per tutte le trasformazioni che passano
dallo stato i allo stato f.
Figura:
Per tutte le trasformazioni che portano da uno stato
iniziale a temperatura T ad uno stato finale a
temperatura T + ΔT la variazione di energia interna ΔEint
è la stessa
E possiamo quindi far riferimento alla trasformazione fo
isocora per determinare la variazione di energia interna
associata alla variazione di temperatura ΔT.
Per tale trasformazione sappiamo infatti che:
f0
ΔEint = ncv ΔT
La variazione di energia interna di un gas ideale non dipende dal tipo di
trasformazione che ha prodotto una variazione di temperatura del gas, ma solo dalla
variazione ΔT stessa.
ΔEint = ncv ΔT
Variazione di energia interna di un gas
ideale, per qualsiasi trasformazione
che porta una variazione ΔT della
temperatura
NB: Q ed L associati alla particolare trasformazione sono comunque differenti per i vari percorsi, così
come Pf e Vf
Calore specifico molare a pressione costante
Consideriamo ora che il nostro sistema abbia il pistone libero di muoversi e sia ancora in
contatto termico con la sorgente di calore a temperatura T regolabile.
In questo caso alla variazione ΔT di temperatura corrisponderà un’espansione ΔV del volume
del gas a pressione costante (la pressione è legata alla pressione atmosferica ed al peso del
pistone..)
Ø Stato iniziale i (Pi,Ti,Vi)
Ø Stato finale fʹ (Pi,T+ ΔT,V+ ΔV)
Il calore in questa trasformazione isobara sarà dato da:
Q = nc p ΔT
Il lavoro compiuto dal gas nell’espansione sarà: L = P ⋅ ΔV
L’eneregia interna:
ΔEint = Q − PΔV = nc p ΔT − PΔV
L’energia interna però sappiamo essere anche uguale a:
ΔEint = ncv ΔT
nc p ΔT − PΔV = ncV ΔT
Ricordando che PV = nRT → PΔV = nRΔT possiamo sostituire PΔV ed ottenere:
nc p ΔT − nRΔT = ncV ΔT
c p − cV = R
c p = R + cV
Relazione
di Mayer
Gradi di libertà e calore specifico molare
Abbiamo visto che per i gas monoatomici il calore specifico a volume costante è legato alla
costante universale dei gas R dalla relazione: c = 3 2 R
v
Il calore specifico a pressione costante per un gas monoatomico sarà quindi
cp = 5 2 R
c p = cv + R =
5
R
2
Per i gas biatomici e poliatomici dove entrano in gioco oltre che i gradi di libertà traslazionali
anche quelli rotazionali delle molecole (2 per i gas biatomici 3 per quelli poliatomici) vale il
teorema di equipartizione dell’energia ( ogni grado di libertà di una molecola contribuisce
all’energia interna della molecola in media con un valore ½ kBT di energia )
Se f è il numero di gradi di libertà allora:
Eint =
f
nRT
2
molecola
Es.
ncv ΔT =
Trasl.
f
f
nRΔT → cv = R
2
2
Rot.
totali
Eint
c p = cv + R → c p =
cv
f +2
R
2
cp = cv +R
Monoat.
He
3
0
3
3/2nRT
3/2R
5/2R
Biatom.
O2
3
2
5
5/2nRT
5/2R
7/2R
Poliatom.
CH4
3
3
6
3nRT
3R
4R
Espansione Adiabatica (continua)
Ø Abbiamo visto che l’espansione adiabatica è una trasformazione che avviene senza scambio di
calore con l’ambiente, cioè Q=0
Ø Avevamo lasciato in sospeso la formulazione dell’equazione di stato
Ø T,p e V variano durante la trasformazione; si possono comunque trovare delle relazioni che
legano le variabili due a due (noi troveremo la relazione che lega p e V).
Consideriamo il recipiente isolato contente il gas ed il pistone tenuto fermo dai pallini di
piombo, che man mano andremo a levare.
Per ogni pallino levato il volume del gas aumenta di una infinitesimo dV.
Per una variazione così piccola di volume la pressione p può essere considerata costante, quindi
il lavoro infinitesimo dL sarà dato da: dL = pdV
Per la prima legge della termodinamica si ha (ricordando che Q=0):
Ma sappiamo anche che: dEint = cV ndT
cV ndT = − pdV
Differenziando la legge dei gas perfetti :
ndT = −
pV = nRT
R = c p − cV
d pV = Vdp + pdV ⎫⎪
⎬ Vdp + pdV = nRdT
d nRT = nRdT
⎪⎭
( )
( )
pdV + Vdp
(c
p
− cV
)
pdV
+
=0
cV
ndT =
(
)
cV Vdp + cV pdV + c p − cV pdV
(
dE int = −. pdV
cV c p − cV
)
pdV
cV
Vdp + pdV
(cp − cV )
=0
⎫
⎪ pdV Vdp + pdV
=
⎬−
cV
c p − cV
⎪
⎭
(
cV Vdp + c p pdV = 0
)
Espansione Adiabatica (2)
dL = pdV
Q=0
dEint = cV ndT
dE int = − pdV
R = c p − cV
pV = nRT
cV Vdp + c p pdV = 0
Dividendo questa espressione per cVpV si ottiene:
γ =
cp
cv
>1
dp
dV
+γ
=0
p
V
ln pV = cost
∫
dp
dV
+γ∫
= cost
p
V
γ
γ
piVi = p f V f
γ
γ =
cp
cv
>1
Una trasformazione adiabatica sul diagramma P-V si posizionerà
lungo una linea sulla quale p∝1/Vγ
Quindi:
Trasformazione isoterma
ln a + α ln b = ln abα
ln p + γ ln V = cost
Eq. Di stato di una
trasformazione
adiabatica
pV = cost
γ
dp c p dV
+
=0
p cV V
=>
PV=cost => P∝1/V => iperbole
Trasformazione adiabatica =>
PVγ =cost dove γ>1 => P∝1/Vγ
La curva adiabatica è più ripida di quella isoterma
p∝
1
Vγ