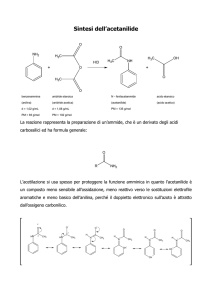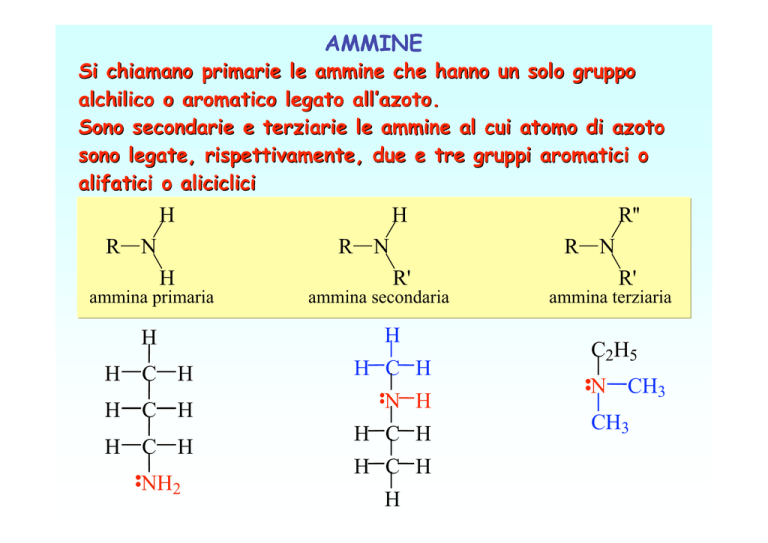
AMMINE
Si chiamano primarie le ammine che hanno un solo gruppo
alchilico o aromatico legato all’azoto.
Sono secondarie e terziarie le ammine al cui atomo di azoto
sono legate, rispettivamente, due e tre gruppi aromatici o
alifatici o aliciclici
H
R N
H
R''
R N
H
R N
R'
ammina primaria
ammina secondaria
H
H
H C
N
H C
H C
H
H C H
H C H
H C H
NH2
H
H
H
H
R'
ammina terziaria
C2H5
N CH3
CH3
H
H C H
NH2
metanammina
amminometano
metilammina
H
Ammine alifatiche
H
H
H
H C H
H C H
H C H
H C H
H C H
NH2
etanammina
amminoetano
etilammina
H C H
H C H
1-propanammina
1-amminopropano
1-propilammina
H
2-propanammina
2-amminopropano
2-propilammina
H
H C H
C2H5
H C H
N CH3
N-metil-etanammina
N-metil-amminoetano
metil etil ammina
H C H
NH2
N H
H
H C NH2
CH3
N,N-dimetil-etanammina
N,N-dimetil-amminoetano
dimetil etil ammina
H
H
H
H
H
H
H
N
H H
H
H
N-metil-cicloesanammina
N-metil-amminocicloesano
dimetil cicloesil ammina
CH3
NH2
Ammine aromatiche
CH3
benzenammina
amminobenzene
fenilammina
anilina
N H
CH3
H3C
N-metilbenzenammina
N-metil-amminobenzene
metilfenilammina
N-metil-anilina
C
CH3
N CH3
N-metil-N-2(2-metilpropil)benzenammina
N-metil-N-tert-butil-amminobenzene
metil-tert-butil-fenilammina
N-metil-N-isopropil-anilina
CH3
NH2
CH3
CH2
H2N C H
CH2
CH2
NH
CH2
CH2
CHOH
CHOH
HO
HO
2-feniletanammina
1-fenil-2-propanammina
(anfetammina)
NH2
H C H
H C H
OH
NH2
2-amminoetanolo
(etanolammina)
NH2
H C H
H C H
H C H
H C H
NH2
OH
OH
nor-adrenalina
adrenalina
H
NH2
H C H
H C H
N
H
H
H C H
H C H
H C H
NH2
1,4-butandiammina
1,5-pentandiammina
(putrescina)
(cadaverina)
H
H
H H
H
pirrolidina
H
Come nell’ammoniaca, gli orbitali di valenza dell’azoto
delle ammine sono ibridati sp3.
Tre degli orbitali ibridati sono impegnati in legami con
gruppi alchilici o aromatici mentre il quarto è un
orbitale atomico.
H3C
N
H
CH3
Nelle ammine gli orbitali dell’azoto sono ibridati sp3.
Il lone pair in uno dei quattro orbitali conferisce
carattere basico alle ammine.
I gruppi alchilici legati all’azoto, per effetto induttivo
positivo, aumentano la densità di carica nell’orbitale
atomico.
H3C
N
H
CH3
NH2
H N
H
C2H5
C2H5
C2H5
H5C2
N
H5C2
H
N
C2H5
Carattere nucleofilo dell’azoto amminico
La nucleofilia dell’azoto del gruppo funzionale delle ammine è
influenzata dalla natura dei gruppi alchilici o aromatici legati
all’azoto. Nelle ammine alifatiche, aumentando il numero dei gruppi
alchilici aumenta la densità elettronica nell’orbitale atomico
dell’azoto e quindi il carattere nucleofilo.
La presenza di un radicale aromatico, a causa della
delocalizzazione dei due elettroni dell’azoto nell’orbitale p
dell’anello, rende le ammine meno nucleofile.
Nonostante che il carattere nucleofilo delle ammine
terziarie alifatiche sia maggiore di quello delle
ammine alifatiche secondarie e primarie, le ammine
terziarie hanno valori di Kb più bassi (sono meno
basiche), a causa dell’ingombro dei tre gruppi
alchilici.
La spontaneità del processo di protonazione
dell’ammina da parte dell’acqua è infatti
tanto maggiore quanto maggiore è la stabilità
della forma protonata. La stabilità di questa forma
è maggiore per le ammine che, avendo minore
ingombro sterico, possono essere maggiormente
solvatate.
Kb = 6 • 10-4
N
CH3
H
CH 3
Kb = 5 • 10-4
Kb = 6.6 • 10-5
N
N
H
H+
H
H
CH3
H 3C
C H3
H+
H+
H
H
H
N
N
N
CH3
CH3
H
H
CH3
H3 C
CH3
CH 3
CH3
Le ammine aromatiche hanno carattere nucleofilo
(e anche carattere basico) minore di quello delle
ammine alifatiche e alicicliche.
La presenza del radicale aromatico comporta infatti
la delocalizzazione dei due elettroni dell’azoto
nell’orbitale p dell’anello.
I valore di Kb dell’amminobenzene è circa un
milione di volte più piccolo di quello
dell’amminocicloesano.
N
H
Kb = 4,2 • 10-10
H
benzenammina
N
H
Kb = 5,5 • 10-4
H
cicloesanammina
O
H
N R'
R C
H
H
H2O
O H
R C
N
H H
R'
R C
N R'
H
aldimmina
(base di Schiff)
Le ammine primarie agiscono da nucleofili nei confronti dei
composti carbonilici.
L’allontanamento di una molecola di acqua dall’intermedio
della reazione porta alla formazione di una base di
Schiff. Le ammine secondarie e terziarie non possono dare questa
reazione.
O
H
O
R C
N R'
R C
X
H
H+
X-
N
H
H
O
R C
R'
N H
R'
Le ammine agiscono da nucleofili nei confronti dei derivati
degli acidi carbossilici (esteri, alogenuri acilici, anidridi).
La reazione è una sostituzione nucleofila di 2° ordine.
Se si è partiti da un alogenuro acilico e da un’ammina
primaria, per allontanamento dello ione alogenuro
dall’intermedio si forma un’ammide protonata che, per
successivo allontanamento di in protone, dà luogo alla
formazione di un’ammide monoalchilsostituita.
Il gruppo carbonilico
Nel doppio legame tra C ed O troviamo
un legame sigma (σ) ed uno pigreco (π)
Carbonio ed Ossigeno hanno ibridizzazione sp2
ed il gruppo carbonilico è planare con angoli di 120°
R’
120°
R
120°
O
C
120°
R e R’ possono essere due differenti gruppi
e danno origine a vari gruppi funzionali
contenenti il gruppo carbonilico
Composti contenenti il carbonile
formula
famiglia
formula
O
R
R
O
Aldeide
C
R
Estere
C
H
O
O
O
C
Chetone
R
C
R’
O
R
famiglia
C
OH
R’
Ammide
NH2
Acido
Carbossilico
O
R
C
Cl
Cloruro
Acilico
ACIDI CARBOSSILICI
Struttura di Lewis
:
gruppo carbonilico
=
O:
R - COOH
R—C
:
:O — H
gruppo ossidrilico
suffisso: -oico
R – CO2H
H-COOH
CH3-COOH
C6H5-COOH
Acido metanoico
Acido etanoico
Acido benzoico
Acido formico
Acido acetico
I gruppi carbossilici sono presenti (e caratterizzano le
proprietà chimiche) di molte ed importanti bio-molecole
Es.: acido palmitico (acido grasso)
Es.: alanina (amminoacido)
Le proprietà chimiche del gruppo carbossilico possono
essere dedotte dal profilo del potenziale elettrostatico
accumulo di carica negativa
O relativamente basico
accumulo di carica positiva
H relativamente acido
R C
H+
OH
R C
OH-
O
R C
OH
Comportamento acido-base
del gruppo carbossilico
O-
-
R C
OH
STRUTTURE IN RISONANZA
DELLO IONE CARBOSSILATO
(aumentano le proprietà acide)
O
+
R C
OH
O
O
+
OH
Le caratteristiche del gruppo R influenzano il comportamento
acido-base del gruppo carbossilico
H
H C C
H
Cl
O
Cl
OH
acido etanoico
(pKa = 4,74)
C C
Cl
F
O
F
OH
acido tricloroetanoico
(pKa = 0,64)
O
C C
F
OH
acido trifluoroetanoico
(pKa = 0,23)
L’elevata elettronegatività del fluoro comporta polarizzazione degli orbitali molecolari
del gruppo carbossilico e delocalizzazione della carica nell’anione carbossilato.
Tali effetti sono minori nell’acido tricloroacetico e non si hanno nell’acido acetico.
L’acido trifluoroacetico è quindi l’acido più forte e l’acido acetico è il più debole.
Le proprietà chimiche del gruppo carbossilico possono
essere dedotte dal profilo del potenziale elettrostatico
accumulo di carica negativa
O relativamente basico
Carbonio non
particolarmente elettrofilo
accumulo di carica positiva
H relativamente acido
Principali reazioni di sostituzione nucleofila acilica del gruppo carbossilico
Cloruri acilici
Anidridi acide
Esteri
Ammidi
Per reazione di un acido carbossilico con un
alcol si ottiene un
ESTERE
O
H3C C
OH
O
H O
CH3
H3C C
OCH3
H2O
I composti ciclici che si formano per esterificazione
interna dei γ− e dei δ−ossiacidi si chiamano lattoni
γ
δ
OH
H2O
O
C
α
β
O
OH
δ−idrossiacido
O
δ−lattone
H
O
OH
γ
C
β
O
O
O
α
γ−idrossiacido
γ−lattone
H2O
Reazione di esterificazione
O
H3C
C
OH
acido carbossilico
H+
O H
H3C
catalizzatore:
acido minerale
(H2SO4)
H
C
O H
O H
H3C
OH
H3C
C
OH
C
OH
H
OH
H
OH
O
H
Nella prima tappa del processo
, l’Cacido
viene protonato.
H
C
O
O
3
H3C C O CH3
H3C C
L’acido protonato
è
stabilizzato
per
risonanza
CH3
OH
OH CH3
OH
alcol
H
OH
H2O
H+
L
acido
attaccato
dall’alcole (nucleofilo
). 3
H 3C entrante
C O CH
H3’C
C protonato
O CH3 viene H
3C C O CH3
La trasposizione
di un protone
O
O “Hprepara” il nucleofilo uscente
OH
Nell’ultima tappa si elimina una molecola di acqua
(nucleofilo uscente) ed il protone catalitico, con
formazione dell’estere. Il meccanismo della
reazione è SN2
O CH3
H3C
C
O
estere
O
O
R C
OH
HS
Per reazione di un acido
carbossilico con un tiolo
si forma un tioestere.
La reazione decorre con lo
stesso meccanismo della
reazione di esterificazione
di un acido carbossilico con
un alcole.
H2O
R C
CH3
S
H N CH2
CH2
S
CH3
C
O
CH3
O C
CH2 CH2
H N C O
H C OH
H3C
C CH3
Un tioestere di
grande importanza
in biochimica è
l’acetilcoenzima A
NH2
CH2
O
O
P
O
N
O
O
P
N
O
O
O
CH2
H
OPO3H2
N
HH
OH
N
Reazione di condensazione con ammine: AMMIDE
acetammide
O
H3C C
O
H3C C
N H
N H
H
H
O
H3C C
risonanza
tautomeria
O H
H3C C
N H
N
H
H
Il nome delle aldeidi si costruisce facendo seguire la
desinenza -ale al nome dell’idrocarburo saturo ad ugual
numero di atomi di carbonio.
O
H
O
H C
H3C C
H
metanale
aldeide formica
H H
H3C C C C
H H
O
H3C C C
H
H
H
etanale
propanale
aldeide acetica
aldeide propionica
H CH3
O
H C C C
H
O
H H
H
butanale
metilpropanale
aldeide butirrica
aldeide metilpropionica
La vecchia nomenclatura (ancora in uso) è riportata in corsivo sotto
la nomenclatura IUPAC.
Per i chetoni il nome si costruisce facendo seguire la
desinenza -one al nome dell’idrocarburo saturo ad ugual
numero di atomi di carbonio.
O
H3C C
CH3
propanone
O
H3C C
CH2CH3
butanone
O
H3C C
CH2CH2CH3
2-pentanone
Aldeide: contiene un carbonio carbonilico C=O
π
R
σ
H
xy
R
H
C
O
Chetone: contiene un carbonio carbonilico C=O
π
R2
σ
R1
xy
R2
R1
C
O
δδ+
O
R C
O
R C
R
R
Risonanza fra due forme limite
Tautomeria cheto-enolica
Aldeidi e chetoni possono esistere all’equilibrio nelle due forme chetonica ed enolica,
che differiscono per la posizione di un protone e per un doppio legame.
Questa isomeria si chiama tautomeria, le forme vengono dette tautomeri e sono due
particolari isomeri di struttura che si pongono in equilibrio tra loro.
Un composto carbonilico, per poter esistere in forma enolica, deve avere un atomo
di idrogeno legato all’atomo di carbonio adiacente al carbonile (carbonio α).
O
H
H
C
C
H
C
H
H
H
OH
H
H
C
C
H
C
H
H
Tautomeria cheto-enolica
OH
O
H
C
C
H
H
H
H
C
C
H
Movimento concertato di elettroni e protoni intramolecolare
H
Reattività del gruppo carbonilico:
addizione nucleofila
Più reattiva un aldeide o un chetone?
Nu:
Nu:
Le aldeidi sono più reattive perché nei chetoni i sostituenti alchilici sono
gruppi donatori che diminuiscono la parziale carica positiva
sul carbonio carbonilico.
La minore reattività dei chetoni deriva anche da un maggior ingombro sterico.
H
H
R
2 R'OH
C
H+
R
O
R
2 R'OH
C
O
OR'
OR'
R
R
C
H+
R
C
OR'
OR'
La reazione dei composti carbonilici con gli alcoli, nel
rapporto stechiometrico di 1:2, porta alla formazione degli
acetali. Il meccanismo della reazione è il seguente :
H
H
+
H
H
R C
R C
O
OH
O R
H H
R C O R
OH
H+
H
R C OR
OH
emiacetale
L’addizione nucleofila di una molecola di alcole ad un’aldeide
o ad un chetone porta alla formazione di un emiacetale.
H
R C OR
H+
H
H
R C OR
R C OR
OH
OH
emiacetale
H2O
ROH
H
H
R C OR
OR
H+
H
R C OR
R
O
H
acetale
Dalla reazione dell’emiacetale con una seconda molecola di
alcole si ottiene un acetale, con meccanismo di sostituzione
nucleofila.
L’equilibrio della reazione di formazione dell’emiacetale è quasi
completamente spostato a sinistra.
O
R C
H
OH
R'OH
R C OR'
H
In assenza di un catalizzatore acido non si può verificare la reazione
dell’emiacetale con la seconda molecola di alcole, che è una sostituzione
nucleofila e quindi non si forma l’acetale.
Le g- e le d-ossialdeidi possono invece
formare emiacetali ciclici stabili
H
H
O
C
O
H
Come si osserverà nei saccaridi.
O
O
C
H
O
C
H
OH