Cod. 06-2008-MXT-2007-IT-1266-B
INTERAZIONI
FARMACOLOGICHE
NEL TRATTAMENTO
DELL’EMICRANIA
a cura di
Depositato all’AIFA in data 11/07/07
F. Franconi
G.B. Allais
PACINIeditore
MEDICINA
INTERAZIONI
FARMACOLOGICHE
NEL TRATTAMENTO
DELL’EMICRANIA
a cura di
F. Franconi
G.B. Allais
PACINIeditore
MEDICINA
MSD Italia S.r.rl.
Via Vitorchiano 151
00189 Roma
[email protected]
Esemplare fuori commercio. Omaggio ai Sigg. Medici.
© Copyright 2007 by Pacini Editore S.p.A. – Pisa
Realizzazione editoriale
Pacini Editore S.p.A.
Via Gherardesca 1
56121 Ospedaletto (Pisa)
Tel. 050 313011 - Fax 050 3130300
[email protected]
www.pacinimedicina.it
Grafica e stampa
Industrie Grafiche Pacini – Pisa
Servizio scientifico offerto alla Classe Medica da MSD Italia S.r.l.
Questa pubblicazione riflette i punti di vista e le esperienze degli autori e non necessariamente quelli della MSD Italia S.r.l.
Ogni farmaco menzionato deve essere usato in accordo con il relativo riassunto delle caratteristiche del prodotto fornito
dalla ditta produttrice.
Fotocopie per uso personale del lettore possono essere effettuate nei limiti del 15% del volume dietro pagamento alla SIAE del
compenso previsto dall’art. 68, comma 4, della legge 22 aprile 1941 n. 633 ovvero dall’accordo stipulato tra SIAE, AIE, SNS e CNA,
CONFARTIGIANATO, CASA, CLAAI, CONFCOMMERCIO, CONFESERCENTI il 18 dicembre 2000.
Le riproduzioni per uso differente da quello personale sopracitato potranno avvenire solo a seguito di specifica autorizzazione rilasciata dall’Editore.
INDICE
Introduzione.................................................................................................................................. »
1
Capitolo 1
Emicrania
G.B. Allais, I. Castagnoli Gabellari, C. Benedetto ............................................................................. »
3
»
15
»
33
»
45
»
55
Capitolo 2
Neurone serotoninergico:
serotonina ed emicrania
F. Franconi, I. Campesi................................................................................................................................... Capitolo 3
Terapia dell’emicrania
G.B. Allais, I. Castagnoli Gabellari, C. Benedetto............................................................................... Capitolo 4
Interazioni tra i triptani ed altri farmaci,
cibi, rimedi botanici
F. Franconi, S. Canu ....................................................................................................................................... Capitolo 5
Interazioni dei triptani: il parere del clinico
G.B. Allais, I. Castagnoli Gabellari, C. Benedetto............................................................................... INTRODUZIONE
Gli Autori hanno voluto scrivere una breve nota sull’uso dei triptani nel trattamento dell’emicrania, con particolare riguardo alle problematiche delle interazioni farmacologiche e alle differenze di genere. Ovviamente è sembrato opportuno iniziare con una carrellata che coprisse
la problematica dell’inquadramento dell’emicrania in senso clinico e che inquadrasse i triptani
nel neurone serotoninergico, allo scopo di arrivare ad indirizzare sulle interazioni possibili dal
punto di vista farmacodinamico. Come è anche evidente dal titolo del quarto capitolo, non
sono state analizzate solo le interazioni fra farmaci etici, ma anche quelle che coinvolgono
supplementi alimentari, rimedi botanici e cibi, affrontando sia quelle farmacodinamiche che
farmacocinetiche. Si è ritenuto opportuno trattare anche queste ultime interazioni perché
sono abbastanza sconosciute e per segnalare l’importanza di rivolgere domande precise e
puntuali al paziente, per conoscere eventuali medicazioni di autoprescrizione e per fare prevenzione di eventuali effetti collaterali attraverso l’educazione del paziente.
1
Capitolo 1
EMICRANIA
G.B. Allais, I. Castagnoli Gabellari, C. Benedetto
Introduzione
L’emicrania è una delle forme di cefalea primaria più comuni. Può essere considerata come
una patologia multifattoriale a possibile eziologia poligenica, a cui si associa l’influenza di
fattori ambientali. Dall’interazione di queste due componenti scaturisce la notevole variabilità nell’espressione clinica di tale patologia.
Il tentativo di darne una definizione precisa risale già alla fine del I secolo d.C., quando sotto
la denominazione di heterocrania venne per la prima volta caratterizzata una particolare
forma di cefalea, distinguibile per la sua natura parossistica, la marcata severità, la distribuzione unilaterale, l’associazione con nausea, vomito e fotofobia e la presenza di intervalli
liberi tra le crisi 1.
Nei secoli, le segnalazioni sempre più frequenti di sottotipi e varianti dell’emicrania, resero
evidente la necessità di una classificazione più dettagliata all’interno del vasto mondo delle
cefalee.
Inizialmente l’ambito di indagine si orientò verso la ricerca dei possibili meccanismi patogenetici, da cui derivò la stesura nel 1962 di una delle classificazioni maggiormente utilizzate al
mondo, almeno fino agli ultimi anni Ottanta: quella dell’Ad Hoc Committee on Classification
of Headache 2. Questa classificazione ebbe il grande merito di imporre un primo linguaggio
comune a tutti coloro che si occupavano di cefalee.
In tempi più recenti, dalla consapevolezza che i meccanismi patogenetici delle diverse forme di cefalea, nonostante i molti studi ed i significativi progressi compiuti negli ultimi anni,
restano in gran parte ancora da chiarire, si è ritenuto più opportuno adottare delle classificazioni basate piuttosto sugli aspetti clinici peculiari di ogni singola forma. Nel 1988 venne
creata la prima classificazione delle cefalee della International Headache Society (IHS) 3, aggiornata in seguito nel 2004 4. Si tratta di una classificazione su base gerarchica, in cui tutti i
disordini cefalalgici vengono distribuiti in gruppi principali (primo livello diagnostico) sulla
base dell’individuazione di precisi elementi clinici distintivi irrinunciabili. La progressione
dell’iter diagnostico prevede l’ulteriore suddivisione in vari sottotipi di cefalea, a seconda del
riconoscimento di criteri clinico-diagnostici aggiuntivi.
Va da sé che la possibilità di effettuare una diagnosi corretta, anche a livelli di codificazione
superiori al primo, è vincolata ad una scrupolosa raccolta dei dati anamnestici.
3
interazioni farmacologiche nel trattamento dell’emicrania
Epidemiologia
L’emicrania colpisce circa il 12% degli adulti nei Paesi industrializzati. Per quel che riguarda la
prevalenza 1-year, cioè la presenza di emicrania nel corso dell’anno precedente l’indagine, i
tassi riportati in numerosi studi epidemiologici variano notevolmente, attestandosi in media
al 6% per i maschi e al 18% per le femmine 5. Questa differenza nei due sessi si rende manifesta
a partire dalla pubertà; fino ad allora infatti la prevalenza si attesta attorno al 3-5%, senza differenze significative tra maschi e femmine. Successivamente si assiste ad un incremento della
prevalenza molto più marcato nelle donne che negli uomini, con un picco massimo tra i 30 e
i 39 anni, fascia di età in cui si manifesta anche la maggior discrepanza tra femmine e maschi,
con tassi di prevalenza che arrivano a toccare un rapporto di 3,5:1 tra i due sessi. A partire dai
40 anni si assiste ad un progressivo decremento della prevalenza dell’emicrania in entrambi i
sessi, per assestarsi attorno a valori decisamente inferiori (1-4%) nella terza età 5 (Fig. 1).
24,4%
Maschi
Femmine
22,2%
17,3%
16,0%
6,4%
4,0%
12-17
5,0%
18-29
7,4%
5,0%
6,5%
5,0%
30-39
Età
40-49
50-59
1,6%
60+
Figura 1
Prevalenza dell’emicrania nei due sessi durante le varie età della vita.
Quadri clinici
L’emicrania può presentare diversi sottotipi, anche se quelli che costituiscono il più frequente
motivo di consultazione del medico sono l’emicrania senz’aura e l’emicrania con aura.
I vari quadri clinici dell’emicrania, secondo quanto stabilito dalla recente classificazione IHS 4,
sono tutti riportati in Tabella I.
4
emicrania
Tabella I
Classificazione dell’emicrania (ICHD-II, 2004)
1.1 Emicrania senza aura
1.2 Emicrania con aura
1.2.1 Aura tipica con cefalea emicranica
1.2.2 Aura tipica con cefalea non emicranica
1.2.3 Aura tipica senza cefalea
1.2.4 Emicrania emiplegica familiare
1.2.5 Emicrania emiplegica sporadica
1.2.6 Emicrania di tipo basilare
1.3 Sindromi periodiche dell’infanzia che sono precursori comuni dell’emicrania
1.3.1 Vomito ciclico
1.3.2 Emicrania addominale
1.3.3 Vertigine parossistica benigna dell’infanzia
1.4 Emicrania retinica
1.5 Complicanze dell’emicrania
1.5.1 Emicrania cronica
1.5.2 Stato emicranico
1.5.3 Aura persistente senza infarto
1.5.4 Infarto emicranico
1.5.5 Epilessia indotta dall’emicrania
1.6 Emicrania probabile
1.6.1 Emicrania senza aura probabile
1.6.2 Emicrania con aura probabile
1.6.3 Emicrania cronica probabile
Emicrania senza aura
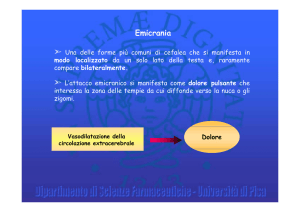
Rappresenta la forma più frequente di emicrania (circa l’85% dei casi). È caratterizzata da una
grande variabilità nelle manifestazioni cliniche, tanto che solo la determinazione da parte
della IHS di precisi criteri diagnostici (vedi Tabella II) ha permesso di definire con maggior
precisione questa patologia. Secondo l’attuale classificazione IHS, si tratta di un “disordine
cefalalgico ricorrente, che si manifesta con attacchi che durano dalle 4 alle 72 ore”. Caratteristiche tipiche di questa cefalea sono la localizzazione unilaterale, l’intensità moderata o
severa, l’aggravamento in seguito ad attività fisiche di routine e l’associazione con nausea,
vomito, fono-fotofobia.
5
interazioni farmacologiche nel trattamento dell’emicrania
Tabella II
Criteri diagnostici dell’emicrania senz’aura
A. Almeno 5 attacchi che soddisfino i criteri B-D
B. Attacchi di cefalea della durata di 4-72 ore (non trattati o trattati senza successo)
C. La cefalea presenta almeno due delle seguenti caratteristiche:
1. sede unilaterale
2. qualità pulsante
3. intensità media o forte
4. aggravata da o che limiti l’attività fisica di routine (es. camminare o salire le scale)
D. Alla cefalea si associa almeno uno dei seguenti:
1. nausea e/o vomito
2. fotofobia e fonofobia
E. Non attribuita ad altra condizione o patologia
Familiarità
Studi condotti su gemelli monozigoti e dizigoti hanno permesso di affermare che l’emicrania
possiede una sicura componente ereditaria, a cui si associa un’influenza ambientale che può
variamente prevalere sulla componente genetica. I familiari di primo grado di pazienti emicranici presentano un rischio relativo di emicrania variabile da 1,4 per l’emicrania senz’aura a
circa 4 per l’emicrania con aura 6.
Sesso
L’emicrania è indubbiamente una patologia più frequente nella popolazione femminile, con
una prevalenza nettamente maggiore nel sesso femminile nella piena età fertile 5; tale differenza di genere, tuttavia, si manifesta solo a partire dalla pubertà, evidenziando il ruolo fondamentale che gioca nella patogenesi dell’emicrania la presenza degli ormoni sessuali femminili
e la loro variazione ciclica nei vari momenti della vita riproduttiva della donna 7.
Età di insorgenza
Benché il 30% dei casi di emicrania insorga già prima dei 10 anni di vita, l’età di esordio più frequente si colloca in realtà nella seconda/terza decade. Raramente l’emicrania esordisce oltre i
50 anni. I casi di insorgenza in età avanzata, dunque, vanno sempre indagati con attenzione al
fine di escludere la presenza di secondarismi.
Fattori scatenanti
Con il termine di fattori scatenanti si intendono tutti quei fattori che sono in grado di favorire, da soli o in combinazione, un attacco emicranico. I più frequenti, ma anche aspecifici,
6
emicrania
sono rappresentati dallo stress/tensione, dalle variazioni nell’orario dei pasti, dall’affaticamento e dalla mancanza di sonno. Anche l’ingestione di particolari alimenti, quali il cioccolato, i formaggi stagionati, gli agrumi, i crostacei e gli alcolici, è stata spesso riferita dai
pazienti come responsabile dello scatenamento della crisi. Tra i fattori ambientali sono da
annoverare il caldo o il freddo intensi, il vento, la quota atmosferica, i cambiamenti di stagione, la luce e gli odori forti. Infine va ribadito il ruolo scatenante che possono avere alcune
variazioni ormonali, quali quelle che intercorrono in particolare durante la mestruazione;
non a caso la maggioranza delle donne emicraniche nota la presenza di almeno un attacco
nel periodo perimestruale. Per un elenco più dettagliato dei possibili fattori di rischio per
l’insorgenza di un attacco si veda la Tabella III.
La crisi emicranica
L’andamento temporale di un attacco emicranico può essere suddiviso in 5 fasi 8:
✘ fase prodromica;
✘ fase dell’aura (può essere del tutto assente);
✘ fase algica;
✘ fase di risoluzione;
✘ fase postdromica.
Fase prodromica
A seconda degli studi, una percentuale variabile tra il 12% e il 79% dei pazienti emicranici
riferisce di avvertire dei prodromi dell’attacco acuto 9. In genere si tratta di sintomi premonitori vaghi e indefiniti, che il paziente può imparare a riconoscere e che possono precedere di
qualche ora fino ad alcuni giorni l’attacco emicranico.
Sulla base delle loro caratteristiche possono essere distinti in sintomi di tipo:
✘ eccitatorio (irritabilità, iperattività fisica, euforia, sbadigli, craving per i carboidrati, aumento
della diuresi, diarrea);
✘ inibitorio (debolezza, rallentamento psico-fisico, difficoltà nell’espressione verbale, umore
depresso, difficoltà di concentrazione, anoressia, costipazione, ritenzione di liquidi).
Fase dell’aura
Verrà descritta più avanti, a proposito dell’emicrania con aura.
Fase algica
L’attacco di emicrania può insorgere in qualsiasi momento del giorno e della notte, anche
se spesso si manifesta fin dalle prime ore del mattino. Il suo esordio può essere repentino o
graduale, con un dolore inizialmente sordo e mal localizzabile.
La frequenza degli attacchi di emicrania senz’aura è di gran lunga superiore a quella dell’emicrania con aura e può variare in media da 1-2 al mese, fino a 2-3 alla settimana; una quota
purtroppo piuttosto ampia della popolazione emicranica può però soffrire di attacchi anche
molto più frequenti, fino a giungere alla quotidianità, in presenza di abuso di sintomatici.
7
interazioni farmacologiche nel trattamento dell’emicrania
Tabella III
Possibili fattori scatenanti l’attacco emicranico
Fattori psicologici
✘✘
✘✘
✘✘
✘✘
Emozioni
Stress
Rilassamento dopo un periodo stressante
Modificazioni del tono dell’umore
Fattori ambientali
✘✘
✘✘
✘✘
✘✘
✘✘
✘✘
Fattori climatici (vento, caldo o freddo eccessivi, pioggia, cambiamento di stagione)
Altitudine
Esposizione al sole e alla luce intensa
Rumori
Odori forti (profumi, detergenti)
Fumo di sigaretta
Fattori alimentari
✘✘
✘✘
Alcol
Cibi e bevande contenenti:
– Nitrati: insaccati o carne pretrattata, peperoni
– Glutammato: carni e zuppe in scatola, dadi da brodo, cibi cinesi
– Tiramina: formaggi stagionati, fegato, fichi, banane
– Feniletilamina: cioccolata
Fattori ormonali
✘✘ Ciclo mestruale
✘✘ Contraccettivi orali
Fattori farmacologici
✘✘
✘✘
✘✘
✘✘
Nitroderivati
Sildenafil
Reserpina
Estrogeni
Altri fattori
✘✘
✘✘
✘✘
✘✘
✘✘
8
Insonnia/eccesso di sonno
Ipoglicemia
Fatica fisica
Febbre
Lunghi viaggi
emicrania
Come già precedentemente accennato, la durata degli attacchi non trattati varia tra un minimo di 4 e un massimo di 72 ore, anche se nei 2/3 dei pazienti le crisi durano al massimo 24 ore.
Nei soggetti di età inferiore ai 15 anni i criteri IHS prevedono una durata da 2 a 48 ore.
La localizzazione del dolore è frequentemente, ma non necessariamente, unilaterale (come
invece l’etimologia del termine emicrania farebbe pensare) e in ogni caso il lato può variare da
una crisi all’altra. Generalmente il dolore inizia a livello della regione oculare e fronto-temporale per poi diffondere al resto del capo.
Il dolore emicranico, nella forma più tipica, è di tipo pulsante o martellante. Altra terminologia
utilizzata dai pazienti per descrivere il proprio dolore può essere trafittivo, ma anche gravativo,
costrittivo o urente sono termini possibili.
L’intensità moderata o severa e l’aggravamento con l’attività fisica o coi movimenti del capo
sono forse le più specifiche e sensibili caratteristiche del dolore emicranico. Molto spesso,
infatti, durante la crisi il paziente necessita di mettersi coricato immobile, al buio e lontano dai
rumori, tanto da non poter più attendere alle proprie consuete attività, o da subirne quantomeno una grossa limitazione.
Sintomi di accompagnamento tipici sono: la fotofobia (80% dei casi), la fonofobia (76%), la nausea (73%); meno frequente, ma più disabilitante, il vomito (36%) 10. Recentemente si è notato che
anche l’osmofobia può essere considerata come uno dei disturbi maggiormente caratterizzanti
l’emicrania. Altri sintomi spesso presenti durante una crisi emicranica sono le palpitazioni, il
pallore o l’arrossamento cutaneo, il senso di mancamento, i brividi o l’alternanza di sensazioni di
caldo e di freddo, l’anoressia o un senso di fame, la diarrea, la contrazione della diuresi seguita da
poliuria alla risoluzione dell’attacco, l’irritabilità o la depressione. Più raramente possono essere
presenti iperemia congiuntivale, rinorrea e ostruzione nasale ed edema al viso 11.
Remissione
Le fasi di risoluzione e quella postdromica possono essere raccolte in un’unica descrizione. La
remissione di un attacco ha una durata variabile e talvolta può essere caratterizzata da sonno
profondo o da un episodio conclusivo di vomito. In circa il 90% dei pazienti, una volta cessata
la cefalea, possono persistere sintomi residui tra cui una sensazione di spossatezza, letargia,
astenia, inappetenza o anche alterazioni dell’umore.
Emicrania con aura
Rispetto all’emicrania senz’aura l’emicrania con aura presenta una frequenza decisamente inferiore, nonché caratteristiche cliniche molto più costanti sia inter- che intra-individualmente,
almeno per ciò che attiene alle caratteristiche cliniche dell’aura. Per i criteri diagnostici definiti
dall’IHS si veda la Tabella IV.
Familiarità
Circa il 27% degli individui affetti da emicrania con aura presenta familiarità per tale patologia 12.
9
interazioni farmacologiche nel trattamento dell’emicrania
Tabella IV
Criteri diagnostici dell’emicrania con aura
A. Almeno 2 attacchi che soddisfino i criteri B-C
B. Aura caratterizzata da almeno uno dei seguenti sintomi, ma senza alcun deficit motorio:
1. sintomi visivi completamente reversibili, positivi (es. luci tremolanti, macchie, linee) e/o negativi;
2. sintomi sensitivi completamente reversibili, positivi (es. puntura di spillo o ago) e/o negativi (es.
ipoestesia);
3. disturbi del linguaggio.
C. Presenza di almeno 2 delle seguenti caratteristiche:
1. disturbi visivi omonimi e/o sensitivi unilaterali;
2. almeno un sintomo dell’aura si sviluppa gradualmente in ≥ 5 minuti e/o diversi sintomi si
susseguono in ≥ 5 minuti;
3. ogni sintomo dura ≥ 5 minuti e ≤ 60 minuti.
D. Non attribuita ad altra condizione
Sesso
Anche in questo caso la prevalenza di emicrania con aura è maggiore nelle donne, con un
rapporto F:M pari a 2:1, meno marcato dunque di quello presente nell’emicrania senz’aura.
Età d’insorgenza
Frequentemente l’emicrania con aura insorge in età giovanile, ma meno precocemente di
quanto accada per l’emicrania senz’aura. L’insorgenza nella prima decade di vita si assesta
infatti attorno al 31,7% nel caso di emicrania senz’aura e al 12,2% nel caso di emicrania con
aura 13.
Fattori scatenanti
Non sembra esistano particolari fattori scatenanti comunemente ricorrenti in ogni paziente.
I fattori psicologici, in particolare lo stress, sembrano giocare un ruolo importante pure in
questa forma di emicrania, così come i fattori climatici, che incidono in oltre un quarto dei
soggetti. Discreta importanza sembrano rivestire gli stimoli visivi, mentre non vi è la stessa
evidenza per i fattori alimentari 14.
Caratteristiche dell’attacco
Non esistono orari preferenziali di insorgenza delle crisi. Queste hanno una frequenza molto
irregolare e in media molto più bassa rispetto agli attacchi di emicrania senz’aura. L’elemento
più caratteristico dell’emicrania con aura è, come noto, l’aura stessa e non il dolore. Si tratta
di una fase precoce dell’attacco, caratterizzata dalla comparsa di sintomi neurologici focali di
origine emisferica e/o troncoencefalica. Tra i sintomi più frequenti si ritrovano quelli di tipo
10
emicrania
visivo 15 che comprendono: scotomi scintillanti, flash luminosi, spettri di fortificazione (linee
luminose disposte a zig-zag). Esistono anche sintomi negativi quali l’offuscamento della vista,
o un’emianopsia laterale omonima. Al secondo posto in ordine di frequenza vi sono i sintomi
sensitivi, in cui compaiono parestesie che coinvolgono più spesso la mano e che da qui possono poi progredire lungo il braccio, coinvolgendo contemporaneamente la sede periorale
e linguale (cosiddetta sindrome cheiro-orale). Infine si possono rilevare alcuni sintomi fasici,
caratterizzati in primis dalla disartria.
L’esordio dell’aura è graduale (dai 5 ai 10 minuti); i sintomi possono perdurare per un tempo
variabile tra i 5 e i 60 minuti, ma questo intervallo temporale può anche estendersi al di sopra di
un’ora, se sono presenti più tipi di sintomi che si succedono uno dopo l’altro. La cefalea segue
solitamente l’aura, con un intervallo libero che può andare da pochi secondi a un’ora. La fase algica tendenzialmente dura meno che nell’emicrania senz’aura, ma non vi sono regole precise.
Il dolore ha più spesso una localizzazione unilaterale rispetto a quella riscontrabile in una
emicrania senz’aura.
Emicrania e ciclo riproduttivo femminile
Come già precedentemente accennato, a partire dalla pubertà l’emicrania presenta una
prevalenza nettamente maggiore nel sesso femminile rispetto a quello maschile con un
rapporto di 3,5:1 tra i due sessi nel pieno dell’età fertile 5. Questa discrepanza sembrerebbe
attribuibile alla presenza, nelle donne, di un preciso fattore scatenante costituito dagli ormoni sessuali femminili e in particolare dalla loro variazione ciclica nei vari momenti della
vita riproduttiva 7.
L’esperienza clinica permette infatti di affermare che la maggioranza delle donne emicraniche riferisce di soffrire di attacchi in qualche modo correlati al ciclo mestruale, che si
presentano in particolare immediatamente prima, durante e/o subito dopo i giorni del flusso mestruale (attualmente si tende a delimitare tale periodo in modo piuttosto restrittivo,
identificando una “finestra perimestruale” della durata di cinque giorni, che si estende da
due giorni prima a tre giorni dopo l’inizio del flusso). Nell’ambito di quella che viene genericamente detta emicrania mestruale si riconoscono 2 distinte entità: l’emicrania mestruale
pura, caratterizzata da attacchi emicranici che si presentano sempre e solo nella finestra perimestruale e l’emicrania correlata alle mestruazioni, in cui gli attacchi si presentano sempre a
cadenza catameniale ma eventualmente anche in altri momenti, per effetto di diversi fattori
scatenanti o anche in apparenza senza alcun motivo. Mentre l’emicrania mestruale pura è
piuttosto infrequente, essendo presente in non più del 7-10% delle donne emicraniche,
l’emicrania correlata alle mestruazioni è invece molto comune, interessando almeno il 50%
delle donne emicraniche.
Gli attacchi mestruali si presentano di solito sotto forma di emicrania senz’aura (i fenomeni
neurologici dell’aura sono reperibili solo in casi eccezionali); in genere ad ogni ciclo si associa un attacco molto severo, di lunga durata ed accompagnato da imponenti fenomeni
vegetativi, particolarmente refrattario al trattamento farmacologico e con un’alta probabili11
interazioni farmacologiche nel trattamento dell’emicrania
tà di recidiva 16. Gli attacchi che incidono nei giorni in cui è presente il flusso hanno inoltre
maggiore gravità rispetto a quelli immediatamente premestruali 17.
Mentre il ciclo mestruale con le sue continue fluttuazioni ormonali può rappresentare un
continuo stimolo per l’insorgenza di un attacco, la gravidanza costituisce un periodo di relativo benessere per la maggior parte delle pazienti emicraniche. In questo periodo, infatti,
l’emicrania presenta una spiccata tendenza al miglioramento (65-70% dei casi) o addirittura
alla remissione 7. Esistono alcune condizioni che permettono di prevederne il miglioramento: esso è più probabile nell’emicrania senz’aura, rispetto a quella con aura, e diviene più
consistente con il progredire dell’età gestazionale. Se la sintomatologia è insorta al menarca, o se la cadenza degli attacchi è stata tipicamente mestruale, e soprattutto se la paziente
è primigravida, la percentuale di miglioramento sarà decisamente elevata 18.
Tra le varie modificazioni che avvengono in gravidanza e che possono rendere conto del
minor numero di attacchi, le più rilevanti sembrano essere la stabilizzazione dei tassi estrogenici nel sangue 19, l’incremento di sostanze ad alta capacità analgesica quali le β-endorfine 20, e la diminuzione del tono muscolare. Molte altre variazioni, di tipo fisico, biochimico
ed emozionale, legate alla gravidanza, possono inoltre giocare un ruolo importante nel favorire il miglioramento dell’emicrania 21. Purtroppo esiste anche una minoranza di donne
emicraniche che non trova giovamento particolare e a volte peggiora. Solo in un numero
veramente esiguo di pazienti gli attacchi emicranici esordiscono con la gravidanza 22; in
questo ultimo caso è necessario escludere attentamente la presenza di altre patologie concomitanti.
Per ciò che concerne l’effetto dell’assunzione dei contraccettivi orali sull’andamento dell’emicrania, nonostante sia noto che in alcuni casi si possa avere una esacerbazione della
sintomatologia dolorosa, non sembrerebbe giustificato escludere dai benefici della “pillola”
tutte le donne che soffrono di tale disturbo. Nel 65% dei casi la pillola non esercita alcun
effetto nell’emicrania senz’aura, nel 25% dei casi la peggiora e nel 10% circa, al contrario, la
migliora 18. Bisogna quindi valutare attentamente caso per caso. Differente è il caso specifico dell’emicrania con aura: infatti sembrerebbe che l’assunzione della pillola incrementi il
numero delle crisi in più della metà delle pazienti. Inoltre i contraccettivi orali, in presenza
di emicrania con aura (e ancor di più se la donna fuma), costituiscono un fattore di rischio
per ictus cerebrale. Anche se, in termini assoluti, la possibilità di incorrere in un accidente
cerebrovascolare rappresenta un evento remoto (si tratta pur sempre di un’evenienza molto
rara in una giovane donna), la maggior parte degli studiosi concorda nel divieto dell’uso
della pillola per le donne affette da emicrania con aura 23.
Infine bisogna prendere in considerazione come varia l’emicrania al sopraggiungere della
menopausa. Con l’abolizione delle cicliche fluttuazioni ormonali si osserva generalmente
un miglioramento della sintomatologia nella maggior parte delle donne. Il miglioramento può comunque essere preceduto da un certo periodo di esacerbazione di frequenza
ed intensità degli attacchi emicranici, soprattutto nella prima fase del climaterio, in cui vi
sono ancora fluttuazioni irregolari degli ormoni ovarici. L’andamento dell’emicrania è invece
completamente diverso nel caso di una menopausa chirurgica, dove è osservabile un peggioramento dell’emicrania in circa i due terzi dei casi 24.
12
emicrania
Bibliografia
Adams F, ed. The extant works of Aretaeus, the Cappadocian. London: The Sydenham Society 1856; p. 52.
1
Ad Hoc Committee on the Classification of Headache of the NIH. Classification of headache. JAMA
1962;179:717-8.
2
3
Headache Classification Committee of the International Headache Society. Classification and
diagnostic criteria for headache disorders, cranial neuralgias and facial pain. Cephalalgia 1988;8(Suppl.
7):1-96.
Headache Classification Subcommittee of the International Headache Society. The International
Classification of Headache Disorders. Cephalalgia 2004;24(Suppl. 1):1-160.
4
Lipton RB, Bigal ME, Diamond M, Freitag F, Reed ML, Stewart WF. Migraine prevalence, disease burden,
and the need for preventive therapy. Neurology 2007;68:343-9.
5
Gardner LK. Genetics of migraine: an update. Headache 2006;46(Suppl. 1):S19-24.
6
MacGregor A. Migraine in women. London: Martin Dunitz Ltd 1999.
7
Blau JN. Migraine: theories of pathogenesis. Lancet 1992;339:1202-7.
8
Schoonman GG, Evers DJ, Terwindt GM, van Dijk JG, Ferrari MD. The prevalence of premonitory symptoms
in migraine: a questionnaire study in 461 patients. Cephalalgia 2006;26:1209-13.
9
Lipton RB, Stewart WE, Diamond S, Diamond M, Reed M. Prevalence and burden of migraine in the
United States: data from the American Migraine Study II. Headache 2001;41:646-57.
10
11
Silberstein SD. Migraine symptoms: results of a survey of self-reported migraineurs. Headache
1995;35:387-96.
Cologno D, De Pascale A, Manzoni GC. Familial occurrence of migraine with aura in a population-based
study. Headache 2003;43:231-4.
12
Manzoni GC, Farina S, Granella F, Alfieri M, Bisi M. Classic and common migraine. Suggestive clinical
evidence of two separate entities. Funct Neurol 1986;1:112-22.
13
Cologno D, Torelli P, Manzoni GC. Possible predictable factors in the prognosis of migraine with aura.
Cephalalgia 1999;19:824-30.
14
Russel MB, Olesen J. A nosographic analysis of the migraine aura in general population. Brain
1996;119:355-61.
15
Granella F, Sances G, Allais G, Nappi RE, Tirelli A, Benedetto C, et al. Characteristics of menstrual and nonmenstrual attacks in women with menstrually related migraine referred to headache centers. Cephalalgia
2004;24:707-16.
16
MacGregor A, Hackshaw A. Prevalence of migraine on each day of the natural menstrual cycle. Neurology
2004;63:351-3.
17
Granella F, Sances G, Zanferrini C, Costa A, Martignoni E, Manzoni GC. Migraine without aura and
reproductive life events: a clinical epidemiological study in 1300 women. Headache 1993;33:385-9.
18
Silberstein SD. Migraine and women. The link between headache and hormones. Postgrad Med
1995;97:147-53.
19
Genazzani AR, Petraglia F, Facchinetti F. Opioids and reproduction. In: Genazzani AR, Volpe A, Facchinetti
F, eds. Gynecological Endocrinology. Lancs: Parthenon Publishing 1987; pp. 43-45.
20
21
Allais G, Bosio A, Mana O, Airola G, Chiochetto D, Terzi MG, et al. Migraine during pregnancy
and lactation: treatment of the acute attack and non-pharmacological strategies. Minerva Med
2003;94(Suppl. 1):27-38.
13
interazioni farmacologiche nel trattamento dell’emicrania
22
Chancellor AM, Wroe SJ, Cull RE. Migraine occurring for the first time in pregnancy. Headache
1990;30:224-7.
Allais G, De Lorenzo C, Mana O, Benedetto C. Oral contraceptives in women with migraine: balancing
risks and benefits. Neurol Sci 2004;25:S211-4.
23
Neri I, Granella F, Nappi R, Manzoni GC, Facchinetti F, Genazzani AR. Characteristics of headache at
menopause: a clinico-epidemiologic study. Maturitas 1993;17:31-7.
24
14
Capitolo 2
NEURONE SEROTONINERGICO:
SEROTONINA ED EMICRANIA
F. Franconi, I. Campesi
Nel 1930 Vittorio Erspamer (1954) 1, iniziando a studiare le cellule enterocromaffini, vide che,
trattate con colorante atto a mettere in evidenza il nucleo indolico, assumevano una intensa
colorazione. Si apriva la strada che di lì a pochi anni avrebbe condotto alla scoperta della
serotonina o 5 idrossitriptamina (5-HT), la cui formula di struttura è mostrata in Figura 1. Tuttavia, prima di arrivare a definire la funzione di neurotrasmettitore di questa indolamina, si è
Figura 1
Struttura tridimensionale
della serotonina.
15
interazioni farmacologiche nel trattamento dell’emicrania
dovuto attendere la metà del secolo scorso e solo successivamente si è evidenziato che essa
agisce attraverso numerosi recettori di membrana appartenenti a due diverse classi: i recettori
ionotropici e i recettori metabotropici 2. Uno schema della sinapsi serotoninergica è illustrato
in Figura 2.
L-triptofano
Serotonina
1
Agonista della serotonina
Formazione
di 5-HT
MAO inibitori
3
Metabolismo di 5-HT
Bloccante uptake
Concentrazione
sinaptica di 5-HT
2
Amfetamina
4 Bloccante uptake
Concentrazione
sinaptica di 5-HT
Rilascio
di 5-HT
5 Agonista 5-HT
Recettore
5-HT2
Recettore
5-HT1A
Attivazione
recettore 5-HT
Figura 2
Schema di una sinapsi serotoninergica dove sono evidenziate le sedi delle possibili interazioni
farmacologiche. 1) Sintesi della 5-HT a partire dal triptofano; 2) farmaci facilitanti il rilascio; 3) inibitori del
metabolismo della serotonina; 4) bloccanti del re-uptake; 5) agonisti recettoriali.
Sintesi della serotonina
Nell’organismo dei mammiferi la sintesi della serotonina avviene a partire dall’aminoacido
aromatico triptofano, introdotto con la dieta, che, ad opera della triptofano-idrossilasi, l’enzima che catalizza la tappa limitante la sintesi, viene idrossilato sull’anello aromatico 2 con
conseguente formazione di 5-idrossitriptofano (Fig. 3). Uno dei fattori più importanti nella
regolazione della sintesi della serotonina è la disponibilità dell’aminoacido precursore. Il triptofano deve essere trasportato nelle cellule ed attraversare la membrana ematoencefalica e
ciò avviene attraverso un processo attivo che utilizza specifici trasportatori. Tuttavia è bene
ricordare che la disponibilità cerebrale di triptofano non è solo funzione della sua concentra16
Neurone serotoninergico: serotonina ed emicrania
Inibitori dell’idrossilasi
L-triptofano
fenfluramina
p-clorofenilalanina
Triptofano
idrossilasi
α-propildopacetamide
6-fluorotriptofano
p-cloroamfetamina
5-idrossitriptofano
Inibitori della decarbossilasi
L-aminoacido
decarbossilasi
α-metildopa
benserazide
brocresine
carbidopa
Serotonina
difluorometildopa
monofluorometildopa
Figura 3
Sintesi della Serotonina.
zione plasmatica, ma anche di quella degli aminoacidi che competono con il triptofano per il
meccanismo di trasporto 2.
Una volta che si è giunti alla formazione del 5-idrossitriptofano, come illustrato nella Figura 3,
la biosintesi della serotonina procede mediante una reazione di decarbossilazione catalizzata
dalla L-aminoacido decarbossilasi 2. L’attività di questo enzima a livello celebrale è particolarmente elevata, tanto che non è possibile trovare il 5-idrossitriptofano nel cervello.
Catabolismo della serotonina
Il catabolismo della 5-idrossitriptamina (vedi Figura 4) coinvolge enzimi situati sulla membrana
esterna dei mitocondri ed esattamente le monoamino ossidasi (MAO). Questa è una famiglia di
enzimi costituita da due isoforme, MAO-A e MAO-B, ed è proprio la prima a catalizzare l’ossidazione della serotonina con produzione di 5-idrossindolacetaldeide 2. Quest’ultima è substrato
dell’aldeide deidrogenasi ed è convertita in acido 5-idrossindolacetico 2. Le MAO sono un target
farmacologico importante e possono essere inibite da una serie di molecole denominate inibitori delle MAO (IMAO). Gli inibitori possono essere specifici e non trovano un uso terapeutico
come antidepressivi perché aumentano la disponibilità di serotonina a livello sinaptico.
17
interazioni farmacologiche nel trattamento dell’emicrania
Inibitori delle MAO-A
Serotonina
Selettivi:
Monoamino
ossidasi A
Non selettivi:
clorgilina
idrazalina
brofaromina
iproniazide
moclobemide
nialamide
tranilcipromina
5-idrossindolacetaldeide
Inibitori della deidrogenasi
Aldeide
deidrogenasi
blu di metilene
disulfiram
clorpropamide
Acido
5-idrossindolacetico
Figura 4
Catabolismo della serotonina.
Trasportatore della serotonina
Lo spegnimento della neurotrasmissione è un fatto di estrema rilevanza affinché la trasmissione del segnale non subisca variazioni significative imputabili a fenomeni di desensibilizzazione recettoriale. Lo spegnimento dell’azione dei neuroni serotoninergici avviene anche attraverso la ricaptazione della serotonina dallo spazio sinaptico. Il trasportatore
della serotonina è situato sulla membrana plasmatica e regola la concentrazione tra il
comparto intracellulare e quello dello spazio sinaptico e quindi la saturazione dei recettori ed il tempo di attivazione degli stessi, modulando sia la trasmissione tonica sia quella
fasica (Fig. 5). La ricaptazione è un processo altamente efficace e può determinare un
gradiente transmembranario di 700-800 volte. L’importanza di tale processo è confermata
dall’uso degli inibitori del sistema di trasporto che producono un aumento della stimolazione sull’organo effettore.
Esistono diversi tipi di neurotrasportatori e quello della serotonina appartiene alla classe
dei carrier Na+/Cl- dipendenti, così come quello delle altre ammine biogene. Inoltre, è
bene ricordare che la dipendenza ionica fa sì che, in particolari condizioni, il sistema di
trasporto, invece di portare la serotonina nel citoplasma, la porta nello spazio extrasinaptico. E proprio all’inversione della direzione del trasporto si deve attribuire la facilitazione
18
Neurone serotoninergico: serotonina ed emicrania
5-HT
MEMBRANA
POSTSINAPTICA
Na+
Cl-
SPAZIO
SINAPTICO
CITOPLASMA
Figura 5
Trasportatore della serotonina.
del rilascio non-esocitotico del neurotrasmettitore con conseguente aumento della trasmissione monaminergica.
Tra le molecole che facilitano tale processo ricordiamo le amfetamine ed i loro derivati. Infatti queste sono substrati del trasportatore che vengono portati all’interno della cellula:
come conseguenza si ha un aumento dei siti disponibili per la serotonina sulla superficie
interna della membrana con aumento del trasporto verso l’esterno. Questo meccanismo
è anche utilizzato dalla 3,4-metilendiossimetamfetamina (MDMA-ecstasy) e dalla fenfluramina, un anoressizzante che libera serotonina.
I trasportatori delle monoamine (noradrenalina, dopamina, serotonina) hanno una stretta
omologia strutturale fra di loro, come confermato dal fatto che alcuni farmaci, tra cui gli
antidepressivi triciclici imipramina e amitriptilina, li inibiscono, mentre la desimpramina e
la clorimipramina sono selettive, la prima verso il trasportatore della noradrenalina, mentre la seconda lo è verso quello della serotonina.
Inoltre, i trasportatori delle monoamine possono essere bloccati in maniera non selettiva
da alcune sostanze di abuso (cocaina) che sono in grado di bloccare i sistemi di trasporto 2. Più recentemente sono state sintetizzate molecole che presentano una selettività
maggiore verso i singoli neurotrasportatori come gli inibitori selettivi del re-uptake della
serotonina (SSRI) e gli inibitori selettivi del re-uptake della noradrenalina (SNRI); è facile
intuire che gli antidepressivi triciclici e gli SSRI non si legano allo stesso sito del trasportatore 2.
19
interazioni farmacologiche nel trattamento dell’emicrania
Liberazione della serotonina
Affinché avvenga la trasmissione del messaggio mediato dalla serotonina è necessario che
questa venga liberata dalle vescicole dove è immagazzinata. Il processo d’immagazzinamento
prevede un numero costante e riproducibile di molecole ed avviene attraverso un trasporto attivo. Infatti il neurotrasmettitore è immagazzinato contro-gradiente di concentrazione e
l’energia necessaria viene fornita da una pompa protonica elettrogenica che prende il nome di
ATPasi vacuolare. I trasportatori vescicolari non mostrano nessuna analogia con quelli presenti
sulla membrana esterna. Il neurotrasmettitore contenuto nelle vescicole viene poi liberato
attraverso un meccanismo di esocitosi: questo fenomeno appare essere calcio-dipendente
ed è alquanto complesso, prevedendo varie e numerose fasi 2.
Recettori
È noto che le azioni della serotonina si esplicano attraverso numerosi sottotipi recettoriali che
sono distribuiti in tutto il corpo, andando dal cervello all’intestino fino alle piastrine. Nei mammiferi sono stati identificati 14 sottotipi recettoriali che presentano caratteristiche specifiche
per quanto riguarda l’interazione con gli agonisti e gli antagonisti e i meccanismi di trasduzione del segnale: ad esempio i 5-HT3 sono ionotropici mentre gli altri (5-HT1, 5-HT2, 5-HT4, 5-HT5,
5-HT6, 5-HT7) sono metabotropici, essendo accoppiati alle proteine G (Fig. 6).
Nome
5-HT1A
Agonisti
selettivi
Trasduzione
del segnale
5-HT1B
Triptani
cAMP
cAMP
Figura 6
Trasduzione del segnale relativo ai recettori 5-HT1.
20
5-HT1D
5-HT1E
5-HT1F
cAMP
cAMP
Triptani
cAMP
Neurone serotoninergico: serotonina ed emicrania
La classe 5-HT1 è composta da 5 isoforme (5-HT1A, 5-HT1B, 5-HT1D, 5-HT1E, 5-HT1F): sono legate
prevalentemente alle proteine G inibitorie che sono accoppiate all’adenilato ciclasi in senso
inibitorio (Fig. 6), per cui si osserva nel tessuto una diminuzione dei livelli di cAMP; tuttavia
sono stati descritti anche altri meccanismi di trasduzione 3 del segnale come indicato nella
Tabella I.
Tabella I
Recettori metabotropici della serotonina e loro principali meccanismi di trasduzione del segnale
Recettore
Proteina G
Principale meccanismo di trasduzione
5-HT1A
Gialfa3 > Gialfa2 > Gialfa1 >
Goalfa > Gsalfa
Inibizione adenilato ciclasi
Attivazione dei canali del potassio
Stimolazione ERK
Inibizione della conduttanza dei canali del calcio
5-HT1B
Gialfa3 > Gialfa1 > Gialfa2 >
Goalfa
Inibizione della adenilato ciclasi
Stimolazione ERK
5-HT1D
Gialfa e Goalfa
Inibizione della adenilato ciclasi
5-HT1E
Gialfa e Goalfa
Inibizione della adenilato ciclasi
5-HT1F
Gialfa e Goalfa
Inibizione della adenilato ciclasi
5-HT2A
Gqalfa e G11alfa > Gialfa
Attivazione della fosfolipasi C
Attivazione della PKC
Stimolazione ERK
5-HT2B
Gqalfa e G11alfa
Attivazione della fosfolipasi C
Stimolazione ERK
Attivazione della fosfolipasi A2
5-HT2C
Gqalfa e G11alfa
Attivazione della fosfolipasi C
Attivazione della PKC
Attivazione della fosfolipasi A2
5-HT4
Gsalfa
Attivazione della adenilato ciclasi
Attivazione della PKA
5-HT5a
Non noto
Non noto
5-HT5B
Non noto
Non noto
5-HT6
Gsalfa
Attivazione della adenilato ciclasi
5-HT7
Gsalfa
Attivazione della adenilato ciclasi
Attivazione della PKA
Modificata da Ramadan et al., 2006 3.
21
interazioni farmacologiche nel trattamento dell’emicrania
In questo contesto ci sembra opportuno ricordare che per alcuni anni vi è stata un po’ di diatriba a proposito dei recettori 5-HT1B e 5-HT1D. Alcuni autori ritenevano che i recettori 5-HT1B
fossero espressi solo nei roditori, mentre si pensava che i 5-HT1D fossero espressi in altre specie,
incluso l’uomo. In realtà, i due recettori sono molto simili dal punto di vista farmacologico,
anche se devono essere considerati due entità distinte 2.
È importante ricordare che i recettori 5-HT1B e 5-HT1D possono modulare, inibendola, la secrezione della serotonina dal neurone serotoninergico 2.
Serotonina e cefalea
Il ruolo della serotonina, o 5-idrossitriptamina, nella cefalea è ben definito da molti anni come
evidenziano numerose review pubblicate su importanti riviste mediche 2 4 5. Il ruolo della serotonina nell’emicrania è sostenuto da una serie di dati a livello umano. Infatti la concentrazione plasmatica e piastrinica di serotonina varia nel corso dell’attacco emicranico, e la sua
eliminazione urinaria e quella dei suoi metaboliti è elevata durante gli attacchi emicranici 6.
Infine, agenti che determinano una deplezione di serotonina possono precipitare un attacco
di cefalea.
Particolarmente importanti appaiano essere le azioni della serotonina esplicate attraverso l’attivazione dei recettori 5-HT1D e 5-HT1B 5. Detti recettori, come mostrato in precedenza, sono
negativamente correlati con l’adenilato ciclasi mediante varie proteine G inibitorie 7 come
illustrato in Tabella I. Entrambi sono presenti a livello del trigemino (asse trigemino-tessuto
vascolare) ed è noto che l’attivazione del trigemino è uno dei meccanismi fondamentali nella
cascata di eventi che portano all’inizio ed al perpetuarsi dell’attacco cefalalgico. In questa localizzazione si ritrovano anche i recettori 5-HT1F 8 (Tab. I). L’attivazione dei recettori 5-HT1D e 5-HT1B,
localizzati sui vasi intracranici, incluse le anastomosi arterovenose, conduce ad una vasocostrizione che sembra essere correlata con la remissione dell’attacco cefalalgico. D’altra parte
sembra anche che l’attivazione dei suddetti recettori sulle terminazioni dei nervi sensori nel
sistema trigeminale determini un’inibizione della liberazione dei peptidi pro-infiammatori.
Come illustrato in precedenza, la cefalea è una malattia che presenta una più alta incidenza
nel sesso femminile e quindi riteniamo opportuno dedicare un po’ di spazio per ricordare le
relazioni esistenti tra il sistema della serotonina e gli ormoni sessuali femminili. Neumeister 9
evidenzia come agli estrogeni ed al progesterone sia imputabile la ridotta riserva serotoninergica e la ridotta attività del sistema serotoninergico nel cervello femminile. D’altra parte,
studi clinici, effettuati con la tomografia ad emissione di positroni (PET) e con la risonanza magnetica (MRI), evidenziano, in maniera abbastanza esaustiva, che le giovani donne depresse
sintetizzano meno serotonina rispetto agli uomini della stessa fascia di età 10.
Le differenze di genere non sono solo visibili a livello della sintesi, ma si estendono anche sul
fronte del catabolismo del precursore della serotonina: la triptofano-pirrolasi, enzima che catalizza il catabolismo del triptofano, è infatti più attiva nelle donne fertili rispetto agli uomini 11.
Inoltre, la deplezione di triptofano determina una depressione più grave nelle donne rispetto
all’uomo 12 9, malattia quest’ultima che ha, fra l’altro, una netta prevalenza femminile. Infine, i
22
Neurone serotoninergico: serotonina ed emicrania
livelli plasmatici e piastrinici di serotonina correlano positivamente con le variazioni dei livelli
di estrogeni presenti durante il ciclo mestruale 6: le fasi con alti livelli di estrogeni si associano
ad alti livelli di serotonina.
Triptani
Farmacodinamica
Sin dagli anni Novanta del secolo scorso sono in uso terapeutico molecole che attivano i
sottotipi recettoriali 1B/1D: i triptani 2 5 13. Questi esercitano la loro azione antiemicranica modulando la liberazione di neurotrasmettitore mediante l’attività agonistica sugli autorecettori
5-HT1B e 5-HT1D; inoltre sembrano bloccare la liberazione di neuropeptidi pro-infiammatori
(calcitonin gene-related peptides, provvisto di forte attività vasodilatante; sostanza P, con azione
proalgogena e vasodilatante; neurochinina A con azione molto simile a quella della sostanza
P ma anche con importante influenza sulla permeabilità vasale) a livello delle terminazioni
nervose nello spazio perivascolare 5.
Invero, i triptani possono ridurre lo sviluppo della estravasione plasmatica nella dura madre associata con la depolarizzazione degli assoni perivascolari in seguito ad iniezione di capsaicina
o stimolazione del nervo trigemino e ciò potrebbe contribuire all’azione anticefalalgica 7.
I recettori 5-HT1B sono presenti sulle cellule endoteliali dei vasi meningei umani e l’RNA degli
stessi è molto espresso a livello delle cellule muscolari lisce vasali, suggerendo che la loro
attivazione sia importante per la vasocostrizione 5.
In definitiva, gli agonisti dei recettori 5-HT1B e 5-HT1D sembrano esercitare la loro azione anticefalagica mediante tre meccanismi: un meccanismo vascolare mediato dalla vasocostrizione, un meccanismo neurogenico attraverso l’inibizione della liberazione di neuropeptidi
pro-infiammatori e pro-algogeni ed un meccanismo centrale che controlla la trasmissione
dolorosa 5.
Il primo fra i triptani ad essere messo in commercio è stato il sumatriptan, la seconda generazione è invece rappresentata da almotriptan, eletriptan, frovatriptan, naratriptan, rizatriptan e
zolmitriptan. Le strutture molecolari di questa classe di farmaci sono riportate in Figura 7.
Questi farmaci presentano una buona efficacia terapeutica accompagnata da un buon profilo
di tollerabilità/sicurezza 14.
Caratteristiche farmacocinetiche dei triptani
I vari triptani (almotriptan, eletriptan, frovatriptan, naratriptan, rizatriptan, zolmitriptan, sumatriptan), nonostante le analogie strutturali, presentano caratteristiche farmacocinetiche molto
diverse, alcune delle quali sono riassunte in Tabella II 4 15-19. Ciò non meraviglia perché è ben
noto che piccole variazioni nella struttura della molecola ne modificano la lipofilia, influenzando quindi il passaggio attraverso le membrane cellulari con effetti sull’assorbimento, la
distribuzione, il metabolismo e l’eliminazione.
23
interazioni farmacologiche nel trattamento dell’emicrania
HO
NH2
N
H
serotonina
H3C
N
N
H
N
N N
S
O O
N
H
N
rizatriptan
O
O
N
H
zolmitriptan
eletriptan
H
N
N
N
H
N
H
naratriptan
N
H
almotriptan
O O
S
O O
S
NH
S
O O
N
H
N
N
H
CH3
N
sumatriptan
N
N
H2N
NH
O
frovatriptan
Figura 7
Le strutture degli agonisti dei recettori 1B/1D della serotonina 5-HT.
L’assorbimento descrive la velocità ed il tempo necessari a raggiungere la circolazione sistemica dal luogo di somministrazione ma, più che la misura dell’assorbimento, nella clinica appare
importante misurare la biodisponibilità, definita come la frazione del farmaco che riesce a
raggiungere il suo sito d’azione o il liquido biologico dal quale arriva facilmente al suo bersaglio. La biodisponibilità assume una grande importanza nella somministrazione orale in
quanto, oltre che dell’assorbimento a livello dello stomaco e dell’intestino, che dipende dalle
caratteristiche chimico fisiche della molecola, tiene conto del passaggio che il farmaco necessariamente deve compiere nel fegato. Qui, prima di raggiungere la circolazione sistemica, il
medicinale può essere metabolizzato e/o escreto per via biliare; se la capacità metabolica del
fegato è alta o se il farmaco è escreto in maniera notevole per via biliare, la biodisponibilità è
ridotta per quel fenomeno denominato effetto primo passaggio. Come si vede nella Tabella II,
la biodisponibilità dei vari triptani è molto diversa passando dal 14% del sumatriptan a oltre il
60% per l’almotriptan ed il naratriptan.
Importanti e significative differenze fra i vari triptani sono state ampiamente descritte a livello
metabolico; infatti alcune di queste molecole sono prevalentemente substrato degli enzimi
citocromo P450 dipendenti (CYP) mentre altre sono metabolizzate prevalentemente dalle
MAO, le cui due isoforme, MAO-A e MAO-B, hanno un ruolo fondamentale nel metabolismo
delle catecolamine e della serotonina (Fig. 4). Altre sono substrati sia delle MAO che delle
CYP, per altre ancora è stato invocato anche il ruolo di ulteriori enzimi. Un’analisi un poco più
24
49,5
30
Cmax (mg/l)
Legame albumine (%)
Renale 50%
3-7
Renale 10%
5
CYP34A
85
82
<1
50
Eletriptan
Renale (50%)
ed epatica
26
CYP1A2
seguita
CYP2D6
15%
4,2/ 7,0*
2-3, con il 60%
nella 1 ora
23/40*
Frovatriptan
Renale 50%
5-6
CYP1A2
-3A4, -2C9,
-2C19 -2D6
28-31
12,6
2-3
63/74*
Naratriptan
Renale 14%
2,5-3
MAO
14
19,8
1-1,5
40-45%
Rizatriptan
Renale (20%)
2
MAO-A (80%)
14-21%
54
2,5
14
Sumatriptan
Renale > 60%
2,5-3
CYP1A2/MAO
25
3,3/3,8
1
40-50
Zolmitriptan
* Determinata indipendentemente maschi/femmine.
Cmax = concentrazione plasmatica massima raggiunta dopo la somministrazione; Tmax = tempo necessario per raggiungere il picco ematico; T1/2 = emivita (Goadsby et al., 1998 4; Jhee
et al., 2001 15; Dodick et al., 2004 16; Dixon et al., 1993 17; Dixon et al., 1997 18; Lacey et al., 1995 19).
Eliminazione
T1/2 (h)
MAO (27%)
Renale
CYP3A4 + CYP
2D6 (16-18%)
1-4
Tmax (h)
Enzimi
> 70
Biodisponibilità (%)
Almotriptan
Tabella II
Principali caratteristiche farmacocinetiche dei triptani
Neurone serotoninergico: serotonina ed emicrania
25
interazioni farmacologiche nel trattamento dell’emicrania
approfondita rivela che l’almotriptan viene metabolizzato per il 45% circa, ed in particolare le
MAO-A ne metabolizzano il 27% mentre il resto è metabolizzato dalle CYP2D6 e dalla CYP3A4,
essendo il metabolismo mediato prevalentemente dalla CYP3A4 20 21.
L’eletriptan è quasi totalmente metabolizzato dalla CYP3A4 22; tuttavia, a differenza degli altri
triptani, è anche substrato della glicoproteina-P (P-gp) 23, un trasportatore espresso sul polo
apicale degli enterociti e sull’endotelio dei vasi cerebrali, che veicola i suoi substrati dall’interno della cellula in direzione dell’ambiente extracellulare. Questo meccanismo potrebbe limitare l’assorbimento orale e la penetrazione cerebrale del farmaco nonostante la sua lipofilia 24.
La glicoproteina P può essere inibita o indotta da numerosi xenobiotici 25 e ciò porta ad un
ampliamento delle potenziali interazioni 26.
L’eletriptan si distribuisce nel latte umano ed il produttore suggerisce di minimizzare l’esposizione del neonato evitando l’allattamento materno per ventiquattro ore dopo il trattamento 27.
Il frovatriptan è più affine verso i recettori 5-HT1B rispetto agli altri triptani 28 (Tab. III 3) ed è caratterizzato da una lunga durata d’azione con un’emivita superiore a tutti gli altri, raggiungendo le 25 ore (Tab. II). La lunga emivita si accompagna tuttavia, ad una latenza relativamente
lunga prima che esso possa agire 28. La sua biotrasformazione è principalmente catalizzata
dalla CYP1A2, enzima largamente influenzato da fattori ambientali come dieta e fumo di sigaretta (vedi dopo).
Tabella III
Affinità dei triptani verso i vari sottotipi recettoriali umani dei 5-HT1 della serotonina (espressa
come costante di inibizione)
Triptano
5-HT1B
5-HT1D
Almotriptan
8,15
7,80
Eletriptan
8,14
8,85
Frovatriptan
8,24
8,31
Naratriptan
8,64
8,55
Rizatriptan
7,70
8,18
Sumatriptan
7,77
8,13
Zolmitriptan
8,40
9,07
Adattata da Ramadan et al., 2006 3.
Il naratriptan è molto lipofilo; di conseguenza oltrepassa la barriera ematoencefalica ed ha una
buona biodisponibilità 29. È interessante notare che la biodisponibilità è del 63% nei soggetti
di sesso maschile e del 74% in quelli di sesso femminile 2 e ciò si riflette nei livelli ematici massimi che sono più bassi (35-50%) negli uomini rispetto alle donne 15. Viene prevalentemente
eliminato per via renale anche attraverso la secrezione tubulare e nell’urine si ritrova una quo26
Neurone serotoninergico: serotonina ed emicrania
ta immodificata (50%) mentre una parte (30%) è costituita da metaboliti. Il suo metabolismo
è mediato da numerose isoforme delle CYP ed esattamente dalle CYP1A2, -3A4, -2C9, -2C19 2
con formazione di metaboliti inattivi, almeno in vitro. Il naratriptan è controindicato nei pazienti affetti da grave insufficienza epatica e renale e la dose deve essere ridotta in funzione
della clearance della creatinina.
Il rizatriptan è disponibile anche come dissolving tablet (liofilizzato orale), forma che facilita
il rapido assorbimento intestinale ed agisce rapidamente, ma la sua emivita non è particolarmente lunga poiché si lega scarsamente alle proteine plasmatiche. Esso è substrato delle
MAO ma non delle CYP, riducendo la possibilità di interazioni di tipo metabolico a quelle
mediate dalle MAO 29. Anch’esso deve essere usato con cautela nei pazienti con grave insufficienza epatica e renale, dove si richiede una riduzione del dosaggio.
Il sumatriptan, il capostipite di questa famiglia di medicinali, oltre che stimolare i recettori
5-HT1B e 5-HT1D, agisce anche sui 5-HT1F 29 con buona affinità (Tab. III). Disponibile in varie forme farmaceutiche, ha una bassa biodisponibilità quando somministrato per via orale per un
effetto di primo passaggio elevato 30-32, ha un’emivita relativamente corta ed è biotrasformato
dalla MAO-A 33. Inoltre, ricordiamo che il triptano non oltrepassa la barriera ematoencefalica
ma si ritrova nel latte materno 29.
Infine, lo zolmitriptan è disponibile anche come spray nasale, ha una buona biodisponibilità
ed un’emivita di 2,5-3 ore 5, è in grado di passare la barriera ematoencefalica 29 e viene metabolizzato dalla CYP1A2 in un metabolita attivo (N-desmetil-zolmitriptan) che è più potente
(circa 2-6 volte) dello stesso zolmitriptan. Tale metabolita ha il medesimo profilo farmacocinetico del composto di partenza e partecipa all’attività terapeutica 2.
In generale, possiamo evidenziare che l’eliminazione renale dei triptani e dei loro metaboliti è molto variabile; infatti il sumatriptan, il frovatriptan e lo zolmitriptan sono scarsamente eliminati per questa via, contrariamente a quanto avviene per l’almotriptan, il
naratriptan ed il rizatriptan 34; è evidente che, per questi ultimi, è molto importante adeguare il dosaggio alla funzionalità renale, tramite la clearance della creatinina, per evitare
eventuali effetti avversi.
Effetti collaterali
La presenza di recettori 5-HT1B a livello coronarico 5 fa sì che i triptani siano controindicati nei
soggetti affetti da malattie cardiovascolari come angina, infarto, attacco ischemico transitorio
(TIA), malattie a carico dei distretti vascolari periferici 7. Tuttavia il sumatriptan e il rizatriptan
hanno mostrato una grande selettività verso i vasi meningei essendo 10 volte più potenti in
questo segmento vasale rispetto alle coronarie umane 5. Le osservazioni presenti in letteratura
sembrano suggerire che alle concentrazioni ematiche che si raggiungono con il normale regime terapeutico è poco probabile che insorga ischemia cardiaca in soggetti scevri da rischio
di malattie cardiovascolari 5. I triptani possono determinare un aumento, di solito lieve, della
pressione arteriosa per cui risultano controindicati negli ipertesi non controllati 7 e ciò non
meraviglia, considerato il loro meccanismo d’azione e la presenza dei recettori serotoninergici
a livello vasale.
27
interazioni farmacologiche nel trattamento dell’emicrania
Inoltre, i triptani devono essere usati con cautela nei diabetici, nei fumatori, nelle gestanti, negli obesi, nei soggetti con ipercolesterolemia, nelle donne di oltre 50 anni e negli uomini oltre
i 40 e nei soggetti con storia familiare di malattie cardiovascolari precoci 7.
I triptani danno anche effetti collaterali lievi a livello del Sistema Nervoso Centrale, che sono
positivamente correlati con la lipofilia della molecola 16 anche se sembrano intervenire ulteriori fattori. Gli effetti avversi più comuni sono la sonnolenza e la stanchezza (47%), la difficoltà di
concentrazione (26%), le palpitazioni (24%) e le vertigini (18%) 16. In altri studi si sono trovate
percentuali diverse ma la sonnolenza, la stanchezza e la difficoltà di concentrazione rimangono ai primi posti, mentre le palpitazioni vengono dopo le vertigini e la nausea.
Vista la particolare struttura del naratriptan e dell’almotriptan, in via teorica è possibile un’ipersensibilità nei pazienti che già lo sono verso le sulfonamidi 27. Inoltre il naratriptan è controindicato nei soggetti con insufficienza epatica e renale grave e il rizatriptan deve essere usato
con cautela nella stessa tipologia di pazienti.
Tra le possibili conseguenze dovute all’utilizzo dei triptani, così come con tutti gli agenti farmacologici e non elencati nella Tabella IV 35, desta preoccupazione l’insorgenza della sindrome serotoninergica che, per la sua peculiarità, sarà trattata nel paragrafo successivo.
Tabella IV
Molecole che possono indurre una sindrome serotoninergica
✘✘ Analgesici: fentanile, meperidina, pentazocina, tramadol
✘✘ Antibiotici e antivirali: linezolide, ritonavir
✘✘ Anticonvulsivanti: valproato
✘✘ Antiemicranici: triptani
✘✘ Antidepressivi: SSRI, SNRI, IMAO, triciclici, trazadone
✘✘ Antiobesità: sibutramina
✘✘ Antiparkinson: L-Dopa; selegilina
✘✘ Ansiolitici: buspirone
✘✘ Antitosse: destrometorfano
✘✘ Rimedi botanici e supplementi alimentari: ginseng, erba di San Giovanni (Hypericum perforatum),
triptofano
✘✘ Sostanze d’abuso: cocaina, amfetamine, ecstasy, LSD, semi di Peganum harmala
✘✘ Stabilizzanti dell’umore: litio
Modificata da Boyer et al., 2005 35.
Sindrome serotoninergica
La sindrome serotoninergica è una malattia iatrogena che è associata all’uso di determinati agenti che sono riassunti in Tabella IV e/o da interazioni fra sostanze ed è bene ricordare
che non è una sindrome da reazione idiosincrasica ai medicamenti, ma è sostenuta da un’ec28
Neurone serotoninergico: serotonina ed emicrania
cessiva attivazione serotoninergica a livello centrale e periferico 35. Dalla Tabella IV si evince
anche che la sindrome può essere associata a supplementi alimentari ed a rimedi botanici
che, usualmente, vengono assunti senza il controllo medico e quindi rendono più difficile la
prevenzione della sindrome e la diagnosi della stessa. L’incidenza della sindrome serotoninergica, come evidenziano Boyer e Shannon (2005) 35 in un esaustivo articolo pubblicato sul New
England Journal of Medicine, è aumentata da quando si utilizzano farmaci pro-serotoninergici.
Tuttavia appare difficile valutare la reale incidenza di tale patologia iatrogena per tutta una
serie di fattori, compresa la difficoltà relativa alla diagnosi. Infatti nei casi blandi l’ipertono
serotoninergico può dare luogo a sintomi aspecifici come tremori e diarrea.
Prima di andare oltre ci sembra opportuno descrivere gli altri sintomi della sindrome come un
insieme di alterazioni dello stato mentale, iperattività del sistema nervoso autonomo ed alterazioni neuromuscolari (Fig. 8) che si riflettono in agitazione, nervosismo, ipervigilanza, insonnia, confusione, delirio, acatisia, incoordinazione motoria, mioclono, ipertensione nei casi lievi,
ipotensione nei casi gravi, midriasi, diarrea, ipertermia che può superare i 41°C nelle forme
gravi. Inoltre sono presenti diaforesi, brividi, tachicardia, tachipnea, dispnea, e nella forme più
gravi semicoma, coma e alterazioni degli esami ematoclinici 35. La sintomatologia alquanto aspecifica pone il problema della diagnosi differenziale con l’ipertermia maligna da neurolettici,
malattie infettive, encefalopatia erpetica, colpo di calore, delirium tremens, intossicazione con
simpaticomimetici e anticolinergici.
Accanto alle molte forme blande della sindrome serotoninergica, che sono la maggioranza 35, è bene sottolineare che rare volte tale sintomatologia può portare ad un esito fatale.
Sintomi sindrome serotoninergica
Acatisia
Stato mentale
alterato
Clono
sostenuto
Ipertermia
Sintomi
gravi
Sintomi
lievi
Tremore
Clono
inducibile
Ipertonicità
muscolare
Figura 8
Sintomi della sindrome serotoninergica.
29
interazioni farmacologiche nel trattamento dell’emicrania
Di qui la grande preoccupazione da parte delle autorità sanitarie ed i recenti warning
della Food and Drug Administration.
In questo capitolo non si affronta il tema dell’efficacia terapeutica in quanto sarà ampiamente
trattato nel capitolo successivo.
Bibliografia
Erspamer V. Pharmacology of indole-alkylamines. Pharmacol Rev 1954;6:425-87.
1
Sander-Bush E, Mayer S. 5-Hydroxytryptamine (serotonin): receptor agonists and antagonists. In:
Hardman J, Limbird L, eds. Goodman & Gilman’s The pharmacological basis of therapeutics. New York:
McGraw-Hill 2006; pp. 297-316.
2
Ramadan NM, Buchanan TM. New and future migraine therapy. Pharmacol Ther 2006;112:199-212.
3
Goadsby PJ. Serotonin 5-HT1B/1D receptor agonists in migraine. Comparative pharmacology and its
therapeutic implications. CNS Drugs 1998;10:271-86.
4
Tepper SJ, Rapoport AM, Sheftell FD. Mechanisms of action of the 5-HT1B/1D receptor agonists. Arch
Neurol 2002;59:1084-8.
5
Legato M. Principles of gender-specific medicine. 1st edition. San Diego: Elsevier Academic Press 2004.
6
Sander-Bush E, Mayer S. 5-Hydroxytryptamine (serotonin): receptor agonists and antagonists. In:
Hardman J, Limbird L, eds. Goodman & Gilman’s The pharmacological basis of therapeutics. New York:
McGraw-Hill 2005; pp. 297-316.
7
Saxena P, Pfelt-Hansen P. Triptans, 5-HT1B/1D receptor agonists in the acute teatment of migraines. In:
Olesen J, Goadsby PJ, Ramadan N, Tfelt-Hansen P, Welch KMA, eds. The Headaches. Philadelphia:
Lippincott Williams and Wilkins 2006; pp. 469-503.
8
Neumeister A. Tryptophan depletion, serotonin, and depression: where do we stand? Psychopharmacol
Bull 2003;37:99-115.
9
10
Nishizawa S, Benkelfat C, Young SN, Leyton M, Mzengeza S, de Montigny C, et al. Differences
between males and females in rates of serotonin synthesis in human brain. Proc Natl Acad Sci USA
1997;94:5308-13.
Bano S, Akhter S, Afridi MI. Gender based response to fluoxetine hydrochloride medication in endogenous
depression. J Coll Physicians Surg Pak 2004;14:161-5.
11
Bell C, Abrams J, Nutt D. Tryptophan depletion and its implications for psychiatry. Br J Psychiatry
2001;178:399-405.
12
Goadsby PJ, Lipton RB, Ferrari MD. Migraine – current understanding and treatment. N Engl J Med
2002;346:257-70.
13
Ferrari MD, Roon KI, Lipton RB, Goadsby PJ. Oral triptans (serotonin 5-HT(1B/1D) agonists) in acute
migraine treatment: a meta-analysis of 53 trials. Lancet 2001;358:1668-75.
14
Jhee SS, Shiovitz T, Crawford AW, Cutler NR. Pharmacokinetics and pharmacodynamics of the triptan
antimigraine agents: a comparative review. Clin Pharmacokinet 2001;40:189-205.
15
Dodick DW, Martin V. Triptans and CNS side-effects: pharmacokinetic and metabolic mechanisms.
Cephalalgia 2004;24:417-24.
16
Dixon CM, Saynor DA, Andrew PD, Oxford J, Bradbury A, Tarbit MH. Disposition of sumatriptan in
laboratory animals and humans. Drug Metab Dispos 1993;21:761-9.
17
30
Neurone serotoninergico: serotonina ed emicrania
18
Dixon R, Warrander A. The clinical pharmacokinetics of zolmitriptan. Cephalalgia 1997;17(Suppl.
18):15-20.
Lacey LF, Hussey EK, Fowler PA. Single dose pharmacokinetics of sumatriptan in healthy volunteers. Eur J
Clin Pharmacol 1995;47:543-8.
19
Salva M, Jansat JM, Martinez-Tobed A, Palacios JM. Identification of the human liver enzymes involved in
the metabolism of the antimigraine agent almotriptan. Drug Metab Dispos 2003;31:404-11.
20
Buchan P, Wade A, Ward C, Oliver SD, Stewart AJ, Freestone S. Frovatriptan: a review of drug-drug
interactions. Headache 2002;42(Suppl. 2):S63-73.
21
Tepper S, Allen C, Sanders D, Greene A, Boccuzzi S. Coprescription of triptans with potentially interacting
medications: a cohort study involving 240,268 patients. Headache 2003;43:44-8.
22
Evans DC, O’Connor D, Lake BG, Evers R, Allen C, Hargreaves R. Eletriptan metabolism by human hepatic
CYP450 enzymes and transport by human P-glycoprotein. Drug Metab Dispos 2003;31:861-9.
23
Cummins CL, Jacobsen W, Benet LZ. Unmasking the dynamic interplay between intestinal P-glycoprotein
and CYP3A4. J Pharmacol Exp Ther 2002;300:1036-45.
24
Wandel C, Kim RB, Kajiji S, Guengerich P, Wilkinson GR, Wood AJ. P-glycoprotein and cytochrome P-450
3A inhibition: dissociation of inhibitory potencies. Cancer Res 1999;59:3944-8.
25
Dresser GK, Schwarz UI, Wilkinson GR, Kim RB. Coordinate induction of both cytochrome P4503A and
MDR1 by St John’s wort in healthy subjects. Clin Pharmacol Ther 2003;73:41-50.
26
27
Sweetman S, ed. Martindale. The complete drug reference. London-Chicago: Pharmaceutical Press
2005.
Buchan P, Keywood C, Wade A, Ward C. Clinical pharmacokinetics of frovatriptan. Headache
2002;42(Suppl. 2):S54-62.
28
Gallagher RM, Cutrer FM. Migraine: diagnosis, management, and new treatment options. Am J Manag
Care 2002;8:S58-73.
29
Fowler PA, Lacey LF, Thomas M, Keene ON, Tanner RJ, Baber NS. The clinical pharmacology,
pharmacokinetics and metabolism of sumatriptan. Eur Neurol 1991;31:291-4.
30
31
Dechant KL, Clissold SP. Sumatriptan. A review of its pharmacodynamic and pharmacokinetic
properties, and therapeutic efficacy in the acute treatment of migraine and cluster headache. Drugs
1992;43:776-98.
Scott AK. Sumatriptan clinical pharmacokinetics. Clin Pharmacokinet 1994;27:337-44.
32
Dixon CM, Park GR, Tarbit MH. Characterization of the enzyme responsible for the metabolism of
sumatriptan in human liver. Biochem Pharmacol 1994;47:1253-7.
33
Bailie G, Johnson C, Mason N, Peter W. Triptans for migraine teatment: dosing considerations in CKD.
MEDfacts 2002;4:2.
34
Boyer EW, Shannon M. The serotonin syndrome. N Engl J Med 2005;352:1112-20.
35
31
Capitolo 3
TERAPIA DELL’EMICRANIA
G.B. Allais, I. Castagnoli Gabellari, C. Benedetto
Introduzione
Un trattamento efficace dell’emicrania richiede, come prima tappa, una corretta diagnosi di
cefalea primaria ottenuta mediante l’accurata raccolta della storia clinica, la negatività dell’esame obiettivo generale e neurologico, nonché l’esclusione di patologie focali o sistemiche
potenzialmente responsabili di cefalee secondarie.
Prima di intraprendere qualsiasi terapia è inoltre necessario individuare eventuali fattori scatenanti/favorenti l’attacco e, ove possibile, eliminarli. Il modo più adeguato per l’identificazione
di questi stimoli è rappresentato dalla compilazione della carta diario della cefalea, che può
risultare utile anche per il monitoraggio clinico degli attacchi. Infine è importante cercare di
individuare patologie concomitanti e/o comorbidità, in base alle quali si può indirizzare più
specificamente la terapia.
Classicamente la terapia dell’emicrania viene suddivisa in sintomatica e preventiva. La terapia
sintomatica ha lo scopo di bloccare la crisi o, una volta che questa sia iniziata, quantomeno
diminuirne l’intensità e i fenomeni di accompagnamento; la terapia di profilassi si prefigge
invece fondamentalmente di ridurre in primis la frequenza degli attacchi, avendo poi come
obiettivi secondari la diminuzione di durata e intensità degli stessi, nonché della sintomatologia di accompagnamento e dell’assunzione di analgesici.
In questo capitolo verrà presa in considerazione nei particolari la gestione dell’attacco acuto
con la terapia sintomatica, mentre solo brevi cenni saranno fatti a proposito della terapia di
profilassi.
Terapia sintomatica
Nel prescrivere un farmaco antiemicranico di natura sintomatica si dovrebbe sempre tener
conto di una serie di criteri:
✘ utilizzo di un solo principio attivo;
✘ assunzione del farmaco il più presto possibile, a dosaggio adeguato e con unica somministrazione;
✘ ricorso alla via parenterale, intramuscolare o rettale in presenza di vomito;
33
interazioni farmacologiche nel trattamento dell’emicrania
✘ adozione di misure complementari: riposo, buio, impacchi freddi nella zona dolente, ecc.;
✘ monitoraggio della risposta al farmaco con diario;
✘ monitoraggio della frequenza di assunzione farmaci sintomatici, per evitare il rischio di
abuso.
Antiemicranici specifici
Sono costituiti dagli agonisti selettivi dei recettori 5-HT1B/1D o triptani e dagli ergot-derivati.
Posologia e dosi massime dei triptani sono indicate in Tabella I.
Triptani
Sono i farmaci di prima scelta nel trattamento degli attacchi emicranici.
Rispetto agli ergot-derivati posseggono numerosi vantaggi tra cui un meccanismo d’azione
selettivo, già ampiamente descritto nel capitolo precedente, farmacocinetica semplice e
costante, effetti collaterali moderati e ottimi livelli di sicurezza. I soli svantaggi imputabili a
questa classe di farmaci sono il costo elevato e la restrizione d’uso in presenza di patologia
vascolare ischemica e ipertensione arteriosa non controllata.
Il capostipite di questa categoria di farmaci è il sumatriptan, disponibile in numerose formulazioni – orale, rettale, spray nasale e sottocutanea (Tab. I) – che permettono la scelta della
via di somministrazione più adeguata in base alle caratteristiche dell’attacco.
I triptani di seconda generazione sono:
✘ rizatriptan 10 mg in compresse e in wafer liofilizzato a dissoluzione rapida (RPD), con
assorbimento comunque gastrico e parametri di farmacocinetica e farmacodinamica
sovrapponibili alla compressa standard; la posologia da 5 mg è quella consigliata nei
pazienti in trattamento concomitante con propranololo o con insufficienza epatica o
renale 1 2;
✘ zolmitriptan: disponibile nelle formulazioni in compresse tradizionali e a rapido dissolvimento sulla lingua (rapimelt) da 2,5 mg 3;
✘ eletriptan, disponibile nella formulazione in compresse ai dosaggi di 20 e 40 mg 4;
✘ almotriptan, disponibile in compresse da 12,5 mg;
✘ frovatriptan 2,5 mg, rispetto agli altri triptani ha un’emivita molto più lunga (> 25 ore), il
che lo renderebbe particolarmente adatto nei casi di ricorrenze frequenti del dolore 5.
Esiste infine il naratriptan 2,5 mg, attualmente non commercializzato in Italia.
È da sottolineare che la mancata risposta clinica ad un dato triptano non implica il fallimento di tutta la classe nel singolo paziente; è opportuno, pertanto, scegliere un farmaco diverso nella stessa classe oppure una diversa modalità di somministrazione, qualora la risposta
clinica non fosse soddisfacente.
34
Terapia dell’emicrania
Tabella I
Posologia e dosi dei triptani: formulazioni presenti in Italia e all’estero *
Triptano
Posologia
almotriptan
12,5 mg os (max 25 mg/24 ore)
eletriptan
20-40-80 * mg os (max 80 mg/24 ore)
frovatriptan
2,5 mg os
naratriptan
2,5 * mg os (max 5 mg/24 ore)
rizatriptan
10 mg os, RPD (max 20 mg/24 ore)
5 mg se associato a propranololo
sumatriptan
6 mg sc (max 12 mg/24 ore)
50-100 mg os (max 300 mg/24 ore)
25 mg rettale (max 50 mg/24 ore)
20 mg spray nasale (max 40 mg/24 ore)
zolmitriptan
2,5 mg os, rapimelt (max 5 mg/24 ore)
5 * mg spray nasale (max 10 mg/24 ore)
* Le dosi massime assumibili nelle 24 ore riportate in tabella si riferiscono ai foglietti illustrativi presenti nel nostro paese e non
sempre coincidono con le indicazioni fornite in altri paesi.
Studi di efficacia clinica
Gli studi di efficacia riguardano il confronto con il placebo o con un principio attivo e, nel
caso dei triptani di nuova generazione, il confronto con il sumatriptan, capostipite della classe
farmaceutica.
Generalmente la misura primaria di efficacia, utilizzata nella maggior parte dei trial clinici condotti sui triptani, è stata il criterio del sollievo dal dolore a 2 ore dalla somministrazione del farmaco, inteso come riduzione dell’intensità del dolore da grave o moderato, a lieve o assente.
Tra gli endpoint secondari sono stati spesso utilizzati il sollievo dal dolore a mezz’ora, 1 ora e 4
ore dalla somministrazione del farmaco; la percentuale di pazienti liberi dal dolore a 2 ore; la
continua libertà dal dolore, intesa come percentuale di attacchi emicranici che si sono risolti
entro 2 ore dall’assunzione del farmaco, senza assunzione di un farmaco di salvataggio (rescue
medication) e in assenza di ricorrenza della cefalea entro 24 ore dalla somministrazione del
farmaco; la percentuale di ricorrenza della cefalea; l’uso di farmaci di salvataggio dopo 2 ore
o più dall’assunzione del farmaco in esame; l’effetto sui sintomi di accompagnamento, sulla
disabilità e sulla qualità della vita del paziente. In realtà attualmente il parametro primario di
efficacia suggerito dalla IHS 6 è la libertà dal dolore a 2 ore. Per una definizione dettagliata
degli endopoints si veda la Tabella II.
35
interazioni farmacologiche nel trattamento dell’emicrania
Tabella II
Principali misure di efficacia utilizzate nei trials clinici sui triptani
Endpoint
Definizione
Sollievo dal dolore
(pain relief)
Riduzione dell’intensità del dolore da grave/moderato a lieve/assente
a 2 ore dall’assunzione del farmaco, senza uso di farmaci di soccorso
Scomparsa del dolore
(pain-free)
Libertà dal dolore entro 2 ore dall’assunzione del farmaco, senza uso di
farmaci di soccorso
Recidiva della cefalea
(headache recurrence)
Libertà dal dolore entro 2 ore dall’assunzione del farmaco, ma ricomparsa
di recidiva di cefalea nelle successive 22 ore
Continua libertà dal dolore
(sustained pain-free)
Libertà dal dolore dopo 2 ore dall’assunzione del farmaco, senza uso di
farmaci di soccorso e senza recidive nelle 22 h successive
Per quanto concerne l’utilizzo dei triptani nel trattamento acuto dell’emicrania, numerose
review e meta-analisi ne sostengono l’efficacia come farmaci di prima scelta.
I risultati di una meta-analisi su 53 studi clinici controllati 7 dimostrano che sumatriptan 100
mg è in grado di produrre un sollievo dal dolore a 2 ore nel 59% dei casi, una scomparsa
del dolore a 2 ore nel 29% dei casi, una recidiva nelle 24 ore nel 30% e una libertà continua
dal dolore per 24 ore nel 20% dei casi. Considerando l’endpoint primario valutato (sollievo
dal dolore a 2 ore), rizatriptan 10 mg ed eletriptan 80 mg sono risultati superiori rispetto al
sumatriptan 100 mg; zolmitriptan 2,5 mg e 5 mg, eletriptan 40 mg e rizatriptan 5 mg hanno
mostrato efficacia simile a sumatriptan 100 mg, mentre naratriptan 2,5 mg, eletriptan 40
mg e frovatriptan 2,5 mg sono risultati inferiori. Per quanto riguarda il raggiungimento della
libertà dal dolore a 2 ore, rispetto a sumatriptan 100 mg, naratriptan 2,5 mg si è dimostrato
essere il meno efficace, mentre eletriptan 80 mg, almotriptan 12,5 mg e rizatriptan 10 mg
hanno dimostrato efficacia superiore (Fig. 1). I tassi di ricorrenza della cefalea nelle 24 ore
rispetto a sumatriptan 100 mg (30%) sono minori per eletriptan 40 mg (22%) e 80 mg (20%),
e superiori per rizatriptan 10 mg (37%). La capacità di garantire continua libertà dal dolore è superiore per rizatriptan 10 mg (26%), eletriptan 80 mg (25%) e almotriptan 12,5 mg
(27%) rispetto a sumatriptan 100 mg (20%). Sulla base della combinazione dei dati, gli autori
concludono che rizatriptan 10 mg, eletriptan 80 mg e almotriptan 12,5 mg determinano la
probabilità più elevata di successo terapeutico costante.
In generale, i triptani hanno mostrato una maggiore efficacia quando assunti in fase iniziale dell’attacco 8. Parrebbe decisamente importante che la somministrazione di un triptano
orale avvenga il più rapidamente possibile rispetto al momento di insorgenza della crisi.
Le percentuali di risoluzione dell’attacco sarebbero infatti decisamente superiori quando
l’assunzione del triptano avvenga nella fase di dolore lieve rispetto a quando l’assunzione
è più tardiva 9. Ciò sarebbe legato ad un fenomeno di allodinia che tipicamente si instaura
col proseguire della crisi emicranica. Per altro è anche importante notare che l’assunzione
precoce di un triptano può essere consigliata senza remore solo a pazienti con bassa nume36
Terapia dell’emicrania
A
Con sottrazione del placebo
0
Sumatriptan
B
Risultati a 2 ore
25 mg
50 mg
20
40
Assoluta (%)
60
80
25 mg
Sumatriptan
100 mg
Zolmitriptan
2,5 mg
5 mg
Naratriptan
2,5 mg
Rizatriptan
5 mg
10 mg
Zolmitriptan
Rizatriptan
20 mg
40 mg
80 mg
Frovatriptan
2,5 mg
2,5 mg
5 mg
2,5 mg
5 mg
10 mg
20 mg
Eletriptan
Almotriptan 12,5 mg
50 mg
100 mg
Naratriptan
Eletriptan
Assenza di dolore a 2 ore
Con sottrazione del placebo Assoluta (%)
0
10
20
30
40
50
40 mg
80 mg
Almotriptan 12,5 mg
Figura 1
Risultati di efficacia, assoluta e con sottrazione di placebo, dei vari triptani a 2 ore dall’assunzione (Ferrari
et al., 2001 7).
A: tasso di risposta al dolore; B: tasso di libertà dal dolore.
Per ogni triptano sono indicati i valori medi e l’intervallo di confidenza al 95%. Le aree in grigio rappresentano l’intervallo di confidenza al 95% per il sumatriptan 100 mg.
rosità mensile di crisi, mentre deve essere tenuta una cautela decisamente maggiore con
questo comportamento prescrittivo in caso di alte frequenze mensili di attacchi, a causa del
rischio di abuso 10.
Da una review degli studi comparativi sui triptani vs le altre classi di sintomatici attivi 11 risulta
che, rispetto all’ergotamina, i triptani mostrano una superiorità in efficacia, senza differenze
significative nella percentuale di eventi avversi, mentre rispetto ai farmaci antiinfiammatori
non steroidei (FANS) mostrano “complessivamente” una comparabilità sia in efficacia che in
percentuale di eventi avversi. Tuttavia, a commento di tali risultati, gli Autori hanno tenuto
a sottolineare che in realtà la pratica clinica degli esperti in cefalee suggerisce la superiorità
dei triptani rispetto ai FANS nel trattamento acuto dei pazienti emicranici.
Ergot-derivati
L’uso dei derivati dell’ergot deve essere limitato a crisi gravi e di bassa frequenza, nel caso in
cui non siano efficaci i triptani o i FANS.
37
interazioni farmacologiche nel trattamento dell’emicrania
I loro molteplici effetti farmacologici rendono difficoltoso il riconoscimento di un preciso
meccanismo d’azione, che sembrerebbe tuttavia essere costituito da una vasocostrizione dei
vasi cefalici e da un blocco della permeabilità indotta dai neuro-peptidi rilasciati dalle fibre
trigeminali stimolate.
All’interno di questa famiglia l’ergotamina, associata alla caffeina, è il farmaco più datato, ma anche
più utilizzato. La diidroergotamina, isolata successivamente, non è disponibile in Italia in formulazioni atte al trattamento dell’attacco acuto di emicrania. È importante ricordare che i derivati
dell’ergotamina non devono essere assolutamente somministrati in contemporanea ai triptani.
Efficacia clinica
La revisione di studi clinici concernenti farmaci a base di ergot-derivati, evidenzia la mancanza di parametri omogenei e la difficoltà di interpretazione degli stessi. L’ergotamina per via
orale ha dimostrato un’efficacia antiemicranica che oscilla dal 36% al 70%, risultando talora
migliore e altre volte uguale al placebo, ma sempre inferiore rispetto ai triptani 12. Al contrario
l’ergotamina rettale ha presentato un’efficacia maggiore vs. sumatriptan rettale (73% vs 63%
sollievo dal dolore) 13. La formulazione intranasale di diidroergotamina si è dimostrata comunque efficace, ma in misura minore rispetto al sumatriptan spray 13. Anche la formulazione
sottocutanea di diidroergotamina ha mostrato una minor efficacia vs sumatriptan sottocute
nel conferimento di sollievo a 2 e 4 ore; tuttavia il tasso di ricorrenza nelle 24 ore è risultato
inferiore per la diidroergotamina rispetto al triptano (17,7% vs 45%) 14.
Tollerabilità
L’uso frequente di ergot-derivati può causare una cefalea da rimbalzo al momento della sospensione e una cronicizzazione della cefalea stessa. Tra gli effetti collaterali di più frequente
riscontro compaiono principalmente la nausea e il vomito, più raramente si possono verificare
diarrea e dolori addominali, parestesie e/o crampi agli arti inferiori. Con il termine “ergotismo”
si intende la comparsa di acrocianosi, ulcere distali, neuropatie ischemiche, fibrosi pericardiaca, pleurica o retoperitoneale dovute ad una assunzione cronica del farmaco.
Antiemicranici non specifici
Comprendono principalmente i FANS, il paracetamolo e gli antiemetici.
Antinfiammatori non steroidei e paracetamolo
In epoca precedente l’avvento dei triptani costituivano i farmaci di prima scelta nel trattamento sintomatico dell’emicrania di intensità lieve o moderata. Attualmente il loro utilizzo
viene preferibilmente riservato alle crisi di intensità lieve, in caso di controindicazioni all’uso
dei triptani, o in caso di recidiva dopo assunzione di triptani. Requisito fondamentale per la
loro efficacia è la pronta somministrazione all’esordio dell’attacco.
In questa categoria di farmaci l’acido acetilsalicilico (ASA) presenta il maggior numero di studi
controllati che ne dimostrano la superiorità rispetto al placebo; in particolare la formulazione
38
Terapia dell’emicrania
effervescente risulta efficace almeno quanto la combinazione di aspirina più metoclopramide,
ma è associata a minor incidenza di effetti collaterali 15. La lisina acetilsalicilato in associazione a
metoclopramide, ha rivelato un’efficacia superiore a placebo e pari a sumatriptan 100 mg per
os 16. Oltre all’ASA, anche il naprossene sodico 17 e l’ibuprofene 18 si sono dimostrati efficaci nel
ridurre il dolore emicranico. In uno studio comparativo tra ketoprofene 75 e 150 mg e zolmitriptan 2,5 mg, a 2 ore dall’assunzione tutti e tre i farmaci sono risultati più efficaci del placebo
nel raggiungimento del sollievo del dolore, così come nell’ottenimento della libertà dal dolore 19. Esistono diversi studi relativi all’utilizzo di differenti formulazioni di diclofenac: diclofenac
potassico per os o intramuscolo si è rivelato più efficace del placebo, facendo registrare dei
vantaggi rispetto a sumatriptan in termini di rapidità d’azione, efficacia sui sintomi associati
e tollerabilità 20; recentemente la formulazione granulare di diclofenac potassico è risultata di
efficacia superiore non solo rispetto al placebo, ma anche rispetto alla formulazione in compresse 21. Relativamente al paracetamolo non sono disponibili dati univoci sulla sua superiorità
rispetto a placebo. Al contrario, esistono dati a sostegno della sua efficacia in caso di associazione con metoclopramide o con domperidone o nella combinazione paracetamolo, aspirina
e caffeina. In questo ultimo caso la somministrazione in fase precoce del dolore ha mostrato
una efficacia superiore a quella ottenibile con sumatriptan 50 mg 22.
Prodotti di combinazione
L’associazione di indometacina, caffeina e proclorperazina, somministrata per via rettale, costituisce una delle formulazioni più utilizzate in Italia per il trattamento sintomatico dell’emicrania. Nonostante tale combinazione abbia presentato una buona efficacia 23, il suo utilizzo è da
valutare cautamente alla luce sia dell’elevata incidenza di effetti collaterali connesso all’utilizzo
di combinazioni multiple, sia del rischio di abuso del sintomatico con successiva dipendenza
e cronicizzazione della cefalea. Simili avvertenze valgono anche per farmaci contenenti butalbital (la formulazione disponibile in Italia contiene butalbital, propifenazone e caffeina), tanto
più che in letteratura non esistono chiare evidenze di un’efficacia superiore rispetto al placebo
o ad altri sintomatici nel trattamento dell’emicrania 24.
Antiemetici
La nausea e il vomito che accompagnano l’attacco emicranico sono spesso riferiti dai pazienti
come altamente disabilitanti; in aggiunta, la stasi o il rallentamento gastrico che si verificano
durante la crisi possono contribuire a ridurre l’efficacia degli antiemicranici assunti per via
orale. Per questi motivi gli antiemetici sono considerati adiuvanti della terapia sintomatica
dell’attacco emicranico, anche se per alcuni di essi esistono evidenze di una loro efficacia
antiemicranica intrinseca. La metoclopramide per via endovenosa è risultata più efficace del
placebo nella riduzione del dolore emicranico e della nausea, nonché delle eventuali ricadute 25. Pure il domperidone viene utilizzato come coadiuvante, anche se sono scarsi i riferimenti
in letteratura. La sua associazione con paracetamolo ha dimostrato efficacia pari a quella di
sumatriptan 50 mg nella riduzione del dolore, della nausea e del vomito 26.
39
interazioni farmacologiche nel trattamento dell’emicrania
Terapia di profilassi
La profilassi è indicata in tutti i casi in cui la frequenza mensile di attacchi sia maggiore di
2, e i giorni con presenza di cefalea siano più di 4 al mese, o quando, anche in presenza di
un minor numero di crisi, queste abbiano durata di 48-72 ore o più e siano parzialmente
o completamente resistenti alla terapia specifica dell’attacco. Infine, la terapia di profilassi
si rende necessaria quando la terapia dell’attacco non sia soddisfacente per la presenza di
effetti collaterali o di controindicazioni specifiche.
La terapia di profilassi deve essere opportunamente scelta per il singolo paziente, soprattutto
in relazione a patologie concomitanti o alla presenza di sovrappeso, depressione dell’umore o
altre patologie sistemiche (ipertensione arteriosa, diabete, broncopatia cronica, ecc.).
La terapia deve essere mantenuta per almeno 3 mesi, verificandone l’efficacia durante questo periodo di tempo ed evitando sospensioni improvvise.
Vale la pena ricordare che la profilassi può avvalersi, oltre che della terapia farmacologica, anche
di terapie non farmacologiche, ed in particolare dell’agopuntura e del biofeedback (BFB), in pazienti in cui le diverse classi di farmaci siano controindicate o qualora il paziente dimostri scarsa
compliance nei confronti di trattamenti farmacologici, o ancora quando vi siano particolari
condizioni cliniche che controindicano l’utilizzo della profilassi (gravidanza, età pediatrica).
β-bloccanti
Sono rappresentati essenzialmente da propranololo (40-240 mg/die) 27, atenololo (50-100 mg/
die) 28, metoprololo (50-200 mg/die) 28, anche se esistono segnalazioni di efficacia anche per
altri prodotti di questa classe. È opportuno un graduale aumento del dosaggio, così come
una graduale riduzione prima di sospendere tali farmaci. La bradicardia, che rappresenta un
effetto diretto dei β-bloccanti, può essere un effetto collaterale contenuto e non costituire
una limitazione se si segue l’accorgimento di aumentare gradualmente la posologia fino a
raggiungere il dosaggio desiderato. Fra gli effetti collaterali sono da ricordare anche l’astenia,
la stipsi e l’ipotensione. Quest’ultima può causare un ostacolo soprattutto nei mesi estivi, in
donne emicraniche che siano costituzionalmente ipotese. Controindicazioni ai β-bloccanti
sono rappresentate da diabete, broncopatia cronica e asma. In pazienti con depressione dell’umore tali farmaci possono indurre un peggioramento della sintomatologia, mentre un’ipertensione arteriosa coesistente può trarre beneficio da tale trattamento. Non vanno mai associati al verapamil.
Calcio-antagonisti
Tra i calcio-antagonisti, la flunarizina rappresenta forse il farmaco di maggiore diffusione per
la profilassi dell’emicrania nell’Europa del Sud. Nonostante il suo impiego sia stato per molto
tempo limitato a causa degli effetti collaterali, caratterizzati da sonnolenza, aumento di peso,
sindromi parkinsoniane, sindromi depressive e aumento dei livelli di prolattina, l’utilizzo di
bassi dosaggi (10 mg/die non danno vantaggio significativo rispetto a 5 mg/die) e di schemi
40
Terapia dell’emicrania
ridotti di trattamento (a giorni alterni, 5 giorni alla settimana, 20 giorni al mese, ecc.) rende tale
farmaco estremamente efficace e ben tollerato, al pari del propranololo 29. Il verapamil (120360 mg/die) risulta essere meno efficace della flunarizina ma può essere preso in considerazione quando le caratteristiche del paziente limitino fortemente l’utilizzo della stessa. Infine
può essere utile la cinnarizina a 150-200 mg/die.
Inibitori dell’angiotensina
Recentemente è stata dimostrata l’efficacia di lisinopril, un ACE-inibitore, alla dose di 20 mg/
die, nel ridurre frequenza e intensità degli attacchi emicranici. Gli effetti collaterali riportati
sono tosse, ipotensione, astenia 30. Dati positivi nel trattamento preventivo, sono stati riportati
anche per candesartan, un bloccante recettoriale dell’angiotensina II, alla dose di 16 mg/die 31.
È comunque opportuno segnalare che l’utilizzo di questi prodotti per la profilassi dell’emicrania è al momento off label.
Antidepressivi triciclici e inibitori selettivi della ricaptazione della serotonina
Sono indicati in presenza di ansia e/o depressione, anche in considerazione del fatto che questi disturbi possono rappresentare fattori di peggioramento della sindrome emicranica. Tra
gli antidepressivi triciclici, l’amitriptilina è in pratica l’unico farmaco tuttora in uso. Si è rivelata
efficace nel trattamento dell’emicrania, specialmente in casi associati a cefalea tensiva 32. Il
suo meccanismo d’azione antidolorifico non è correlato all’effetto antidepressivo e consiste in
una modulazione centrale di diversi neurotrasmettitori, inibendo il re-uptake di serotonina e
noradrenalina e attenuando le risposte β-adrenergiche. La dose iniziale di farmaco è di 5 mg
la sera con incremento progressivo di pochi mg ogni settimana fino a raggiungere almeno la
dose di 30 mg/die; solitamente, infatti, i dosaggi più elevati utilizzati per il trattamento delle
sindromi depressive non sono utili nella profilassi dell’emicrania. Oltre ai noti effetti collaterali
antimuscarinici (secchezza delle fauci e sedazione), può provocare aumento di peso e di appetito, ipotensione ortostatica, cardiotossicità e disfunzioni sessuali.
Per quanto concerne gli SSRI, anche se mostrano minori effetti collaterali rispetto agli antidepressivi triciclici, essi risulterebbero superiori al placebo solo nel caso della cefalea di tipo
tensivo, ma non dell’emicrania 33.
Derivati della segale cornuta
Numerosi studi controllati e la stessa esperienza clinica mostrano risultati soddisfacenti con
l’uso di farmaci che agiscono a livello del sistema serotoninergico.
Gli ergot-alcaloidi ed i loro derivati sono tra le prime sostanze riconosciute svolgere un’attività antagonista a livello dei recettori della serotonina, in particolare la diidroergotamina nella
formulazione a liberazione programmata (con un’emivita di 12 ore), presente in commercio in
Italia dai primi anni Ottanta. Tra tutti gli antagonisti serotoninergici il pizotifene (dose: 1-2 mg/
die) è il più utilizzato, sia perché di efficacia superiore, sia perchè presenta minor incidenza
41
interazioni farmacologiche nel trattamento dell’emicrania
e gravità di eventuali effetti collaterali (sono comunque spesso presenti aumento di peso e
astenia) 34. Anche la metisergide è un farmaco rivelatosi estremamente efficace alla dose di 6
mg/die, ma con un importante deterrente al suo uso prolungato, rappresentato dallo sviluppo di fibrosi retroperitoneale, polmonare ed endocardica, nonostante tale evento si verifichi
con estrema rarità (1/2500 soggetti). Dal marzo 1999 non è più in commercio in Italia, è tuttora
in commercio in alcuni paesi esteri.
Antiepilettici neuromodulatori
Il valproato di sodio si è rivelato efficace nella profilassi degli attacchi emicranici, come dimostrato ormai da studi clinici randomizzati e controllati 35. Il dosaggio consigliato è di 500-1000
mg/die, anche se è stato utilizzato in dosi superiori, fino a 2000 mg/die. Gli effetti collaterali
comprendono nausea, vomito, alopecia, tremori, sedazione, aumento di peso. Durante il trattamento bisogna monitorare i parametri pancreatici ed epatici per la tossicità segnalata. È
inoltre opportuno effettuare, in caso di periodi di trattamento prolungati, un’ecografia ovarica
per la possibile associazione descritta fra acido valproico e ovaio policistico.
Fra gli antiepilettici, anche il topiramato ha mostrato una buona efficacia, alla dose media di
100 mg/die, aumentabile fino ad un massimo di 200 mg/die, anche se con maggiori problemi
di tollerabilità 36. Per minimizzare gli effetti collaterali è opportuno titolare lentamente il farmaco, con dosi crescenti di 25 mg alla settimana. Il trattamento deve essere effettuato per almeno 3 mesi, anche se spesso, nella pratica clinica, si protrae per diversi mesi. La sospensione del
trattamento deve essere molto graduale. È particolarmente indicato in pazienti sovrappeso
o che presentino controindicazioni per altri farmaci di profilassi. I principali effetti collaterali
sono costituiti da parestesie, sedazione, riduzione dell’attenzione e della concentrazione, diminuzione dell’appetito e calo ponderale, depressione.
Bibliografia
Goldberg MR, Sciberras D, De Smet M, Lowry R, Tomasko L, Lee Y, et al. Influence of β-adrenoceptor
antagonists on the pharmacokinetics of rizatriptan, a 5-HT 1B/1D agonist: differential effects of propranolol,
nadolol and metoprolol. Br J Clin Pharmacol 2001;52:69-76.
1
Lainez MJ, Evers S, Kinge E, Allais G, Allen C, Rao NA, et al. Preference for rizatriptan 10-mg wafer vs.
eletriptan 40-mg tablet for acute treatment of migraine. Cephalalgia 2006;26:246-56.
2
Rapoport AM, Bigal ME, Tepper SJ, Sheftell FD. Zolmitriptan (Zomig). Expert Rev Neurother
2004;4:33-41.
3
McCormack PL, Keating GM. Spotlight on eletriptan in migraine. CNS Drugs 2006;20:961-4.
4
Balbisi EA. Frovatriptan succinate, a 5-HT 1B/1D receptor agonist for migraine. Int J Clin Pract
2004;58:695-705.
5
International Headache Society Clinical Trial Subcommittee. Guidelines for Controlled Trials of Drugs in
Migraine. Second edition. Cephalalgia 2000;20:765-86.
6
Ferrari MD, Roon KI, Lipton RB, Goadsby PJ. Oral triptans (serotonin 5-HT (1B/1D) agonists) in acute migraine
treatment: a meta-analysis of 53 trials. Lancet 2001;358:1668-75.
7
42
Terapia dell’emicrania
Dowson AJ, Mathew NT, Pascual J. Review of clinical trials using early acute intervention with oral triptans
for migraine management. Int J Clin Pract 2006;60:698-706.
8
Burstein R, Collins B, Jakubowski M. Defeating migraine pain with triptans: a race against the development
of cutaneous allodynia. Ann Neurol 2004;55:19-26.
9
Moschiano F, D’Amico D, Allais G, Rigamonti A, Melzi P, Schieroni F, et al. Early triptan intervention in
migraine: an overview. Neurol Sci 2005;26(Suppl. 2):S108-10.
10
Lipton LRB, Bigal ME, Goadsby PJ. Double-blind clinical trials of oral triptans vs other classes of acute
migraine medication – a review. Cephalalgia 2004;24:321-32.
11
Dahlof C. Placebo-controlled clinical trials with ergotamine in the acute treatment of migraine. Cephalalgia
1993;13:166-71.
12
Bigal ME, Tepper SJ. Ergotamine and dihydroergotamine: a review. Curr Pain Headache Rep 2003;7:5562.
13
Winner P, Ricalde O, Le Force B, Saper J, Margul B. A double-blind study of subcutaneous dihydroergotamine
vs subcutaneous sumatriptan in the treatment of acute migraine. Arch Neurol 1996;53:180-4.
14
Diener HC, Lampl C, Reimnitz P, Voelker M. Aspirin in the treatment of acute migraine attacks. Expert Rev
Neurother 2006;6:563-73.
15
Tfelt-Hansen P. The effectiveness of combined oral lysine acetylsalicylate and metoclopramide (Migpriv)
in the treatment of migraine attacks. Comparison with placebo and oral sumatriptan. Funct Neurol
2000;15(Suppl. 3):196-201.
16
Nestvold K, Kloster R, Partinen M, Sulkava R. Treatment of acute migraine attack: naproxen and placebo
compared. Cephalalgia 1985;5:115-9.
17
Sandrini G, Franchini S, Lanfranchi S, Granella F, Manzoni GC, Nappi G. Effectiveness of ibuprofenarginine in the treatment of acute migraine attacks. Int Clin Pharmacol Res 1998;18:145-50.
18
Dib M, Massiou H, Weber M, Henry P, Garcia-Acosta S, Bousser MG, et al. Efficacy of oral ketoprofen in
acute migraine: a double-blind randomized clinical trial. Neurology 2002;58:1660-5.
19
The diclofenac-K/Sumatriptan Migraine Study Group. Acute treatment of migraine attacks: efficacy and
safety of a nonsteroidal anti-inflammatory drug, diclofenac-potassium, in comparison to oral sumatriptan
and placebo. Cephalalgia 1999;19:232-40.
20
Diener HC, Montagna P, Gacs G, Lyczak P, Schumann G, Zoller B, et al. Efficacy and tolerability of
diclofenac potassium sachets in migraine: a randomized, double-blind, cross-over study in comparison
with diclofenac potassium tablet and placebo. Cephalalgia 2006;26:537-47.
21
Goldstein J, Silberstein SD, Saper JR, Elkind AH, Smith TR, Gallagher RM, et al. Acetaminophen, aspirin,
and caffeine versus sumatriptan succinate in the early treatment of migraine: results from the ASSET trial.
Headache 2005;45:973-82.
22
Di Monda V, Nicolodi M, Aloisio A, Del Bianco P, Fonzari M, Grazioli I, et al. Efficacy of a fixed combination
of indomethacin, prochlorperzazine, and caffeine versus sumatriptan in acute treatment of multiple
migraine attacks: a multicenter, randomized, crossover trial. Headache 2003;43:835-44.
23
Wenzel RG, Sarvis CA. Do butalbital-containing products have a role in the management of migraine?
Pharmacotherapy 2002;22:1029-35.
24
Colman I, Brown MD, Innes GD, Grafstein E, Roberts TE, Rowe BH. Parenteral metoclopramide for acute
migraine: meta-analysis of randomized controlled trials. BMJ 2004;329:1369-73.
25
Dowson A, Ball K, Haworth D. Comparison of a fixed combination of domperidone and paracetamol
(Domperamol) with sumatriptan 50 mg in moderate to severe migraine: a randomised UK primary care
study. Curr Med Res Opin 2000;16:190-7.
26
43
interazioni farmacologiche nel trattamento dell’emicrania
Linde K, Rossnagel K. Propranolol for migraine prophylaxis. Cochrane Database Syst Rev 2004;2:
CD003225.
27
Andersson KE, Vinge E. Β-adrenoceptor blokers and calcium antagonists in the prophylaxis and treatment
of migraine. Drug 1990;39:355-73.
28
Diener HC, Matias-Guiu J, Hartung E, Pfaffenrsth V, Ludin HP, Nappi G, et al. Efficacy and tolerability
in migraine prophylaxis of flunarizine in reduced doses: a comparison with propranolol 160 mg daily.
Cephalalgia 2002;22:209-21.
29
30
Schrader H, Stovner LJ, Helde G, Sand T, Bovim G. Prophylactic treatment of migraine with
angiotensin converting enzyme inhibitor (lisinopril): randomized, placebo controlled, crossover study.
BMJ 2001;322:19-22.
Tronvik E, Stovner LJ, Helde G, Sand T, Bovim G. Prophylactic treatment of migraine with an angiotensin
II receptor bloker: a randomized controlled trial. JAMA 2003;298:65-9.
31
Colombo B, Annovazzi PO, Comi G. Therapy of primary headaches: the role of antidepressants. Neurol Sci
2004;25(Suppl. 3):S171-5.
32
Moja PL, Cusi C, Sterzi RR, Canepari C. Selective serotonin re-uptake inhibitors (SSRIs) for preventing
migraine and tension-type headaches. Cochrane Database Syst Rev 2005;3:CD002919.
33
Mylecharane EJ. 5-HT2 receptor antagonists and migraine therapy. J Neurol 1991;238(Suppl. 1):S45-52.
34
Freitag FG. Divalproex in treatment of migraine. Psychopharmacol Bull 2003;37(Suppl. 2):98-115.
35
Wenzel RG, Schwarz K, Padiyara RS. Topiramate for migraine prevention. Pharmacotherapy
2006;26:375-87.
36
44
Capitolo 4
INTERAZIONI TRA I TRIPTANI
ED ALTRI FARMACI, CIBI
E RIMEDI BOTANICI
F. Franconi, S. Canu
Generalità
Nella pratica clinica, talvolta, per arrivare al successo terapeutico o per il trattamento di malattie concomitanti è necessario l’uso contemporaneo di più farmaci. In corso di politerapia,
tuttavia, si può andare incontro ad interazioni che possono modificare la risposta dei singoli
medicamenti. In effetti alcune producono un aumento di efficacia del trattamento, come nel
caso della terapia dell’ipertensione, delle neoplasie (dove la politerapia può ridurre l’insorgenza di cellule resistenti ai chemioterapici), della terapia dell’HIV/AIDS (dove la politerapia impedisce lo svilupparsi delle resistenze dei microrganismi) ed un allargamento delle indicazioni.
Altre, invece, possono condurre ad un incremento di tossicità o alla perdita dell’efficacia con il
conseguente fallimento terapeutico. Infine, in alcuni casi, con la co-somministrazione si possono avere effetti completamente nuovi rispetto a quelli visti con i singoli farmaci. Per ridurre
la probabilità di interazioni che determinano effetti collaterali, un’attenzione particolare dovrà
essere dedicata nel caso di uso di farmaci a basso indice terapeutico, dove piccole variazioni
dei livelli ematici possono determinare problemi di sicurezza.
In questo contesto, appare di rilevanza clinica ricordare che, al di là delle interazioni che
avvengono fra medicinali, esistono interazioni meno note e di frequenza sconosciuta che
riguardano farmaco-cibo (fra le più note, inibitori delle monoamino ossidasi (IMAO) e formaggio, IMAO e birra, IMAO e vino rosso), farmaco-bevanda (benzodiazepine-bevande alcoliche), farmaco-rimedi botanici (triptani ed erba di San Giovanni, uno dei dieci rimedi
botanici più venduti nel mondo), farmaco-supplemento (triptani e triptofano), farmacoinquinanti ambientali.
Le interazioni al di fuori dei medicinali etici sono più difficili da prevenire e da diagnosticare,
perché molto spesso l’operatore sanitario non è a conoscenza dell’uso di questi prodotti da
parte del paziente. È bene inoltre tenere presente che la contemporaneità dell’associazione
non è indispensabile per provocare un’interazione poiché questa si può verificare anche
se intercorre un intervallo di tempo tra le somministrazioni e la durata dell’intervallo sarà
funzione delle caratteristiche farmacocinetiche delle singole molecole.
45
interazioni farmacologiche nel trattamento dell’emicrania
Per sottolineare l’importanza delle interazioni ricordiamo che, sebbene la loro esatta frequenza non sia nota, si stima che essa possa andare dal 3-5% nei soggetti che assumono pochi
medicinali, per arrivare al 20% nei soggetti trattati con più di 10 medicinali 1.
Scolasticamente, le interazioni sono suddivise in farmacocinetiche e farmacodinamiche: le
prime sembrano essere più frequenti e di maggior rilevanza clinica e possono interessare tutte le fasi della farmacocinetica (assorbimento, distribuzione, biotrasformazione, eliminazione),
incluso l’effetto di primo passaggio se il farmaco viene somministrato per via orale. Un ruolo
preminente nella pratica clinica è assunto dalle interazioni che trovano la loro origine nella
fase di biotrasformazione. Queste sono molto numerose e possono dar luogo ad una diminuzione o ad un incremento dei livelli ematici del farmaco. Se nel box 1 abbiamo puntualizzato
la nostra attenzione sul sistema del citocromo P450, dobbiamo ricordare che interazioni avvengono anche ad altri livelli, vedi le monoamino-ossidasi e molti altri ancora.
Accanto alle interazioni farmacocinetiche abbiamo quelle farmacodinamiche che possono
essere antagoniste, additive o sinergiche. Le antagoniste sono caratterizzate da una ridotta
risposta. Di fronte ad un aumento della risposta, si parla di interazione additiva, quando due
medicinali con effetti simili danno una risposta pari alla somma degli effetti dei singoli farmaci;
in caso di attività superiore alla somma di quella determinata dalle singole molecole siamo di
fronte ad una interazione sinergica.
Come abbiamo già menzionato, gli eventi avversi sono più frequenti quando si fa uso di politerapia e, come hanno evidenziato Dixon e Warrander nel 1997 2, la pratica dell’automedicazione è molto diffusa (79%) nei pazienti con cefalea 3 4. Infine, nella pratica clinica è sempre
opportuno chiedere ai pazienti se assumano rimedi botanici e supplementi alimentari per
evitare la comparsa di interazioni che possano alterare il profilo della risposta farmacologica.
Come già accennato in precedenza, la cefalea è una malattia ad alta prevalenza femminile e
sono proprio le donne che, dall’età di 12 anni in poi, consumano più farmaci in confronto agli
uomini 5. Infatti, proprio le donne sono le più grandi consumatrici di farmaci etici e non e ciò
riguarda soprattutto gli analgesici, le associazioni estroprogestiniche, i farmaci neuropsicotropici, i rimedi botanici ed i supplementi 6. Inoltre è bene tenere presente che le donne vanno
più facilmente incontro agli effetti collaterali da medicamenti 7, che peraltro non solo sono
più numerosi, ma risultano essere persino più gravi nel genere femminile in confronto ai quelli
osservati nei maschi 8.
Dunque la popolazione femminile necessita di particolare attenzione soprattutto in caso di
politerapia, anche in considerazione del fatto che i farmaci generalmente sono meno studiati
nel genere femminile. Inoltre, anche quando le donne vengono incluse negli studi clinici,
molto spesso non viene fatta l’analisi di genere; soprattutto ancora oggi le donne sono poco
presenti negli studi di Fase 1 e Fase 2.
Al di là delle generalità appena accennate è importante ricordare che, nell’ambito della stessa
giornata, non appare opportuno fare uso di due diversi triptani anche se le singole molecole
hanno un buon margine di tollerabilità se somministrate singolarmente. Per quanto riguarda i
triptani e gli altri farmaci sono state descritte interazioni sia farmacodinamiche che farmacocinetiche. Vale la pena sottolineare che le singole molecole hanno caratteristiche farmacocine46
Interazioni tra i triptani ed altri farmaci, cibi e rimedi botanici
Box 1.
Enzimi citocromo P450 dipendenti (CYP) e metabolismo dei farmaci
Le CYP sono una superfamiglia di enzimi localizzati nelle membrane del reticolo endoplasmico e di altri organuli cellulari. Metabolizzano numerose sostanze endogene (ormoni steroidei, acidi biliari, acidi grassi, acido arachidonico e derivati, ecc) e numerose sostanze esogene, come inquinanti ambientali (idrocarburi policiclici, ecc.), fumo di tabacco, costituenti
della dieta e soprattutto farmaci.
Le CYP più importanti dal punto di vista della farmacoterapia sono la CYP3A4, -2C9, -2C19,
-1A2, e la -2D6. Nel fegato umano la CYP3A4 è quantitativamente la più importante (2530%), seguita dalla CYP2D6 (20%) e dalla CYP1A2 (13%) 9 e metabolizzano circa il 50%, 2025% ed il 10% dei medicamenti, rispettivamente. L’attività di questi enzimi è molto variabile
sia per la presenza di polimorfismi genetici che coinvolgono le CYP2D6, -2C9 e -2C19, sia
per l’influenza dell’età e del sesso. Quest’ultimo influenza l’espressione e l’attività basale di
dette proteine e la loro inducibilità. In particolare la CYP3A4 che, come già detto, metabolizza circa il 50% dei farmaci è maggiormente attiva nelle donne mentre la CYP2D6 è più attiva
negli uomini 10, così come la CYP1A2. Riguardo quest’ultima le differenze di genere evidenziate a proposito del metabolismo di alcuni suoi substrati, come caffeina e paracetamolo,
vengono rimosse dalla terapia estrogenica 10. Per altre CYP (CYP2C9, CYP2C19 e CYP2E1)
non è ancora chiaro se la loro attività sia sesso dipendente 10.
È importante sottolineare che la variabile genere influenza anche l’induzione delle varie
isoforme; brevemente ricordiamo che l’induzione delle CYP avviene attraverso l’attivazione
di fattori di trascrizione (Pregnan X-receptors, CAR, ecc.) che inducono l’espressione del gene
che codifica la specifica CYP. Il risultato è che un composto può indurre il proprio metabolismo e quello di altri composti determinando una diminuzione dei livelli ematici del medicinale con conseguente perdita di efficacia.
Tra le varie isoforme delle CYP sembrano presentare un’induzione genere mediata la CYP3A4
e la CYP1A2. Ad esempio, l’iperforina, presente nell’erba di San Giovanni, induce, attraverso
il pregnan X receptor, l’espressione della CYP3A4 del 90% e del 50% nelle donne e nell’uomo, rispettivamente 10. Mentre la CYP1A2, enzima presente in maggior quantità nell’uomo,
è indotta (20%) dall’iperico solo nelle donne, ma non nell’uomo 10.
Infine, l’espressione delle varie CYP varia in maniera notevole in funzione della dieta perché
alcuni componenti della stessa possono determinare induzione od inibizione enzimatica.
Ad esempio, alcuni componenti del pompelmo (naringina e furanocoumarine) sono potenti
inibitori della CYP3A4 intestinali 11. Anche gli inibitori si diversificano per la selettività verso
le varie isoforme e il loro effetto, al contrario degli induttori, è molto rapido.
In considerazione della complessità del mondo biologico, non meraviglia che le molecole
substrato di un’isoforma possano comportarsi da inibitori competitivi nei confronti di altri
medicinali che presentano affinità verso la stessa isoforma 12, rendendo ancora più difficoltosa la previsione dell’andamento della singola interazione.
47
interazioni farmacologiche nel trattamento dell’emicrania
tiche molto diverse (Tab. II, cap. 2) ed è quindi possibile che, accanto all’interazione di classe,
si possano osservare delle interazioni peculiari per i singoli composti. Nella Tabella I abbiamo
riassunto i principali enzimi che sono coinvolti nel metabolismo dei singoli triptani.
Tabella I
Enzimi coinvolti nel metabolismo dei triptani
Triptano
Metabolismo
Almotriptan
MAO-A, CYP3A4, CYP 2D6
Eletriptan *
CYP3A4
Frovatriptan
CYP1 A 2
Naratriptan
CYP, renale MAO-A
Rizatriptan
MAO-A
Sumatriptan
MAO-A
Zolmitriptan
CYP1A2, MAO-A
* Eletriptan è anche substrato della P-gp, gli enzimi sono segnalati in ordine di importanza.
Interazioni con derivati dell’ergot
I derivati dell’ergot sono un gruppo di composti prodotti da un fungo, la Claviceps purpurea,
parassita delle graminacee, tra cui la segale; fra questi troviamo l’ergotamina e la diidroergotamina che sono utilizzate, fra l’altro, anche per il trattamento della cefalea. I derivati dell’ergot
sono inibitori della CYP3A4 13 e, quindi, posso ridurre il metabolismo dei triptani che sono
substrato di questa isoforma, determinando un maggior rischio di effetti collaterali.
In questo frangente è importante sottolineare che il metabolismo dei derivati dell’ergot può
essere ridotto da inibitori della CYP3A4 ed i soggetti trattati con tali inibitori possono sviluppare una sindrome iatrogena denominata ergotismo 14. Questa possibilità è stata descritta con
l’eletriptan 15 e per evitare il rischio bisogna far intercorrere 24 ore fra le somministrazioni 15.
Fra i derivati della segale cornuta ed i triptani è possibile anche un’interazione di tipo farmacodinamico poiché anch’essi, come i triptani, possono indurre vasocostrizione. Ciò ha portato
alcune agenzie regolatorie a controindicare l’uso contemporaneo dei triptani e dei derivati
dell’ergot.
Triptani ed antidepressivi
Dalla loro introduzione sul mercato alla fine degli anni Ottanta del secolo scorso, il consumo degli SSRI è andato progressivamente aumentando, così come quello degli SNRI.
48
Interazioni tra i triptani ed altri farmaci, cibi e rimedi botanici
Questi farmaci, inizialmente indicati nel trattamento della depressione, negli anni recenti
hanno trovato nuove indicazioni ed una rilevante quota di essi è prescritta dal medico di
medicina interna.
Gli SSRI e gli SNRI, riducendo la ricaptazione della serotonina dallo spazio intersinaptico,
aumentano la disponibilità del neurotrasmettitore e possono così portare ad un’aumentata stimolazione dei recettori 5-HT1A. Tale fenomeno sembra essere alla base della sindrome
serotoninergica, già ampiamente descritta e discussa nel capitolo 2. Gli SSRI e gli SNRI, di
per sé e quando associati ai triptani, possono determinare la sindrome serotoninergica.
Anche se in alcuni casi la sindrome è stata associata alla sola somministrazione del triptano
o dell’antidepressivo, essa sembra presentarsi con maggior frequenza quando gli SSRI e
SNRI sono associati con i triptani. Le interazioni di tipo farmacodinamico fra triptani ed antidepressivi sono plausibili sul piano biologico e quindi non meraviglia che tali associazioni
siano controindicate con tutti i triptani 16. Anche altri antidepressivi, come il trazodone,
possono determinare, con lo stesso meccanismo, da soli o in associazione, la sindrome
serotoninergica.
Anche gli antidepressivi che rallentano il catabolismo della serotonina, come gli IMAO, da
soli o in associazione con i triptani, possono dare sindrome serotoninergica. A questo proposito, occorre ricordare che alcuni triptani, come il sumatriptan, il rizatriptan e lo zolmitriptan, sono metabolizzati dalle MAO-A (Tab. I); ciò rende possibili anche interazioni farmacocinetiche fra triptani ed IMAO poiché la biotrasformazione dei triptani viene ridotta dagli
IMAO con conseguente aumento dei loro livelli. Questo può portare ad una maggiore probabilità d’insorgenza di una sindrome serotoninergica 17. Fra i tre triptani (sumatriptan, rizatriptan e zolmitriptan) ci sono delle differenze . Il sumatriptan viene quasi completamente
metabolizzato (80%) dalle MAO-A epatiche. Lo zolmiptriptan è, invece, metabolizzato dalle
MAO-A e dalla CYP1A2 mentre il suo metabolita attivo, N-desmetil-, è metabolizzato dalle
MAO-A 14. Infine, il rizatriptan, come evidenziato in Sternieri et al. (2006) 14, ha una struttura
che lo rende sufficientemente resistente alle interazioni metaboliche MAO mediate. Queste
differenze potrebbero essere importanti per le potenziali interazioni fra sumatriptan, rizatriptan e zolmitriptan ed IMAO.
A proposito del metabolismo dei triptani mediato dalle CYP dobbiamo tenere conto delle
possibili interazioni farmacocinetiche; ad esempio, nei volontari sani la fluoxetina, debole inibitore della CYP2D6 e della CYP3A4, modifica l’area sotto la curva concentrazione-tempo e
la Cmax dell’almotriptan 18; la massima concentrazione ematica del frovatriptan è, invece, aumentata dalla fluovoxamina 19.
Triptani ed antifecondativi orali
Gli antifecondativi orali sono tra i farmaci più utilizzati nel mondo; soprattutto è alto il consumo
delle associazioni estro-progestiniche. Nell’ambito di questo argomento è interessante notare
che le associazioni estro-progestiniche non solo possono indurre un attacco cefalalgico nelle
donne predisposte ed avere un ruolo diretto nel dare inizio a questa patologia 20 ma, al di là
49
interazioni farmacologiche nel trattamento dell’emicrania
delle relazioni estrogeni-cefalea, qui appare importante notare che gli ormoni sessuali, specialmente gli estrogeni, influenzano l’attività di alcune CYP. Quindi, a questo livello, si possono
avere interazioni tra gli antifecondativi orali ed i medicamenti (vedi box 1). Se da una parte
gli ormoni possono influenzare il metabolismo di altri medicamenti è anche vero il contrario
e cioè che altri farmaci, etici e non, possono modificare il metabolismo degli ormoni; quindi
appare necessario affrontare il problema delle interazioni considerando le singole molecole.
Le interazioni fra triptani e associazioni estro-progestiniche sono prevalentemente farmacocinetiche e riguardano essenzialmente la fase di biotrasformazione, interessando principalmente i triptani che sono metabolizzati dalle CYP. In particolare, le donne che usano antifecondativi orali presentano variazione dei picchi ematici e dell’area sotto la curva (AUC) dello
zolmitriptan, per ambedue i parametri si sono potuti osservare aumenti del 30-50% 21, il che
può portare ad un rischio maggiore di effetti collaterali. Accanto a questi aumenti si osserva,
nelle donne trattate con antifecondativi, un ritardo di 30 minuti nel giungere al picco ematico
rispetto alle donne che non sono trattate con anticoncezionali 21.
Gli anticoncezionali orali aumentano anche la concentrazione ematica del frovatriptan, un
altro triptano metabolizzato dalla CYP1A2 19, quindi si può avere un aumento del rischio di
sviluppare più effetti avversi. Per gli altri triptani non si sono osservate variazioni significative.
Miscellanee
Il ketoconazolo è uno dei più potenti inibitori della CYP3A4. È evidente che l’uso contemporaneo con triptani substrati di questa isoforma può portare a modifiche della farmacocinetica
del triptano. Infatti, con la co-somministrazione dell’eletriptan e del ketoconazolo si ha un
aumento di 2-3 volte della concentrazione ematica del triptano, mentre l’AUC è aumentata di
circa 6 volte 14. Anche inibitori della CYP meno potenti del ketoconazolo, come il fluconazolo,
l’eritromicina, l’itraconazolo, il ritonavir, l’indinavir, il verapamile, il diltiazem, la ciclosporina, il
dalfopristin, la delavirdina, l’imatinib e la quinupristina, influenzano la farmacocinetica dell’eletriptan, sebbene in maniera ridotta rispetto al ketoconazolo 15. Per non andare incontro alle
suddette alterazioni farmacocinetiche è opportuno osservare un intervallo di sicurezza di 72
ore fra le due somministrazioni. Questo intervallo dovrebbe essere rispettato anche con altri
inibitori come la claritromicina, il nefazodone, il ritonovir, la troleandomicina e il nelfinavir. Inoltre, il metabolismo dell’eletriptan è ridotto dall’amiodarone, un altro inibitore della CYP3A4;
anche in questo caso si suggerisce un intervallo di 72 ore dall’ultima somministrazione di
amiodarone prima di procedere all’assunzione dell’eletriptan 15. È evidente che un’interazione
con gli inibitori delle CYP3A4 determina un rischio maggiore di reazioni avverse.
È doveroso evidenziare che il succo di pompelmo è un inibitore della CYP3A4 ed è in grado di
inibire il metabolismo dell’eletriptan; quindi è possibile avere un’interazione farmaco-cibo con
aumenti dei livelli ematici del triptano e tutte le possibili conseguenze 15.
Anche il metabolismo dell’almotriptan è ridotto dagli inibitori della CYP3A4: claritromicina,
eritromicina, itraconazolo, ritonavir, ketoconazolo 22 23.
50
Interazioni tra i triptani ed altri farmaci, cibi e rimedi botanici
Interazioni con il propanololo
Il propanololo, oltre che interagire con i vari sottotipi del recettore β-adrenergico, inibisce le MAO.
Degno di nota è il fatto che tale fenomeno non si realizza con gli altri β-bloccanti 24, pertanto
questo β-bloccante potrà interagire con farmaci che sono substrati di tali enzimi come il rizatriptan e lo zolmitriptan. In caso di contemporanea somministrazione (propanololo e rizatriptan), si
osserva un ridotto catabolismo del triptano, tanto che è consigliabile ridurre del 50% le dosi del
rizatriptan 25. Un altro triptano che interferisce con il propanololo è lo zolmitriptan 26.
Interazioni con la cimetidina
Un altro triptano che in parte viene metabolizzato (50%) da questo enzima è lo zolmiptriptan.
La CYP1A2 ha come substrato anche la cimetidina ed alcuni antibiotici, inclusi i chinolonici;
quindi sono possibili interazioni fra questi ed i triptani metabolizzati da questa isoforma, ad
esempio in caso di co-somministrazione di zolmitriptan e cimetidina è richiesta una riduzione
del dosaggio del 50% 27.
Fumo di sigaretta, caffè ed altro
Il frovatriptan è metabolizzato dalla CYP1A2 che è indotta nei fumatori cronici, nelle persone
che assumono molto caffè, che consumano grandi quantità di cavoli e carne alla griglia con
conseguente accelerato metabolismo del triptano 19. Quindi non meraviglia che nei fumatori il
frovatriptan presenti una ridotta concentrazione ematica ed una ridotta AUC 18. Detto enzima è
inibito del 25% e del 49% dal propanololo e dalla fluvoxamina rispettivamente, con conseguente
aumento della biodisponibità del triptano ed una maggiore possibilità di effetti collaterali 19 28.
Supplementi alimentari
Il triptofano ed il 5-idrossitriptofano sono precursori della serotonina ed il loro uso è stato
proposto per il trattamento di varie patologie, dalla depressione all’insonnia, all’obesità, alla
cefalea 29. La maggiore disponibilità di serotonina in seguito alla loro assunzione può determinare un rischio di sindrome serotoninergica 29, per cui non appare opportuna la co-somministrazione coi triptani o con gli altri principi attivi che possono scatenare la sindrome.
Interazioni triptani-rimedi botanici
L’iperforina, presente nell’erba di San Giovanni o iperico, inibisce il sistema di trasporto delle
monoamine e questo può far sì che il suo uso possa produrre una sindrome serotoninergi51
interazioni farmacologiche nel trattamento dell’emicrania
ca. Tuttavia l’uso di questo rimedio è stato associato con un aumento dell’espressione della
CYP3A4, enzima che metabolizza il 50% dei farmaci, mediante l’attivazione del fattore di trascrizione denominato Pregnan X-receptor 30. Ciò influenza il metabolismo dei farmaci che sono
substrato di questa isoforma. I dati finora disponibili indicano che questo rimedio botanico,
oltre che inibire la CYP3A4, inibisce anche CYP1A2, CYP2C9 e la P-glicoproteina 31.
Viste le precedenti considerazioni non meravigliano i suggerimenti ai medici del Centro di
Salute Mentale che segnalano che l’associazione triptani e SSRI con l’erba di San Giovanni
aumenta il rischio di sindrome serotoninergica e quindi appare opportuno interrompere l’assunzione del rimedio botanico 31, vedi Tabella II.
Tabella II
Alcune medicine che interagiscono con l’erba di San Giovanni
✘✘ Triptani
✘✘ SSRIs (citalopram, fluoxetina, fluvoxamina, paroxetina, sertralina)
✘✘ Anticonvulsanti (carbamazepina, fenobarbitone, fenitoina)
✘✘ HIV inibitori delle proteasi (indinavir, nelfinavir, ritonavir, saquinavir)
✘✘ HIV inibitori della transcriptasi (efavirenz, nevirapina)
✘✘ Contraccettivi orali
Nonostante le numerose interazioni descritte, quelle con ripercussioni cliniche di una certa
entità sono la minoranza (28%) e solo il 10% si osserva dalla co-somministrazione di farmaci
anticefalalgici 14.
Nonostante ciò è necessario porre una grande attenzione alla problematica interazione anche
in considerazione dei recenti warning della Food and Drug Administration (FDA).
Bibliografia
Oates J. The science of drug therapy. In: Oates J, ed. Goodman & Gilman’s The Pharmacological Basis of
Therapeutics. New York: McGraw-Hill 2006; pp. 117-36.
1
2
Dixon R, Warrander A. The clinical pharmacokinetics of zolmitriptan. Cephalalgia 1997;17(Suppl.
18):15-20.
Lipton RB, Stewart WF, Simon D. Medical consultation for migraine: results from the American Migraine
Study. Headache 1998;38:87-96.
3
Forward SP, McGrath PJ, MacKinnon D, Brown TL, Swann J, Currie EL. Medication patterns of recurrent
headache sufferers: a community study. Cephalalgia 1998;18:146-51.
4
Mann R. Center for Disease Control and Prevention and National Center for Prevention Health. In Statistics,
2000. Center for Disease Control and Prevention and National Center for Prevention Health Statistic
websites, Fastats A to Z: Women’s health, updated December 2000.
5
Goulding MR. Inappropriate medication prescribing for elderly ambulatory care patients. Arch Intern
Med 2004;164:305-12.
6
52
Interazioni tra i triptani ed altri farmaci, cibi e rimedi botanici
Tran C, Knowles SR, Liu BA, Shear NH. Gender differences in adverse drug reactions. J Clin Pharmacol
1998;38:1003-9.
7
Miller MA. Gender-based differences in the toxicity of pharmaceuticals – the Food and Drug Administration’s
perspective. Int J Toxicol 2001;20:149-52.
8
Guengerich FP. Cytochrome P-450 3A4: regulation and role in drug metabolism. Ann Rev Pharmacol
Toxicol 1999;39:1-17.
9
Franconi F, Brunelleschi S, Steardo L, Cuomo V. Gender differences in drug responses. Pharmacol Res
2007;55:81-95.
10
Paine MF, Widmer WW, Hart HL, Pusek SN, Beavers KL, Criss AB, et al. A furanocoumarin-free grapefruit
juice establishes furanocoumarins as the mediators of the grapefruit juice-felodipine interaction. Am J Clin
Nutr 2006;83:1097-105.
11
Tanaka E. Clinically important pharmacokinetic drug-drug interactions: role of cytochrome P450 enzymes.
J Clin Pharm Ther 1998;23:403-16.
12
Moubarak AS, Rosenkrans CF Jr., Johnson ZB. Modulation of cytochrome P450 metabolism by ergonovine
and dihydroergotamine. Vet Hum Toxicol 2003;45:6-9.
13
Sternieri E, Coccia CP, Pinetti D, Ferrari A. Pharmacokinetics and interactions of headache medications,
part I: introduction, pharmacokinetics, metabolism and acute treatments. Expert Opin Drug Metab
Toxicol 2006;2:961-79.
14
Product Information. Relpax®, eletriptan. New York, NY: Pfizer 2002.
15
Medical Economics Staff. Physician’s Desk Reference. PDR Red Book 2002.
16
Gallagher RM, Cutrer FM. Migraine: diagnosis, management, and new treatment options. Am J Manag
Care 2002;8:S58-73.
17
Armstrong SC, Cozza KL. Triptans. Psychosomatics 2002;43:502-4.
18
Buchan P, Wade A, Ward C, Oliver SD, Stewart AJ, Freestone S. Frovatriptan: a review of drug-drug
interactions. Headache 2002;42(Suppl. 2):S63-73.
19
Massiou H, MacGregor EA. Evolution and treatment of migraine with oral contraceptives. Cephalalgia
2000;20:170-4.
20
Jhee SS, Shiovitz T, Crawford AW, Cutler NR. Pharmacokinetics and pharmacodynamics of the triptan
antimigraine agents: a comparative review. Clin Pharmacokinet 2001;40:189-205.
21
McEnroe JD, Fleishaker JC. Clinical pharmacokinetics of almotriptan, a serotonin 5-HT(1B/1D) receptor
agonist for the treatment of migraine. Clin Pharmacokinet 2005;44:237-46.
22
Fleishaker JC, Herman BD, Carel BJ, Azie NE. Interaction between ketoconazole and almotriptan in
healthy volunteers. J Clin Pharmacol 2003;43:423-7.
23
Tepper SJ, Rapoport AM, Sheftell FD. Mechanisms of action of the 5-HT(1B/1D) receptor agonists. Arch
Neurol 2002;59:1084-8.
24
Goldberg MR, Sciberras D, De Smet M, Lowry R, Tomasko L, Lee Y, et al. Influence of β-adrenoceptor
antagonists on the pharmacokinetics of rizatriptan, a 5-HT(1B/1D) agonist: differential effects of propranolol,
nadolol and metoprolol. Br J Clin Pharmacol 2001;52:69-76.
25
Product Information. Zomig® nasal spray, zolmitriptan nasal spray. Wilmington DE: AstraZeneca
Pharmaceuticals 2003.
26
Minton N, Dixon R, Wild M, al. Drug interaction studies and metabolic enzyme characterisation with
zolmitriptan (Zomig). Br J Clin Pharmacol 1999;47:588-96.
27
Product Information. Frova®, frovatriptan. Chadd Ford, PA: Endo Pharmaceuticals 2006.
28
53
interazioni farmacologiche nel trattamento dell’emicrania
Turner EH, Loftis JM, Blackwell AD. Serotonin a la carte: supplementation with the serotonin precursor
5-hydroxytryptophan. Pharmacol Ther 2006;109:325-38.
29
Moore LB, Goodwin B, Jones SA, Wisely GB, Serabjit-Singh CJ, Willson TM, et al. St. John’s wort induces
hepatic drug metabolism through activation of the pregnane X receptor. Proc Natl Acad Sci USA
2000;97:7500-2.
30
Breckenridge A. Important interactions between St John’s wort (Hypericum perforatum) and prescribed
medicines. [Dear Doctor/Pharmacist letter]. In http://www.open.gov.uk/mca, 2002.
31
54
Capitolo 5
INTERAZIONI DEI TRIPTANI:
IL PARERE DEL CLINICO
G.B. Allais, I. Castagnoli Gabellari, C. Benedetto
L’introduzione dei triptani nell’ambito della farmacologia dell’emicrania ha significato per milioni di pazienti al mondo un netto miglioramento della qualità della vita. È infatti accaduto
che l’elevata selettività di tali prodotti e la loro rapida efficacia, sia sul dolore sia sui sintomi
associati, abbia prodotto un drastico calo nel numero di ore/mese in cui il paziente è gravemente disabilitato a causa dell’emicrania.
Non appare quindi strano che molti pazienti considerino i triptani un toccasana da cui non si
separerebbero mai.
D’altro canto, abbiamo visto nel precedente capitolo che potenzialmente molte interazioni
sono possibili, ed alcune di esse possono produrre conseguenze abbastanza serie. Il clinico
delle cefalee che ogni giorno utilizza i triptani come molecole di punta si trova a volte spaesato di fronte alla vastità, seppur spesso fortunatamente solo teorica, delle interazioni possibili.
D’altronde, le informazioni fornite dai riassunti delle caratteristiche del prodotto delle varie
preparazioni triptaniche presenti in commercio sono a volte piuttosto differenti, e questo non
aiuta a discernere nella pratica il comportamento migliore da tenere.
Di seguito riporteremo solo alcune considerazioni in merito alle principali possibilità di interazioni dei triptani con alcune classi farmacologiche e la loro rilevanza clinica per chi tratta in
prima persone le cefalee, rimandando per una disamina completa di tutte le possibili interazioni al capitolo di questo testo appositamente dedicato all’argomento.
Interazioni con altri preparati antiemicranici
A parte la ovvia avvertenza al paziente di non utilizzare contemporaneamente due triptani
differenti, alcune altre indicazioni di comportamento vanno fornite all’emicranico.
Spesso infatti il paziente che abbia avuto un insuccesso terapeutico nell’affrontare un attacco
acuto con un triptano cerca di assumere qualche altro prodotto, in modo da attutire il dolore.
Il medico deve dunque ricordargli, all’atto della prescrizione dei triptani, che non è possibile
assumere nell’arco delle stesse 24 ore prodotti a base di ergotamina. In questo caso appare indicato orientare il paziente ad un eventuale utilizzo di farmaci antiinfiammatori non steroidei
(FANS) come farmaci di soccorso.
55
interazioni farmacologiche nel trattamento dell’emicrania
Altro evento possibile è che pazienti in terapia di profilassi con metisergide o con diidroergotamina mesilato possano trattare gli attacchi residui con triptani. Il terapeuta deve risolvere
questa incompatibilità, valutando attentamente una sostituzione della terapia di profilassi;
alternativamente, ove la profilassi con queste molecole sia risultata l’unica realmente efficace
in quel paziente, si dovrebbe procedere alla sostituzione del triptano con farmaci antinfiammatori o, in ogni caso, avvertire il paziente di essere molto attento ad evitare il più possibile
una eventuale cosomministrazione di triptani e ergot-derivati.
Interazioni con inibitori selettivi del re-uptake
della serotonina e inibitori selettivi del re-uptake
della serotonina e della noradrenalina
Recentemente la Food and Drug Administration (FDA) ha lanciato l’avvertimento che l’uso di
triptani in combinazione con gli SSRI o con gli SNRI aumenta il rischio di sindrome serotoninergica (di cui già discusso nel capitolo 2). In realtà, in un periodo di osservazione di 5 anni
negli Stati Uniti sono stati segnalati solo 27 casi in cui lo sviluppo di tale sindrome era associato all’uso combinato di triptani e SSRI, e di questi, solo 2 casi hanno costituito serio pericolo di vita per i pazienti 1. Inoltre in letteratura sono disponibili pochi studi che indaghino gli
eventuali effetti di questa interazione farmacologica e i risultati sono insufficienti per trarne
conclusioni definitive.
È noto peraltro che tra emicrania e depressione esiste una elevata comorbidità 2 e che quindi
molto spesso nella pratica clinica si incontrano pazienti in concomitante terapia con antiemicranici e antidepressivi; in particolare, vista la grande efficacia e conseguente enorme diffusione degli SSRI/SNRI, non è infrequente che ad un paziente emicranico vengano prescritti
antidepressivi di questa classe farmacologica. Benché la potenziale gravità dello sviluppo di una
sindrome serotoninergica imponga indubbiamente estrema cautela in questi pazienti, tuttavia
può risultare poco etico in alcuni casi privarli della possibilità di curarsi con antidepressivi e
antiemicranici di ultima generazione, dunque più efficaci, sulla sola base di dati ottenuti da
un ridottissimo numero di case reports. Si potrebbe dunque consigliare al medico, dal punto
di vista pratico, nel caso di contemporanea assunzione di tali farmaci, di prestare particolare
attenzione all’eventuale sviluppo di sintomi suggestivi di sindrome serotoninergica, seppur
lievi, quali disturbi gastrointestinali, rigidità, tremori o modificazioni cognitive, e nel caso di
loro riscontro sospendere immediatamente l’uso dei farmaci ad azione serotoninergica. Ciò
implica in pratica di dedicare un po’ di tempo a spiegare dettagliatamente al paziente quali
siano i sintomi iniziali che possono far pensare ad una sindrome serotoninergica e di effettuare
una frequente monitorizzazione del paziente stesso.
Interazioni con inibitori delle monoamino ossidasi
Benché i farmaci appartenenti a questa categoria abbiano indubbiamente una diffusione
molto più limitata rispetto agli SSRI/SNRI, si deve comunque tenere conto che possono es56
Interazioni dei triptani: il parere del clinico
sere presenti importanti interazioni con i triptani il cui metabolismo è monoamino ossidasi
(MAO)-dipendente, cioè sumatriptan e rizatriptan totalmente, zolmitriptan e almotriptan parzialmente. In particolare, va ricordato che per sumatriptan e rizatriptan esiste non solo la controindicazione assoluta all’uso contemporaneo con IMAO, ma addirittura secondo i riassunti
delle caratteristiche dei prodotti l’assunzione di questi ultimi deve essere interrotta almeno
due settimane prima di poter utilizzare sumatriptan o rizatriptan.
Interazioni con antifecondativi orali
Al di là di una preoccupazione specifica della donna emicranica, derivante più da credenze
generiche che da dati scientificamente obiettivati, riguardo ad una sicura esacerbazione del
mal di testa in seguito all’assunzione della pillola, cosa peraltro non vera (vedi capitolo 1), la
principale preoccupazione di una donna che assume contraccettivi orali è invece quella che
altri prodotti farmaceutici possano in qualche modo interagire con gli estroprogestinici diminuendone l’efficacia contraccettiva.
Nel caso dei triptani questa possibilità pare non sussistere.
Se interazioni possono esservi, queste riguardano la possibilità di indurre, da parte dei contraccettivi, una maggiore presenza di effetti collaterali dei triptani, a causa di un aumento
della loro concentrazione ematica (al momento esistono evidenze solo per lo zolmitriptan 3
e il frovatriptan 4).
Interazioni con antiipertensivi e antiaritmici
Spesso i pazienti emicranici possono utilizzare farmaci antiipertensivi. Ciò avviene sia perché
il soggetto può presentare altre patologie che necessitano di questi preparati, sia perché alcuni di tali farmaci, in particolare i β-bloccanti, sono considerati di elezione nel trattamento di
profilassi dell’emicrania.
Il propranololo, il β-bloccante più utilizzato nella cura dell’emicrania, è risultato essere un inibitore dell’enzima MAO-A, responsabile del metabolismo del rizatriptan. In caso di utilizzo contemporaneo di questi farmaci sarà quindi necessario ridurre la dose giornaliera di rizatriptan
da 10 mg a 5 mg 5. Una certa attenzione andrebbe comunque prestata anche in caso di uso
contemporaneo di propranololo e zolmitriptan.
Per quanto riguarda gli altri β-bloccanti non sembra invece sussistere questo tipo di interazione.
Deve essere inoltre tenuta a mente la possibile interazione con il verapamile, anch’esso utilizzato, se pur meno frequentemente, nella profilassi dell’emicrania: esso può inibire l’attività del
CYP3A4, aumentando dunque i possibili effetti collaterali di alcuni triptani il cui metabolismo
dipende da questo citocromo.
Un problema decisamente meno frequente nella popolazione emicranica è quello della cosomministrazione di antiaritmici e triptani. L’amiodarone ad esempio è in grado di inibire la
CYP3A4, con conseguente riduzione del metabolismo dell’eletriptan. Nonostante non esi57
interazioni farmacologiche nel trattamento dell’emicrania
stano precise disposizioni in merito ad un aggiustamento della dose del triptano in caso di
assunzione contemporanea dei due farmaci, è consigliabile sempre porre molta attenzione
all’eventuale insorgenza di effetti collaterali, oppure di scegliere un triptano alternativo, che
possa garantire pari efficacia.
Potenzialmente più pericolosa è un’interazione tra amiodarone o mexiletina 6 e triptani, quando questi ultimi inducano un aumento di attività degli antiaritmici: esiste infatti la possibilità,
se pur teorica, di un allungamento dell’intervallo QT o addirittura di torsioni di punta.
Interazioni con prodotti di derivazione naturale
L’eventuale uso di prodotti cosiddetti “naturali” può rappresentare un lato oscuro veramente
insidioso per il medico che debba tenere conto delle possibili interazioni dei triptani.
Questo perché innanzitutto il medico non viene messo al corrente dal paziente dell’uso di
prodotti naturali, che avviene quasi sempre su consiglio di amici, parenti, o di operatori commerciali più o meno qualificati. Non pare dunque superfluo suggerire costantemente al medico di indagare sempre anamnesticamente il possibile uso di prodotti non etici, prima di
prescrivere farmaci antiemicranici specifici.
Pompelmo
L’uso frequente di succo di pompelmo, spesso anche inserito in diverse diete dimagranti, può
essere insidioso. A volte infatti alcuni piani dietetici prevedono l’ingestione di grandi quantità di
tale frutto, che possono dar luogo all’insorgenza di particolari interazioni in caso di concomitante
assunzione di farmaci. È noto infatti che il pompelmo è in grado di inibire l’enzima CYP3A4,
provocando così un aumento dei livelli ematici dei farmaci da esso metabolizzati. Tale effetto è
stato notato sia con la polpa che col succo, può manifestarsi anche per bassi consumi e l’entità
delle interazioni può variare a seconda della quantità degli ingredienti attivi contenuti nelle varie
preparazioni di mercato. Inoltre, dato che la risposta è prolungata, tale interferenza non viene
evitata separando l’assunzione delle due sostanze. Alla luce di tali dati, il medico è chiamato a
valutare caso per caso l’entità clinica di questa interazione, visto che per numerosi medicinali
sembrerebbe sussistere solo in via teorica. All’interno della classe dei triptani, le molecole passibili
di un’eventuale interazione con questo frutto sono i triptani metabolizzati dal CYP3A4, in primis
l’eletriptan, interamente metabolizzato da questo sistema, ma anche l’almotriptan. Attualmente
non vi sono dati consistenti in letteratura, ad ogni modo nei consumatori di pompelmo, onde
evitare l’insorgenza di effetti collaterali, si potrebbe suggerire di eliminare dalla dieta tale frutto
o, in alternativa, di passare all’utilizzo di altri triptani non metabolizzati dal CYP3A4.
Hypericum perforatum
Nell’ultimo decennio l’uso dell’Hypericum perforatum, comunemente detto erba di San Giovanni, è cresciuto esponenzialmente, parallelamente ad una continua pubblicizzazione delle
58
Interazioni dei triptani: il parere del clinico
sue possibilità terapeutiche in svariate condizioni patologiche (non sempre corrispondenti
alle reali possibilità del prodotto).
Il medico che si trova a prescrivere farmaci in pazienti che utilizzano l’iperico deve essere a
conoscenza del fatto che tale preparato presenta un’azione di induzione su alcuni enzimi
coinvolti nel metabolismo di farmaci quali ad esempio il warfarin, la ciclosporina, la digossina
o i contraccettivi orali, con conseguente riduzione dei loro livelli ematici e degli effetti terapeutici. Al contrario si è notato che, in caso di concomitante utilizzo di triptani, l’iperico è in
grado di esercitare piuttosto un’interazione farmacodinamica di tipo additivo o potenziante
che può risultare in gravi reazioni avverse derivanti da aumentati effetti serotoninergici 7.
Con una considerazione finale, si potrebbe infine suggerire che i triptani con metabolismo
MAO-dipendente possano avere in generale un minor numero di interazioni con altri prodotti
farmaceutici rispetto a quelli la cui degradazione dipende dai citocromi. Questa affermazione
può essere considerata genericamente valida, non fosse altro perché i farmaci che vengono
degradati dalle MAO sono numericamente molto inferiori rispetto a quelli con metabolismo
legato al sistema dei citocromi. E un’ultima notazione appare importante: il sistema dei citocromi ha un metabolismo particolare anche nei singoli organi, e dunque non è possibile
escludere a priori eventuali danni per effetto di interazioni a livello organo-specifico 8, anche
se attualmente non esistono prove certe di tali effetti.
Bibliografia
Shapiro RE, Tepper SJ. The serotonin syndrome, triptans, and the potential for drug-drug interactions.
Headache 2007;47:266-9.
1
Hamelsky SW, Lipton RB. Psychiatric comorbidity of migraine. Headache 2006;46:1327-33.
2
Shadle CR, Guanghan L, Goldberg MR. A double-blind, placebo-controlled evaluation of the effect of oral
doses of rizatriptan 10 mg on oral contraceptive pharmacokinetics in healthy female volunteers. J Clin
Pharmacol 2000;40:309-15.
3
Buchan P, Wade A, Ward C, Oliver SD, Stewart AJ, Freestone S. Frovatriptan: a review of drug-drug
interactions. Headache 2002;42(Suppl. 2):S63-73.
4
Goldberg MR, Sciberras D, De Smet M, Lowry R, Tomasko L, Lee Y, et al. Influence of β-adrenoceptor
antagonists on the pharmacokinetics of rizatriptan, a 5-HT1B/1D agonist: differential effects of propranolol,
nadolol and metoprolol. Br J Clin Pharmacol 2001;52:69-76.
5
Armstrong SC, Cozza KL. Med-Psych drug-drug interaction update. Triptans. Psychosomatics 2002;43:502-4.
6
Henderson L, Yue QY, Berqquist C, Gerden B, Arlett P. St John’s wort (Hypericum perforatum): drug
interactions and clinical outcomes. Br J Clin Pharmacol 2002;54:349-56.
7
Franconi F, Brunelleschi S, Steardo L, Cuomo V. Gender differences in drug responses. Pharmacol Res
2007;55:81-95.
8
59
Finito di stampare nel mese di Luglio 2007
presso le Industrie Grafiche della Pacini Editore S.p.A.
Via A. Gherardesca • 56121 Ospedaletto • Pisa
Telefono 050 313011 • Telefax 050 3130300
www.pacinieditore.it
Cod. NEUR-1072843-0000-MXT-BT-02/2015
Depositato all’AIFA in data 11/07/07
interazioni
farmacologiche
nel trattamento
dell’emicrania
a cura di
F. Franconi
G.B. Allais
PACINIeditore
MedicIna