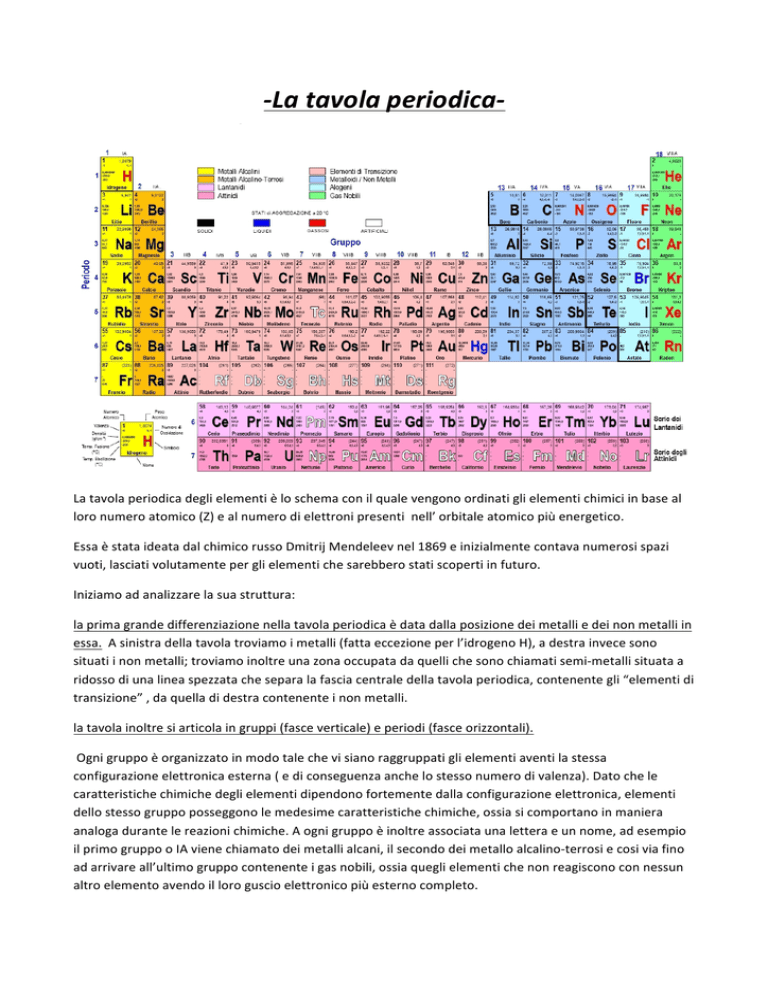
-­‐La tavola periodica-­‐
La tavola periodica degli elementi è lo schema con il quale vengono ordinati gli elementi chimici in base al loro numero atomico (Z) e al numero di elettroni presenti nell’ orbitale atomico più energetico. Essa è stata ideata dal chimico russo Dmitrij Mendeleev nel 1869 e inizialmente contava numerosi spazi vuoti, lasciati volutamente per gli elementi che sarebbero stati scoperti in futuro. Iniziamo ad analizzare la sua struttura: la prima grande differenziazione nella tavola periodica è data dalla posizione dei metalli e dei non metalli in essa. A sinistra della tavola troviamo i metalli (fatta eccezione per l’idrogeno H), a destra invece sono situati i non metalli; troviamo inoltre una zona occupata da quelli che sono chiamati semi-­‐metalli situata a ridosso di una linea spezzata che separa la fascia centrale della tavola periodica, contenente gli “elementi di transizione” , da quella di destra contenente i non metalli. la tavola inoltre si articola in gruppi (fasce verticale) e periodi (fasce orizzontali). Ogni gruppo è organizzato in modo tale che vi siano raggruppati gli elementi aventi la stessa configurazione elettronica esterna ( e di conseguenza anche lo stesso numero di valenza). Dato che le caratteristiche chimiche degli elementi dipendono fortemente dalla configurazione elettronica, elementi dello stesso gruppo posseggono le medesime caratteristiche chimiche, ossia si comportano in maniera analoga durante le reazioni chimiche. A ogni gruppo è inoltre associata una lettera e un nome, ad esempio il primo gruppo o IA viene chiamato dei metalli alcani, il secondo dei metallo alcalino-­‐terrosi e cosi via fino ad arrivare all’ultimo gruppo contenente i gas nobili, ossia quegli elementi che non reagiscono con nessun altro elemento avendo il loro guscio elettronico più esterno completo. Il periodo invece raggruppa gli elementi secondo un criterio diverso: ogni periodo inizia con un’atomo avente come configurazione elettronica un elettrone sul gruppo s più esterno, e muovendoci verso destra possiamo osservare un aumento del numero atomico Z ad ogni passaggio; dunque elementi dello stesso periodo hanno lo stesso numero di orbitali atomici. Passiamo ora a un analisi delle informazione che la tavola periodica ci fornisce riguardo un singolo elemento: Grazie alla tavola possiamo conoscere numero atomico (numero di protoni presenti nell’atomo), peso atomico (massa dell’atomo dato dalla somma di protoni e neutroni) , numero di ossidazione ( la differenza tra il numero di elettroni di valenza dell'atomo considerato e il numero di elettroni che ad esso rimangono dopo aver assegnato tutti gli elettroni di legame all'atomo più elettronegativo di ogni coppia) , valenza e naturalmente simbolo e nome dell’elemento considerato ( a volte è possibile anche trovare densità, temperatura di fusione e di ebollizione dell’elemento in questione). Con un corretto utilizzo della tavola periodica possiamo conoscere anche altre caratteristiche dei vari elementi chimichi come la loro dimensione atomica, l’ elettronegativa, la loro energia di ionizzazione La dimensione atomica di un elemento è, come lo stesso nome ci suggerisce, la grandezza dell’atomo dell’elemento che stiamo tenendo in considerazione ed è determinata dalla distanza fra gli elettroni e il nucleo; nella tavola periodica la dimensione atomica tende ad aumentare quando ci si muove dall’ alto verso il basso lungo un gruppo e a diminuire, invece, muovendoci da sinistra verso destra lungo un periodo. Questo accade perché muovendosi lungo il periodo da sinistra a destra il numero di protoni dell’atomo aumenta e quindi si crea una maggiore attrazione degli elettroni verso il nucleo, mentre scendendo un periodo il numero di orbitali aumenta e gli elettroni sono più lontani dal nucleo. L’ energia di ionizzazione è invece la quantità di energia necessaria per strappare un elettrone dall’atomo allo stato gassoso. Muovendoci verso destra lungo un periodo l’energia di ionizzazione cresce perché andando verso destra la configurazione elettronica degli atomi diventa man mano più stabile e quindi l’energia necessaria per strappare un elettrone sarà maggiore; muovendoci verso il basso in un gruppo invece essa diminuisce perché gli atomi sono situati in orbitali sempre più lontani dal nucleo e quindi, essendo gli elettroni meno attratti da esso, sarà più facile strapparli via. Analizziamo ora come varia, invece, l’elettronegativa nella tavola periodica. L’elettronegatività è una misura relativa alla capacità di un atomo di attrarre elettroni quando prende parte a un legame covalente. Muovendoci verso il basso lungo un gruppo essa diminuisce, viceversa muovendoci verso destra lungo un periodo essa aumenta.












