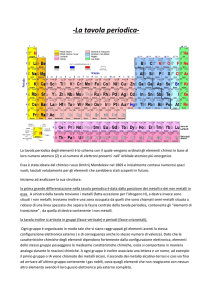
Tavola periodica
Concetto fondamentale della chimica:
strumento per classificare, riconoscere,
prevedere le proprietà degli elementi.
Tavola periodica
Serve a classificare in modo sistematico le proprietà
chimiche e quelle fisiche di tutti gli elementi noti.
E’ tuttora in fase di ampliamento: ai 92 elementi
naturali si aggiungono quelli artificiali, creati nelle
reazioni nucleari. Oggi conta 111 elementi, ma
almeno altri sei sono stati osservati in laboratorio e
sono ancora in attesa di nome e classificazione.
Mendeleev (1869)
La classificazione degli elementi secondo un sistema
periodico fu inizialmente proposta da Mendeleev.
Egli realizzò che, disponendo gli elementi in ordine
crescente di massa atomica, essi potevano essere
raggruppati in famiglie aventi proprietà fisiche e
chimiche simili (legge periodica).
Riuscì a prevedere l’esistenza di elementi non ancora
scoperti (es. germanio) e a prevederne alcune
proprietà.
Tuttavia le ragioni di tale periodicità rimasero a lui
sconosciute.
Tavola periodica
Nella organizzazione proposta da Mendeleev si notavano
alcune discrepanze: ad esempio le masse di Ar e K
avrebbero costretto a disporre i due elementi in
posizioni che contrastavano con le loro effettive
proprietà chimico-fisiche.
Nel XX secolo, sulla base delle scoperte relative alla
struttura atomica, fu proposta una nuova
classificazione: la tavola periodica fu ordinata secondo
il numero atomico crescente.
Sistema periodico (o tavola periodica)
Dal momento che il numero di elettroni in un atomo
neutro è correlato al numero atomico dell’elemento,
è evidente come l’attuale organizzazione della tavola
periodica rispecchi, di conseguenza, anche la
configurazione elettronica degli elementi.
Su di essa vengono riportati nome, simbolo chimico e
proprietà degli elementi (livello microscopico).
Spesso vengono riportate anche alcune proprietà
delle corrispondenti sostanze semplici (livello
macroscopico).
Tavola periodica
E’ suddivisa in 4 blocchi: s, p, d, f, a seconda della
configurazione elettronica degli elementi. Il nome del
blocco indica l’ultimo sottolivello energetico (orbitale)
occupato dagli elettroni, secondo il principio di Aufbau.
Uniche eccezioni sono H, che occupa una posizione unica,
ed He, che pur avendo configurazione 1s2, ha proprietà
simili a quelle dei gas nobili.
Dal riempimento dei livelli energetici dipendono le
proprietà chimiche degli elementi: simile configurazione
elettronica determina simili proprietà chimiche.
Tavola periodica: blocchi
s
p
d
f
Tavola periodica: periodi
E’ suddivisa in 7 periodi. Ogni nuovo periodo
corrisponde all’ occupazione di un livello energetico
con numero quantico principale (n) più elevato. Ogni
periodo contiene un numero di elementi pari al
numero massimo di elettroni (2n2) allocabili nel
corrispondente livello energetico.
Sperimentalmente non è stata evidenziata l’esistenza di
atomi con un numero di elettroni sufficiente ad
occupare livelli superiori al settimo.
Nota bene: gli orbitali d appartengono al livello
energetico inferiore. Es. 3d nel quarto periodo, 4d
nel quinto, etc.
Tavola periodica: gruppi
E’ suddivisa in 18 gruppi. All’interno di un gruppo le
proprietà sono molto simili, ma non identiche.
Il numero del gruppo, per i blocchi s e p, corrisponde al
numero di elettroni presenti nel guscio di valenza,
cioè quelli coinvolti nella formazione dei legami
chimici.
Gli elementi di transizione fanno eccezione.
Gli elementi metallici occupano i blocchi s, d ed f. Il
blocco p contiene elementi metallici, non metallici e
semimetallici
Tavola periodica nomenclatura
Alcuni gruppi hanno un nome particolare.
Gruppi A : elementi rappresentativi
Gruppo IA: metalli alcalini
Gruppo IIA: metalli alcalino-terrosi
Gruppo IIIA: metalli terrosi
Gruppo VIIA: alogeni
Gruppo VIIIA: gas nobili
Gruppi B: elementi di transizione
Periodicità delle proprietà degli elementi
Proprietà fisiche
• Dimensioni atomiche: raggio atomico e raggio ionico
Proprietà chimiche:
• Energia di ionizzazione
• Affinità elettronica
• Elettronegatività
• Carattere metallico e non metallico
• Reattività
Dimensioni atomiche
Raggio atomico
E’ la distanza media tra il nucleo e
gli elettroni che occupano il
livello energetico più esterno. Si
misura in angstrom (1 Å = 10-10
nm).
I raggi atomici diminuiscono da sinistra a destra lungo il
periodo, dal momento che aumenta la carica
nucleare Z e, di conseguenza, la carica nucleare
efficace Zeff.
I raggi atomici crescono dall’alto al basso lungo il
gruppo, perché vengono occupati nuovi livelli
energetici.
Carica nucleare efficace Zeff
Negli atomi polielettronici le dimensioni atomiche sono
determinate dalla carica nucleare efficace Zeff.
In un atomo polielettronico gli elettroni più interni
esplicano una azione ‘schermante’ per cui un
elettrone risente di una carica nucleare efficace Zeff,
minore della carica reale Z.
Elettroni appartenenti allo stesso tipo di orbitale non si
schermano fra loro in modo efficace.
Elettroni appartenenti ad orbitali interni e molto vicini
al nucleo sono molto efficaci nello schermare la
carica nucleare di cui risentono gli elettroni più
esterni.
Carica nucleare efficace
Raggio ionico
IONE: atomo che ha acquistato o perduto uno o più
elettroni.
CATIONE: atomo che ha perduto elettroni
ANIONE: atomo che ha acquistato elettroni
Raggio ionico del catione è minore del raggio
dell’atomo neutro progenitore.
Raggio ionico dell’anione è maggiore del raggio
dell’atomo neutro progenitore.
Energia di Ionizzazione (EI)
E’ l’energia necessaria per allontanare un elettrone da un
atomo (o ione) gassoso nel suo stato fondamentale: si
forma un catione.
A (g) + EI1 → A+ (g) + e- (g)
Di solito si considera l’energia di prima ionizzazione (o di
ionizzazione primaria).
Cresce da sinistra a destra lungo il periodo.
Decresce dall’alto al basso lungo il gruppo.
Può essere usata per stimare la stabilità della
configurazione elettronica di un elemento: a maggior
energia di ionizzazione corrisponde una maggior
stabilità dell’elemento.
Energia di ionizzazione
Energia ionizzazione
Affinità elettronica
Energia che viene liberata quando un atomo (o ione)
gassoso nel suo stato fondamentale cattura un
elettrone. Si forma un anione.
A (g) + e- (g) → A- (g) + energia
Cresce da sinistra a destra lungo il periodo.
Decresce dall’alto al basso lungo il gruppo.
Elettronegatività
E’ una misura quantitativa della forza con cui un
atomo attira a sé la nuvola elettronica coinvolta in
un legame.
Cresce da sinistra a destra lungo il periodo.
Decresce dall’alto al basso lungo il gruppo.
Non è una proprietà assoluta di un atomo, ma è una
proprietà relativa al partner di legame.
Elettronegatività
Carattere metallico
Gli elementi del blocco s rappresentano metalli molto
reattivi.
Gli elementi del blocco
semimetalli e non-metalli.
p
rappresentano
metalli,
Gli elementi del blocco d rappresentano metalli con
proprietà intermedie tra quelle degli elementi del blocco
s e quelle degli elementi del blocco p.
Formano facilmente cationi a diverso stato di ossidazione
(es. Fe2+, Fe3+).
Metalli, non metalli, semimetalli
Reattività
Le
sostanze semplici corrispondenti agli elementi
appartenenti ad uno stesso gruppo hanno reattività
simile.
Esempio: la reazione dei metalli alcalini con l’acqua
MI (s) + H2O (l)
MIOH (aq) + H2 (g) + calore
dove MI è un metallo del gruppo I (Na e K nel nostro caso)
Perché la reazione tra K e H2O sviluppa una fiamma?
Reattività
Osservazioni:
Tutti i metalli alcalini reagiscono con l’acqua secondo la
stessa reazione.
Scendendo lungo il gruppo, la reattività (la violenza della
reazione) aumenta.
Non cambia la reazione chimica, ma il modo in cui essa
avviene.
metalli alcalini