Tavola periodica degli elementi
0
IA
4,003
1
1,008
H
1
2
6,941
Li
3
3
22,99
Na
11
4
39,10
K
19
5
85,47
Rb
37
6
132,9
Cs
55
7
(223)
Fr
87
II A
Metalli
Metalloidi
Non metalli
9,012
Be
40,08
44,96
Ca
Sc
21
87,62
88,91
Y
Sr
38
39
137,3
Ba
138,9
La
57
(226)
Ra
88
10,81
12,01
14,01
26,98
III A
20
56
VB
5
24,31
Mg
IV B
B
4
12
III B
(227)
Ac
89
Serie dei lantanidi
Serie degli attinidi
IV A
VA
120
50,94
Ti
22
91,22
Zr
40
178,5
Hf
72
(257)
Rf
104
V
23
92,91
41
Nb
180,9
Ta
73
(260)
Db
105
140,1
Ce
58
232,0
Th
90
VI A
52,00
Cr
24
95,94
Mo
42
183,9
W
74
(263)
Sg
106
140,9
Pr
59
(231)
Pa
91
VII A
54,94
Mn
25
(98)
Tc
43
186,2
Re
75
(262)
Bh
107
144,2
Nd
60
(238)
U
92
VIII
55,85
Fe
26
101,1
Ru
44
190,2
Os
76
(265)
Hs
108
(147)
Pm
61
(237)
Np
93
58,47
Co
27
102,9
Rh
45
192,2
Ir
77
IB
58,69
Ni
28
106,4
Pd
46
195,1
Pt
78
63,55
Cu
29
107,9
Ag
47
197,0
Au
79
II B
65,39
Zn
30
112,4
Cd
48
200,5
Hg
80
Al
13
69,72
Ga
31
114,8
In
49
204,4
Tl
81
C
6
28,09
Si
14
72,59
Ge
32
118,7
Sn
50
207,2
Pb
82
N
7
30,97
P
15
74,92
As
33
121,8
Sb
51
209,0
Bi
83
VI B
VII B
16
19,00
O
8
32,07
S
16
78,96
Se
F
9
35,45
Cl
17
79,90
Br
34
35
127,6
126,9
Te
52
(210)
Po
84
I
53
(210)
At
85
He
2
20,18
Ne
10
39,95
Ar
18
83,80
Kr
36
131,3
Xe
54
(222)
Rn
86
(266)
Mt
109
150,4
Sm
62
(242)
Pu
94
152,0
Eu
63
(243)
Am
95
157,3
Gd
64
(247)
Cm
96
158,9
Tb
65
(247)
Bk
97
162,5
Dy
66
(249)
Cf
98
164,9
Ho
67
(254)
Es
99
167,3
68
Er
(253)
Fm
100
168,9
Tm
69
(256)
Md
101
173,0
Yb
70
(254)
No
102
175,0
Lu
71
(257)
Lr
103
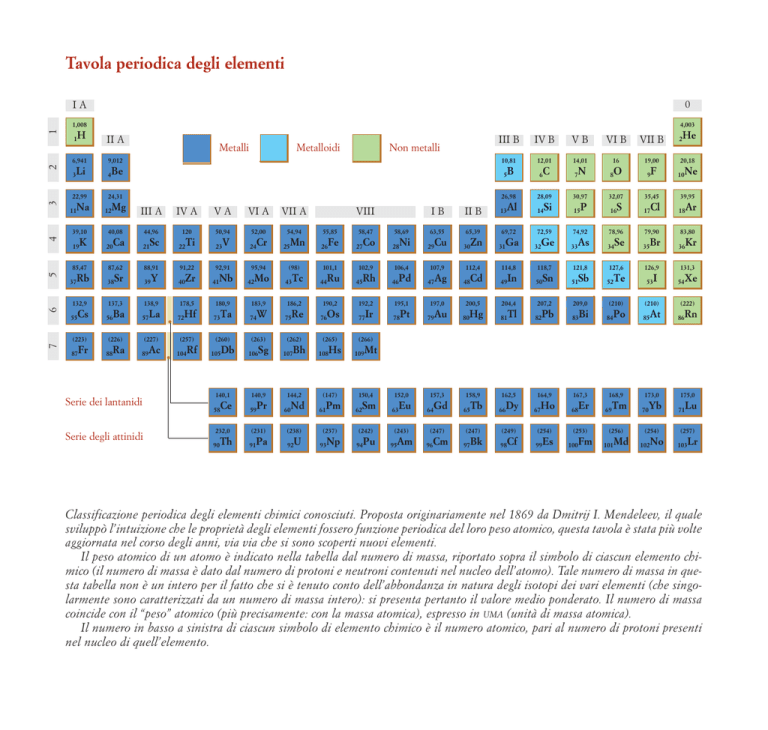
Classificazione periodica degli elementi chimici conosciuti. Proposta originariamente nel 1869 da Dmitrij I. Mendeleev, il quale
sviluppò l’intuizione che le proprietà degli elementi fossero funzione periodica del loro peso atomico, questa tavola è stata più volte
aggiornata nel corso degli anni, via via che si sono scoperti nuovi elementi.
Il peso atomico di un atomo è indicato nella tabella dal numero di massa, riportato sopra il simbolo di ciascun elemento chimico (il numero di massa è dato dal numero di protoni e neutroni contenuti nel nucleo dell’atomo). Tale numero di massa in questa tabella non è un intero per il fatto che si è tenuto conto dell’abbondanza in natura degli isotopi dei vari elementi (che singolarmente sono caratterizzati da un numero di massa intero): si presenta pertanto il valore medio ponderato. Il numero di massa
coincide con il “peso” atomico (più precisamente: con la massa atomica), espresso in UMA (unità di massa atomica).
Il numero in basso a sinistra di ciascun simbolo di elemento chimico è il numero atomico, pari al numero di protoni presenti
nel nucleo di quell’elemento.












