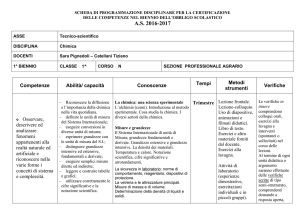
Programmazione classe 3° D
Insegnante: Maria Pia Guadagnini
Individuazione degli argomenti
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Definizione di materia, sistema e ambiente
Gli stati di aggregazione della materia.
Sistemi fisicamente omogenei ed eterogenei, sistemi chimicamente omogenei ed
eterogenei, miscugli e soluzioni. Definizione di fase di un sistema.
Sostanze ed elementi, tavola periodica degli elementi: metalli e non metalli
I passaggi di stato. Il concetto di evaporazione ed ebollizione. Definizione di densità.
Definizione di reazione chimica, reagenti e prodotti. Legge di Lavoisier. Definizione di
elemento e composto. Legge di Proust o delle proporzioni definite, con applicazioni
numeriche. Ipotesi atomica di Dalton. Legge delle proporzioni multiple.
L’uso della mole come unità di misura della quantità di sostanza, il numero di Avogadro.
Esercizi relativi all’utilizzo delle moli. Il principio di Avogadro e la massa relativa.
Differenza fra atomi e molecole.
La tavola periodica e le proprietà.
La struttura dell’atomo e la configurazione elettronica dell’atomo.
I legami chimici: ionico, covalente: semplice, multiplo, dativo, puro e polare, forma
delle molecole e il legame metallico.
Le forze intermolecolari: dipolo-dipolo, forze di London e legami idrogeno.
Proprietà dei metalli
I minerali e le sue proprità
Le rocce: ignee, sedimentarie, metamorfiche
Il vetro
Esperienze di laboratorio
•
•
•
•
Miscugli omogenei e miscugli eterogenei
Cristallizzazione del solfato rameico
Cromatografia su carta
Distillazione di una soluzione
Programmazione classe 4° D
Insegnante: Maria Pia Guadagnini
Individuazione degli argomenti
•
•
•
•
•
•
•
•
•
•
•
•
•
Definizione di reazione chimica, reagenti e prodotti. Legge di Lavoisier. Definizione di
elemento e composto. Legge di Proust o delle proporzioni definite, con applicazioni
numeriche. Ipotesi atomica di Dalton. Legge delle proporzioni multiple.
L’uso della mole come unità di misura della quantità di sostanza, il numero di Avogadro.
Esercizi relativi all’utilizzo delle moli.
Differenza fra atomi e molecole.
La tavola periodica e le proprietà.
La struttura dell’atomo e la configurazione elettronica dell’atomo.
La tavola periodica e le proprietà.
La struttura dell’atomo e la configurazione elettronica dell’atomo.
I legami chimici: ionico, covalente: semplice, multiplo, dativo, puro e polare, forma
delle molecole e il legame metallico.
Le forze intermolecolari: dipolo-dipolo, forze di London e legami idrogeno.
Proprietà dei metalli
I minerali e le sue proprità
Le rocce: ignee, sedimentarie, metamorfiche
Il vetro
Presentazioni:
1. Colori
2. Metalli nobili
3. Legno
4. Leghe
5. Pigmenti