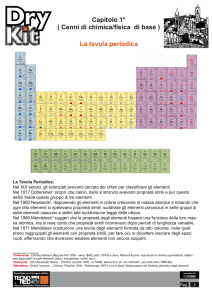
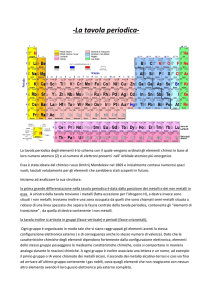
Traccia: T11) Descrivere la tavola periodica
La tavola periodica utilizzata ai giorni d'oggi è stata ideata da Dmitrij Mendeleev nel 1869
ed è il punto di partenza per chiunque si accinga a studiare la chimica. Infatti all'interno
della tavola periodica sono presenti moltissime informazioni che possono aiutare un novello
chimico a risolvere un qualsiasi problema, sia esso di calcolo delle moli oppure di
formazione di uno specifico composto. Ma esaminiamo più da vicino un singolo elemento.
Oltre a fornirci dati standard, quali il nome
dell'elemento o il simbolo, si nota che sono
presenti altre informazioni, quali il numero
atomico Z, ossia il numero di protoni contenuti in
un atomo, e la massa atomica relativa, che
corrisponde alla massa di un atomo di un
particolare elemento.
Se adesso invece andiamo ad esaminare una "linea" di elementi, o per meglio dire, un
periodo, si possono effettuare delle particolari osservazioni.
Appare evidente come il numero atomico Z aumenti proseguendo da sinistra verso destra.
Non solo, ma riflettendo sul fatto che Z indichi il numero di protoni presenti in un atomo, si
evince che in un atomo neutro il numero degli elettroni deve essere uguale a quello dei
protoni. Di conseguenza, i raggruppamenti in blocchi della tavola periodica vanno a
suggerire come gli elementi siano disposti a seconda del numero di elettroni che vanno
progressivamente a riempire gli orbitali atomici più esterni.
Un esempio chiaro può essere trovato negli elementi del blocco s.
Tutti gli elementi appartenenti a questo blocco vanno
progressivamente riempiendo l'orbitale s più esterno. Infatti,
considerando le configurazioni elettroniche di un qualsiasi elementi di
questo blocco, si nota che:
● Be 1s² 2s²
● K [Ar] 4sˡ
● Ba [Xe] 2s²
Tale caratteristica vale anche per gli altri elementi della tavola
periodica, i quali, all'aumentare del numero dei loro elettroni,
riempiono progressivamente gli orbitali p, d e f.
Volendo invece prendere in considerazione una colonna di elementi, un cosìdetto "gruppo",
le affinità tra gli elementi sono meno chiare, ma non per questo assenti. Infatti ogni gruppo
comprende gli elementi che hanno la stessa configurazione elettronica esterna; siccome le
proprietà chimiche degli elementi dipendono fortemente dalla loro configurazione
elettronica, all'interno di ogni gruppo si trovano elementi con caratteristiche chimiche simili
(cioè che si comportano in maniera simile durante lo svolgimento delle reazioni chimiche). I
gruppi sono numerati dall'1 al 18 dalla colonna più a sinistra a quella più a destra.
Ad alcuni di questi gruppi sono stati dati nomi specifici, come metalli alcalini (I gruppo),
metalli alcalino-terrosi (II gruppo), alogeni (VII gruppo) e gas nobili (VIII gruppo).
Tutte queste differenze ed affinità tra i vari elementi, sia lungo un gruppo che lungo un
periodo, sono fondamentali nel definire le proprietà periodiche.
• Raggio atomico
Il raggio atomico è definito come la metà della distanza
internucleare tra due atomi dello stesso elemento, legati in
modo covalente. Il raggio atomico aumenta nello stesso
gruppo spostandosi verso gli elementi in basso e
diminuisce avanzando da sinistra a destra nello stesso
periodo; ciò è dovuto al fatto che scendendo nel gruppo il
numero quantico principale n aumenta e ciò fa sì che
l'atomo abbia una nuvola elettronica più sviluppata, mentre
andando da sinistra a destra nel periodo n rimane uguale,
mentre varia il numero di protoni all'interno del nucleo,
facendo aumentare le forze nucleari di attrazione tra gli
elettroni e il nucleo attorno al quale gravitano, con la
conseguente diminuzione del raggio atomico.
• Energia di ionizzazione
L'energia di ionizzazione di un atomo o di una molecola è l'energia minima richiesta per
allontanare da esso un elettrone e portarlo a distanza infinita. L'energia di ionizzazione
diminuisce scendendo lungo un gruppo ed aumenta procendendo lungo un periodo. Tutto
ciò è dovuto dal fatto che scendendo nel gruppo gli elettroni nell'ultimo livello energetico
sono più lontani dal nucleo, in cui
risiede la carica positiva, e sono
quindi più facili da allontanare.
Andando da sinistra verso destra in
un periodo invece gli elettroni sono
attirati sempre con maggiore forza
dalle forze nucleari. L'energia di
ionizzazione
è
elevatissima
soprattutto nei gas nobili, a causa
della loro stabilità.
• Elettronegatività
L'elettronegatività viene definita come la capacità di un atomo di attrarre elettroni quando
prende parte a un legame chimico. L'elettronegatività diminuisce scendendo lungo un
gruppo ed aumenta procendendo lungo un periodo.
A seconda degli elementi di un
composto e della differenza di
elettronegatività tra di essi, si
potranno
ottenere
legami
covalenti puri, covalenti apolari,
covalenti polari o ionici.
• Affinità elettronica
L'affinità elettronica è l'ammontare di energia rilasciata o assorbita quando un elettrone è
aggiunto ad un atomo neutro. L'affinità elettronica diminuisce scendendo lungo un gruppo
ed aumenta procendendo lungo un periodo.
La tavola periodica inoltre, specifica anche se l'elemento preso in considerazione è gassoso,
metallico, liquido o semi-metallico. Gli elementi metallici occupano tutta la parte sinistra e
centrale della tavola, mentre gli elementi gassosi si trovano nella sola parte sinistra. I semimetalli costituiscono la linea di demarcazione tra i metalli e i gas. Gli elementi liquidi sono
pochi, quali ad esempio il mercurio Hg e il bromo Br.