Sostanze pure
porzioni di materia (materiali) che hanno una composizione chimica ben definita e costante, e proprietà
chimico – fisiche caratteristiche e costanti.
Le sostanze pure si dividono in elementi e composti.
ELEMENTI
COMPOSTI
Sostanze pure che non possono essere ulteriormente
decomposte in altre sostanze → sono le sostanze più
semplici che ci siano (sostanze elementari)
Sostanze pure che, mediante metodi chimici, possono
essere decomposte in sostanze più semplici (elementi)
Sostanze costituite da 2 o più elementi combinati tra
loro secondo un preciso rapporto
Sono poco più di un centinaio (117) divisi in :
naturali (circa 90)
artificiali (gli altri)
Sono milioni suddivisi in
naturali (cioè che si formano in natura)
artificiali o di sintesi (cioè prodotti dall’uomo mediante
opportuni processi chimici)
Ogni elemento è rappresentato mediante un SIMBOLO
costituito da una sola lettera maiuscola oppure due lettere
di cui la prima maiuscola e la seconda minuscola.
Il simbolo in genere coincide con l’iniziale del nome (per
gli elementi noti sin dall’antichità si fa riferimento al
nome latino: per es. per K, P, S, N, Cu).
I nomi possono far riferimento a corpi celesti, scienziati,
nazioni, oppure derivano dal latino o dal greco.
Ogni composto è rappresentato mediante una
FORMULA CHIMICA che può essere:
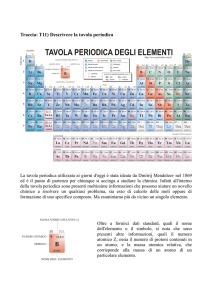
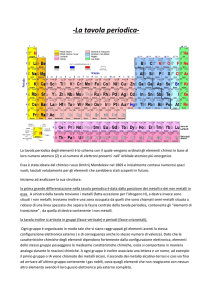
Sono raccolti e ordinati, secondo precisi criteri, nella
tavola PERIODICA DEGLI ELEMENTI.
Questa è costituita da:
Es. CO2, H2O, C6H12O6
7 righe orizzontali → PERIODI indicati con numeri
arabi da 1 a 7
BRUTA o GREZZA : indica gli elementi presenti
usando i rispettivi simboli e il numero di atomi di ogni
elemento (o il rapporto di combinazione tra elementi)
usando dei numeri detti indici scritti in basso a destra del
simbolo
DI STRUTTURA: oltre ad indicare ciascun atomo
presente utilizzando il simbolo dell’elemento,
rappresenta il modo in cui gli atomi sono legati tra loro
utilizzando dei trattini
18 colonne verticali → GRUPPI indicati con numeri
arabi da 1 a 18 oppure con numeri romani da I a VIII
seguiti dalla lettera A oppure B
Es.
Vengono classificati secondo vari criteri che fanno
riferimento alle proprietà chimiche o alla struttura degli
atomi.
La principale suddivisione è basata sulla posizione nella
tavola periodica, sullo stato fisico a T ambiente e su
alcune proprietà fisiche: in base a questi criteri vengono
classificati in:
Vengono classificati secondo vari criteri:
METALLI a sinistra nella tavola periodica
2) In base alla presenza di carbonio;
possono essere:
INORGANICI: non contengono carbonio (C) o se lo
contengono questo non è mai legato direttamente
all’idrogeno (H)
ORGANICI: contengono sempre carbonio (C) legato
direttamente all’idrogeno (H)
NON METALLI a destra nella tavola periodica
SEMIMETALLI: sulla scaletta nella tavola periodica
O
H
H
1) In base al numero di elementi da cui sono
composti; possono essere:
BINARI: formati da 2 elementi
TERNARI: formati da 3 elementi
QUATERNARI: formati da 4 elementi
3) In base al tipo di legame chimico; possono
essere:
COVALENTI con legame covalente
IONICI con legame ionico
Proprietà fisiche degli elementi
METALLI
- Tutti solidi tranne il mercurio(Hg)
- Hanno p.f. elevati
- Densità piuttosto elevate
- Lucentezza metallica,
generalmente
- Sono duttili (si lavorano in fili)
- Sono malleabili (si lavorano in
fogli)
- Sono buoni conduttori di
elettricità e di calore.
SEMITALLI
I semimetalli hanno proprietà
intermedie a quelle di metalli
e non metalli.
Vengono usati come
semiconduttori.
Il più importante è il silicio,
che è uno degli elementi più
diffusi nella litosfera
(minerali e rocce).
-
NON METALLI
Sono sia solidi, sia liquidi,
sia aeriformi
Hanno p.f. molto diversi.
Hanno densità diverse
Non hanno lucentezza
metallica (solo x i solidi)
Non sono duttili né
malleabili
Non sono buoni conduttori
di calore e di elettricità.
L’atomo
L’atomo è la più piccola particella stabile che forma la materia.
Per ogni elemento c’è un atomo diverso, quindi se ci sono 112 elementi significa che ci sono 112 tipi di
atomi con la stessa struttura, ma con diverso numero di particelle SUBATOMICHE (protoni, neutroni,
elettroni).
MASSA
CARICA
ELETTRICA
N° di PARTICELLE
POSIZIONE
PROTONI (p+)
NEUTRONI (n)
ELETTRONI (e-)
Ordine di grandezza:
10-27 Kg
Massa unitaria m=1
Ordine di grandezza:
10-22 Kg
Massa unitaria m=1
+1
0 (privi di carica)
Ordine di grandezza:
10-31 Kg
m = 1936 volte + piccola di quella
dei protoni.
-1
Uguali al numero
atomico (Z)
dell’elemento
Uguale alla differenza Uguali al numero atomico (Z)
tra numero di massa e dell’elemento
numero atomico
(A - Z )
Negli ORBITALI (la regione di spazio
Nel NUCLEO
in cui è massima, 99,9%, la
probabilità di trovare un elettrone).
Uniti da forze molto intense dette
FORZE NUCLEARI
Sono disposti intorno al nucleo e
raggruppati in LIVELLI ENERGETICI di
energia crescente a mano a mano
che ci si allontana dal nucleo.
Z: numero atomico: numero dei protoni (o degli elettroni)
A: numero di massa: numero dei protoni + numero degli elettroni
Elettrone di valenza: elettroni del livello energetico più esterno. Corrispondono al numero romano del
gruppo nella tavola periodica.
Per completare il primo livello bastano 2 elettroni, dal secondo in poi (fino al 7°) 8 elettroni.
Numero di livelli energetici: corrisponde al numero del periodo nella tavola periodica.
Numero di elettroni di valenza: corrisponde al numero romano del gruppo nella tavola periodica.
Gli isotopi
Etimologia: uguale luogo (occupano la stessa casella nella tavola periodica)
gli isotopi sono atomi di uno stesso elemento aventi uguale numero atomico (Z), ma diverso numero di
massa (A).
Questi atomi hanno uguale numero di protoni (p+) e di elettroni (e-), ma diverso numero di neutroni (n).
Gli isotopi hanno stesse proprietà chimiche, ma diverse proprietà fisiche.
Le proprietà chimiche dipendono dagli elettroni di valenza (e- di valenza): elettroni del livello energetico
più esterno
L’unità di massa atomica
Non è possibile pesare un singolo atomo o una molecola, possiamo però confrontarla con una massa di
riferimento. Il riferimento scelto è l’isotopo 12 del carbonio.
Si è stabilito che l’unità di massa atomica (u.m.a., o dalton) sia pari a 1/12 della massa del 12C.
I valori delle masse atomiche che troviamo sulla tavola periodica sono valori medi, che tengono conto della
massa atomica di tutti gli isotopi di un elemento e delle percentuali in cui ogni isotopo compare nella
miscela naturale dell’elemento.