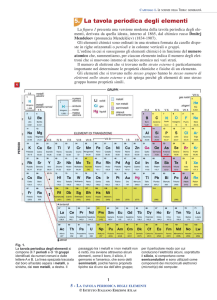
LA TAVOLA PERIODICA Nel 1870, un chimico russo, Dimitri Mendelejev, raccolse e catalogò tutti gli elementi allora
conosciuti in base alle loro somiglianze, disponendoli in righe e colonne, secondo il loro peso
atomico crescente, e ponendo uno sotto l’altro quelli che mostravano proprietà chimiche e fisiche
simili, in modo da formare dei gruppi. Lo studioso di chimica chiamò il suo sistema di
classificazione Tavola periodica degli elementi. La tavola che usiamo noi oggi è molto simile a quella di Mendelejev; essa ne differisce, tuttavia, sia
per l’aspetto grafico (che è più allungato) sia, soprattutto, perché gli elementi non si succedono in
funzione del loro peso atomico, ma in funzione del numero atomico crescente.
•
Organizzazione
La tavola periodica degli elementi è organizzata in file orizzontali: periodi, e in colonne verticali:
gruppi.
In ogni gruppo le proprietà chimiche degli elementi sono simili; le stesse variano con regolarità
lungo i periodi.
In totale esistono 7 periodi: il I periodo contiene due elementi, l’idrogeno e l’elio,
corrispondentemente con il fatto che solo due elettroni possono trovare posto nel primo livello
energetico. Il II periodo, come il primo, finisce quando il secondo livello è completo e contiene,
quindi, otto elementi; il III ne ha anche otto; il IV e il V ne contengono diciotto, il VI ne contiene
trentadue e del VII finora ne conosciamo solo diciannove.
Ogni blocco contiene diverse serie di 2, 6, 10 e 14 elementi in cui si vanno riempiendo
rispettivamente gli orbitali s, p, d ed f. Gli elementi appartenenti all’insieme dei blocchi s e p sono
indicati come elementi rappresentativi o elementi tipici e sono ulteriormente suddivisi in otto
gruppi. I blocchi d e f contengono gli elementi di transizione.
Un gruppo, invece, prende il nome di famiglia, a causa della somiglianza delle proprietà degli
elementi che lo costituiscono. Alcuni gruppi hanno delle dominazioni particolari; così il primo
gruppo è detto anche dei metalli alcalini; il II è quello dei metalli alcalino-terrosi; il VII è quello
degli alogeni; l’ultimo gruppo è quello dei gas nobili.
• Variazioni periodiche
Oltre a conoscere il simbolo degli elementi, la loro massa atomica, il loro stato fisico in natura, la
loro configurazione elettronica esterna, il numero di ossidazione, la tavola periodica fornisce
ulteriori informazioni; sappiamo,infatti, che gli elementi posti a sinistra nel sistema periodico sono
detti METALLI e le loro proprietà (duttilità, lucentezza, malleabilità, buoni conduttori di calore e di
energia) dipendono dalla facilità con cui cedono elettroni (sono infatti chiamati elettropositivi o
cationi); gli elementi posti a destra del sistema periodico sono detti NON METALLI e le loro
proprietà sono opposte a quelle dei metalli; questi ultimi accettano elettroni e difficilmente li
cedono (sono quindi denominati elettronegativi o anioni) . Esistono inoltre sette SEMIMETALLI
ovvero quegli elementi che a più basso numero atomico si comportano da non metalli e quelli che a
più alto assumono caratteri tipici dei metalli, e questi si trovano tra il III e il IV gruppo.
Grazie alla tavola periodica degli elementi vediamo, inoltre, che i raggi atomici variano
periodicamente all’aumentare del numero atomico: cioè diminuiscono lungo un periodo,
raggiungono il minimo, poi, passando al periodo successivo, aumentano bruscamente per poi
diminuire ancora, e così via.
Attraverso la lettura della tavola periodica degli elementi notiamo che l’energia di ionizzazione,
ovvero l’energia richiesta per rimuovere un elettrone da un atomo isolato, l’affinità elettronica, cioè,
la quantità di energia che si manifesta quando un elettrone si combina con una atomo isolato, e
l’elettronegatività, ovvero la tendenza degli atomi ad attrarre gli elettroni di legame, aumenta lungo
il periodo e diminuisce lungo un gruppo.