Chiralità
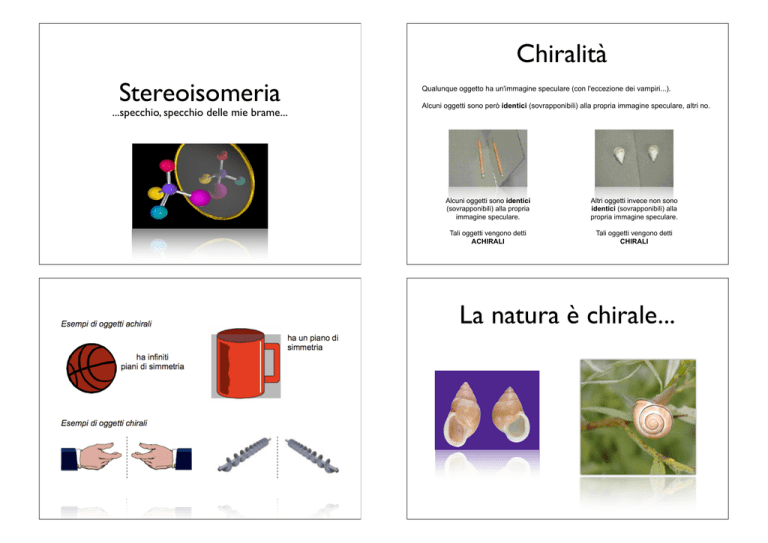
Stereoisomeria
...specchio, specchio delle mie brame...
Qualunque oggetto ha un'immagine speculare (con l'eccezione dei vampiri...).
Alcuni oggetti sono però identici (sovrapponibili) alla propria immagine speculare, altri no.
Alcuni oggetti sono identici
(sovrapponibili) alla propria
immagine speculare.
Altri oggetti invece non sono
identici (sovrapponibili) alla
propria immagine speculare.
Tali oggetti vengono detti
ACHIRALI
Tali oggetti vengono detti
CHIRALI
La natura è chirale...
La natura è chirale...
La natura è chirale...
La natura è chirale...
... ma anche achirale...
simmetria bilaterale
... ma anche achirale...
... ma anche achirale...
simmetria bilaterale
simmetria bilaterale
... ma anche achirale...
... ma anche achirale...
simmetria raggiata
simmetria raggiata
Ma quando una molecola è chirale?
Enantiomeri
Anche le molecole, come tutti gli oggetti possono o non possono essere chirali.
Molecole non sovrapponibili alla propria immagine speculare sono dette chirali.
• 2-butanolo
L’immagine speculare di una molecola chirale si chiama
enantiomero.
La chiralità è condizione necessaria e sufficiente per l’esistenza di due
enantiomeri
Enantiomeri
Cl
• 3-clorocicloesene
Cl
La più comune causa di chiralità è la presenza di un centro stereogenico (o
stereocentro).
Uno stereocentro è di solito un atomo di carbonio tetraderico portante quattro
sostituenti diversi.
Cl
La molecola e la sua
immagine speculare non
sovrapponibile sono
enantiomeri.
Si noti che basta che 2 dei 4 sostituenti ad un carbonio tetraedrico siano uguali
per avere un piano di simmetria
(un piano che taglia in due metà identiche la molecola)
Ad es. nel
clorobromometano vi è
un piano di simmetria
che passa per i due
carboni, per l'ossigeno
e che biseca i due
idrogeni.
Il clorobromometano ha
un piano di simmetria
ed è perciò achirale
• La presenza di atomi di carbonio
asimmetrici suggerisce la possibilità che la
molecola sia chirale.
• Molte, ma non tutte, le molecole che
contengono atomi di C asimmetrici sono
chirali.
Molecole che possiedono piani di simmetria e/o centri di simmetria
sono sovrapponibili alla propria immagine speculare.
Sono quindi achirali.
A proposito di isomeria...
Stereoisomeri: definizioni
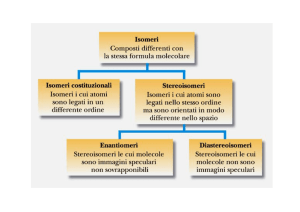
ISOMERI
Composti con la stessa
formula bruta
diversa formula
di costituzione
ISOMERI DI
COSTITUZIONE
Isomeri con un ordine diverso con
cui sono legati gli atomi nelle
molecole
ENANTIOMERI
isomeri collegati da due immagini
speculari non sovrapponibili
uguale formula
di costituzione
STEREOISOMERI
Isomeri con uguale formula di
costituzione, ma con una differente
disposizione spaziale degli atomi o
gruppi che li compongono
DIASTEROISOMERI
stereoisomeri non enantiomeri
• Stereoisomeri: isomeri che hanno la medesima
connettività tra gli atomi ma differente orientazione
3D degli atomi nello spazio.
• Stereoisomeri conformazionali: si interconvertono
per rotazione attorno a un legame.
• Stereoisomeri configurazionali: non possono
interconvertirsi senza rompere legami:
– Enantiomeri: stereoisomeri che sono immagini speculari
non sovrapponibili.
– Diastereomeri: stereoisomeri che non sono immagini
speculari.
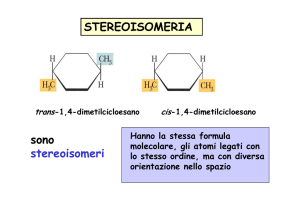
Stereoisomeria: la chimica in 3D
STEREOISOMERI
Due stereoisomeri sono sostanze diverse che
hanno in comune sia la formula bruta che la
formula di costituzione (sequenza degli atomi).
ENANTIOMERI E DIASTEREOISOMERI
Se due stereoisomeri sono l'uno l'immagine speculare non
sovrapponibile dell'altro sono detti enantiomeri.
Altrimenti sono detti diastereoisomeri.
Gli enantiomeri sono molecole con identiche proprietà chimiche,
tranne la capacità di far ruotare la luce polarizzata.
Cosa li rende diversi allora?
I diastereoisomeri sono molecole con proprietà fisiche
completamente diverse.
Una differente orientazione tridimensionale dei loro
atomi nello spazio
Un composto può avere un solo enantiomero, ma più di un
diasteroisomero.
Stereoisomeri con
formula bruta
C3H4Br2
enantiomeri
Trans-1,2-dibromociclopropano
Trans-1,2-dibromociclopropano
Risoluzione di Enantiomeri
Cis-1,2-dibromociclopropano
Cis-1,2-dibromociclopropano
diastereoisomero
Le immagini speculari sono sovrapponibili, quindi sono la stessa
molecola: il Cis-1,2-dibromociclopropano e il Trans-1,2-
dibromociclopropano sono tra loro diastereoisomeri
Enantiomeri: identiche proprietà fisiche;
non possono essere separati.
Diastereomeri: differenti proprietà fisiche,
p.f., p.e., solubilità, etc.; possono essere
separati per distillazione, ricristallizzazione,
cromatografia, etc.
Le Regole di Cahn Ingold Prelog:
Il Sistema di Notazione R-S
Questo ha la maggiore priorità
Questo ha la minore priorità
Le Regole di Cahn Ingold Prelog:
Il Sistema di Notazione R-S
Regola 1. ordinare i sostituenti del C
stereogeno in base alla PRIORITA’.
La priorità si determina in base:
Si guarda il primo atomo legato allo
stereocentro.
Ha maggiore priorità:
a. il gruppo con l'atomo con il più alto
numero atomico
b. in caso di parità, si guardano gli atomi
legati al primo atomo; si confrontano fino
al primo punto di differenza.
c. Un caso speciale è rappresentato dai
carboni coinvolti in un doppio o triplo
legame. Per convenzione si considerano i
legami multipli come più legami semplici.
Regola 2. Si dispone la molecola in
modo che il gruppo con priorità più
bassa sia diretto lontano
dall'osservatore. I rimanenti tre
verranno tutti verso l'osservatore.
Convenzione di Cahn-Ingold-Prelog.
Sistema di nomenclatura R,S
Le Regole di Cahn Ingold Prelog:
Il Sistema di Notazione R-S
2
2
4
4
Senso orario: configurazione R
Regola 3. Si esegue una rotazione
per passare dal gruppo 1 al 2 e poi
al 3.
• Se la rotazione è oraria, la
notazione sarà R (rectus, destra).
1
3
3
• Se antioraria la notazione sarà
S (sinister, sinistra)
RRectus
SSinister
1
Le Regole di Cahn Ingold Prelog:
Il Sistema di Notazione R-S
CONFIGURAZIONE
Con il termine configurazione si intende la disposizione spaziali dei
sostituenti intorno allo stereocentro. Per ogni stereocentro esistono solo 2
configurazioni (2 enantiomeri).
IMPORTANTE
- Se si scambiano di posto due sostituenti, la configurazione si inverte
(R S e S R).
- Se si eseguono due scambi la configurazione rimane la stessa
Importanza biologica degli enantiomeri
I siti dei recettori biologici sono in grado
di discriminare tra configurazione R ed S
di un enentiomero
Attività ottica
Esiste una proprietà fisica che consente di distinguere due
enantiomeri: la
rotazione del piano della luce polarizzata.
Ciascun enantiomero, preso separatamente dall'altro, ha
questa proprietà ed è perciò detto
otticamente attivo.
Attività ottica
Luce non
polarizzata
Luce polarizzata
linearmente
Funzionamento di un
polarimetro
Affinchè una sostanza esibisca attività ottica, deve essere
chirale
un enantiomero deve essere in eccesso rispetto all’altro.
Polarimetro
•
Due enantiomeri ruotano il piano della luce
polarizzata di un angolo identico, ma in
direzioni opposte.
Attività ottica
Attività ottica
La rotazione che viene determinata sperimentalmente al
polarimetro è detta
rotazione osservata
(espressa in gradi).
Per una maggiore uniformità è utile:
Indicare le variabili non proporzionali (λ, T, solvente)
Trasformare la rotazione osservata in una grandezza
indipendente dalla concentrazione e dalla lunghezza della
cella:
ROTAZIONE SPECIFICA
Attività ottica
Attività ottica
Attività ottica
La rotazione che viene determinata sperimentalmente al
polarimetro è detta
rotazione osservata
(espressa in gradi).
Importante differenza
La notazione R/S necessita di conoscere la struttura, ma
può essere stabilita semplicemente guardando la
rappresentazione spaziale della molecola (senza condurre
esperimenti).
La notazione (+)/(–) non necessita di conoscere la
struttura e viene stabilita sperimentalmente
Convenzione di Fischer
Lo scopo delle proiezioni di
Fischer è di mostrare la
configurazione del centro
Attenzione!
Non esiste alcuna relazione tra i due tipi di notazione: non
è possibile dedurre la configurazione R/S dal segno del
potere ottico rotatorio
stereogenico senza la
necessità di disegnare linee
spesse o tratteggiate o di
costruire modelli.
Il sostituente a minore
priorità deve sempre
trovarsi in posizione
verticale: se non lo è, si
opera un numero pari di
scambi tra sostituenti fino
a fargli raggiungere tale
posizione.
Proiezioni di Fischer
A
A
D
B
=
D
B
C
C
A
=
D
C C
B
4
R
1
2
3
Proiezioni di Fischer
• Determinare R e S nelle proiezioni di
Fischer
H
CH3
OH
CH2 CH3
CH3
H
OH
CH2 CH3
(R)-2-butanolo
• quando il gruppo a priorità minore è sulla
verticale (legame dietro): leggere
normalmente
(S)-2-butanolo
• quando il gruppo a priorità minore è
orizzontale (legame davanti): leggere
all’indietro (o leggere normalmente e
invertire R con S)
Stereoisomeri geometrici
• Notazione E-Z per gli alcheni
1. Determinare la priorità più alta fra i due gruppi di
sostituenti sui carboni olefinici, secondo le regole C.I.P.
2. Se i gruppi a maggior priorità sono:
su lati opposti: E (entgegen = opposto)
sullo stesso lato: Z (zusammen = insieme)
CH3 > H
Cl > CH2CH3
Cl
H
C C
H3 C
CH2 CH3
H
C C
CH2 CH3
(E)-3-cloro-2-pentene
H3 C
Cl
(Z)-3-cloro-2-pentene
Assegnazioni D e L
Convenzione di Fischer-Rosanoff
• Prima del 1951, solo le configurazioni relative
potevano essere conosciute.
• Gli zuccheri e gli ammino acidi con la stessa
configurazione relativa della (+)-gliceraldeide furono
chiamati D e quelli con la stessa configurazione
relativa della (–)-gliceraldeide furono chiamati L (con
assegnazione arbitraria).
• Grazie alla cristallografia a raggi X, ora si conoscono
le configurazioni assolute della (+)- e della (–)gliceraldeide: D è (R) e L è (S).
• Non c’è relazione con il segno della rotazione.
CHO
CHO
H *
OH
OH a destra
HO
CH2 OH
H
OH a sinistra
CH2 OH
D-(+)-gliceraldeide
(R)-(+)-gliceraldeide
L-(–)-gliceraldeide
(S)-(–)-gliceraldeide
CHO
H
OH
COOH
H2N
H
CH 2 CH 2 COOH
acido L-(+)-glutammico
carbonio
stereocentro
più vicino al
C meno
ossidato
HO
H
H
C più
ossidato
in alto
H
OH
OH
CH 2 OH
D-(+)-glucosio
C meno
ossidato
in basso