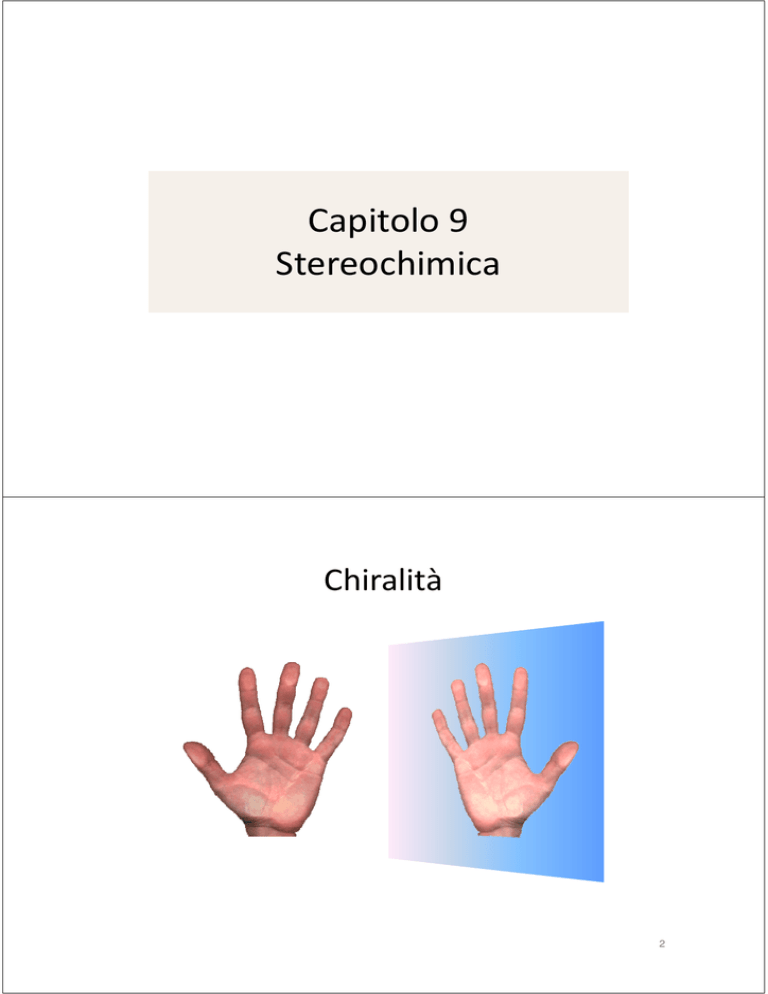
Capitolo 9
Stereochimica
Chiralità
2
Chiralità Molecolare
achirale
achirale
chirale
3
Chiralità Molecolare e Enantiomeri
E’ presente nel latte e nei muscoli
E’ presente nel latte ma non nei muscoli
• Stereoisomeri che sono l’uno l’immagine speculare dell’altro
• Differiscono nella disposizione tridimensionale degli atomi
(Configurazione)
4
Chiralità Molecolare e Enantiomeri
5
Chiralità e Simmetria
Ha un piano di simmetria
Achirale
NON ha un piano di simmetria
Chirale
6
Chiralità Molecolare e Simmetria
7
Chiralità Molecolare
Centro di Chiralità (centro chirale, centro stereogenico, C*)
• carbonio legato a 4 sostituenti diversi
• origine più comune della chiralità
• non possono essere centri chirali: CH2 CH3 C=O C=C C≡C
• N.B.: la chiralità è una proprietà della molecola
8
Chiralità Molecolare
*
9
Proprietà degli Enantiomeri
Proprietà
Acido (+)-lattico
Acido (‒)-lattico
Punto di fusione
53°
53°
Punto di ebollizione
122 °C @ 12 mmHg
122 °C @ 12 mmHg
Acidità (pKa a 25°C)
3.86
3.86
Densità (g/ml)
1.2
1.2
Rotazione specifica [α
α]D25
+3.82
‒3.82
10
Polarizzazione della Luce
Polarizzatore
Polarizzatore
Luce non polarizzata
Luce polarizzata
piana
Luce polarizzata
piana parallela
Luce polarizzata
piana perpendicolare
11
Attività Ottica: Polarimetro
Luce non
polarizzata
Luce
polarizzata piana
Luce polarizzata
piana ruotata
⊕
Sorgente
Polarizzatore
Campione
Rotazione specifica
T
D
[α ] =
α (°)
Osservatore
Polarizzatore
analizzatore
α > 0 ↔ campione destrogiro (+)
α < 0 ↔ campione levogiro (‒)
c ( g / ml ) ⋅ ℓ (dm)
• alla temperatura T
• alla lunghezza d’onda 589 nm (riga D del Na)
• si indicano anche solvente e concentrazione (in g/100ml),
ad es. [α]D +3.82 (c= 0.8, metanolo)
12
Attività Ottica
• [α]D è una costante fisica
• ha un determinato valore (≠ 0) per ogni sostanza chirale
• ha valore opposto per due enantiomeri
acido (+)-lattico [α]D +3.82
acido (‒)-lattico [α]D ‒3.82
13
Chiralità Molecolare e Macroscopica
(+)
(‒)
14
Specificare la Configurazione
Regole di sequenza come E/Z alcheni:
1.
2.
3.
Ordine di peso atomico (maggiore=1, minore=4)
Procedere lungo le catene (–CH2–CH3 > –CH3)
Legami multipli
15
Specificare la Configurazione
Configurazione R
rotazione
oraria
16
Specificare la Configurazione
Configurazione S
rotazione
antioraria
17
18
N.B.: non esiste una correlazione generale tra R/S e +/–
19
Assegnare la
Configurazione Assoluta
• Correlare la proprietà sperimentale (segno di [α]D , ovvero +/‒)
con la struttura molecolare assoluta (ovvero R/S)
• E’ possibile tramite analisi ai raggi X o altri metodi
20
Chiralità agli Eteroatomi
• Un “sostituente” di un centro chirale può essere un doppietto elettronico
• N, P, S (tetraedrici, sp3) possono essere centri chirali
• Nelle regole di configurazione il doppietto ha priorità minore in assoluto
Ammine (R3N:): danno rapida inversione piramidale (via N sp2),
enantiomeri non isolabili
3
3
4
4
1
1
(R)
(S)
2
2
(barriera 25 kJ/mol)
21
Chiralità agli Eteroatomi
Fosfine (R3P:): interconversione lenta, enantiomeri isolabili
4
(S)
2
3
1
3
Sali di solfonio (R3S:+)
4
+
1
2
(donatore biologico di metile)
22
Diastereomeri
• Molecola con n centri di chiralità: fino a 2n stereoisomeri
• Ad es. treonina: due centri chirali, 4 stereoisomeri
2
2
2
2
3
3
3
3
23
enantiomeri
2
2
3
3
diastereomeri
2
2
3
3
enantiomeri
24
Diastereomeri
• Stereoisomeri che non sono immagini speculari
(stereoisomeri che non sono enantiomeri)
Enantiomeri
Diastereomeri
Hanno stesse proprietà chimicofisiche (p. fus., solubilità, densità,
etc.) e opposto [α]
Hanno proprietà chimico-fisiche
distinte
Hanno configurazione opposta di
tutti i centri chirali
Differiscono nella configurazione
di uno o più centri chirali
(ma non tutti)
• Prodotti naturali: normalmente singoli stereisomeri
[ad es. solo (2S,3R)-treonina è l’amminoacido essenziale]
25
Diastereomeri
Epimeri
• Diastereomeri che differiscono nella configurazione
di un solo centro chirale
26
Composti Meso
?
≠
Acido tartarico
27
Composti Meso
28
Composti Meso
• Molecole achirali ma che contengono centri chirali
29
Racemati e Risoluzione degli Enantiomeri
Racemati o miscele raceme
•
•
•
•
Miscela 50:50 dei due enantiomeri
Simbolo (±) o prefisso d,l
Rotazione ottica nulla
Risoluzione: separazione nei due enantiomeri
H
HOOC
HO
CH3
50%
H
[ ]0
H3C
COOH
OH
50%
(‒)
(+)
(±)
30
Risoluzione degli Enantiomeri
31
Risoluzione degli Enantiomeri
32
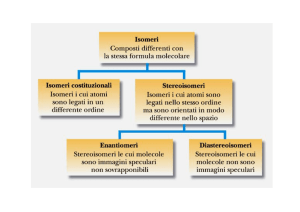
Isomeria - riassunto
Isomeri: composti che hanno stessa formula bruta
ma diversa struttura
1. Isomeri costituzionali
–
Diverse connessioni tra gli atomi
•
•
•
Diverso scheletro
Diversi gruppi funzionali
Diversa posizione dei gruppi funzionali
33
Isomeria - riassunto
2. Stereoisomeri
–
•
Stesse connessioni ma diversa geometria
Enantiomeri
sono immagini speculari
34
Isomeria - riassunto
• Diastereomeri
Non sono immagini speculari
Cis/trans
Configurazionali
35
Isomeria - riassunto
Isomeri
Isomeri
costituzionali
Stereoisomeri
Diastereomeri
Diastereomeri
configurazionali
Enantiomeri
Diastereomeri
cis/trans
36
Stereochimica delle Reazioni
Addizione di H2O ad un Alchene Achirale
• Reazioni tra substrati otticamente inattivi portano a prodotti
otticamente inattivi
• Reazioni tra substrati achirali portano a prodotti achirali oppure,
se chirali, in forma racema
37
Stereochimica delle Reazioni
Addizione di H2O ad un Alchene Achirale
38
Stereochimica delle Reazioni
Addizione di H2O ad un Alchene Chirale
• La reazione tra un substrato chirale e un reagente achirale porta a prodotti
enantiomerici o diastereomerici
• Se il substrato è otticamente attivo (ad es., singolo enantiomero)
lo è anche il prodotto
39
Stereochimica delle Reazioni
Addizione di H2O ad un Alchene Chirale
40
X
Stereochimica delle Reazioni
Addizione di H2O ad un Alchene Achirale
• Reazioni biologiche tra substrati achirali possono portare
a prodotti chirali otticamente attivi (ruolo degli enzimi)
(uno stadio del ciclo dell’acido citrico)
41
Prochiralità
Molecola Prochirale
• Può essere convertita in una molecola chirale in un solo passaggio
– Faccia prochirale: atomo trigonale convertibile in tetraedrico chirale
– Centro prochirale: atomo tetraedrico convertibile in un centro chirale
cambiando uno dei sostituenti
42
Faccia Prochirale
• Carbonio sp2 con sostituenti diversi (alchene, carbonile)
• Descrittori Re/Si: usati per distinguere le due facce prochirali
‒ Priorità come nella nomenclatura R/S
‒ Rotazione oraria o antioraria 1→2→3
43
Centro Prochirale
• Carbonio sp3 con due sostituenti uguali
• Descrittori pro-R/pro-S: usati per distinguere i due gruppi
‒ Priorità come nella nomenclatura R/S
‒ Si innalza la priorità di uno dei due sostituenti uguali senza
intaccare la scala di priorità, es. H(4)→D(3) (D=2H=deuterio)
‒ L’H che sostituito porta a substrato R si dice pro-R
‒ L’H che sostituito porta a substrato S si dice pro-S
44
Bio-prochiralità
• Ciclo dell’acido citrico: addizione di H2O al fumarato, dalla faccia Si
• Alcol deidrogenasi del lievito: coinvolge l’H pro-R dell’etanolo
e la faccia Re del coenzima NADH
45
Chiralità in Natura
Gli enantiomeri di una molecola chirale
– hanno stesse proprietà chimico-fisiche
– di solito hanno proprietà biologiche distinte
(ad es. odore, attività farmacologica, etc.)
46
Chiralità in Natura
• Ibuprofene (Moment)
– Enantiomero R: analgesico, anti-infiammatorio
– Enantiomero S: inattivo, inibisce leggermente l’(R)
– Commercializzato come racemato
O
(R)
HO
47
Chiralità in Natura
• Talidomide
– Enantiomero R: sedativo, anti-emetico
– Enantiomero S: teratogeno
(S)
(R)
48
Chiralità in Natura
• L’attività biologica dipende dalle interazioni con recettori
specifici, es. enzimi (chirali)
• Complementarietà chiave/serratura
49
Chiralità in Natura
• Alcol deidrogenasi del lievito: coinvolge solo l’H pro-R dell’etanolo
50