La chiralità nelle molecole organiche
Prima di affrontare il tema richiesto, occorre fare una piccola introduzione
sulla stereochimica, che studia gli aspetti tridimensionali della struttura
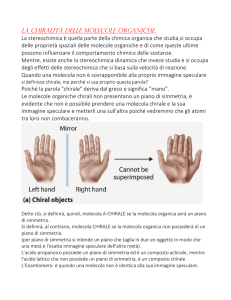
delle molecole. Quando una molecola non è identica alla sua immagine
speculare essa è un particolare tipo di stereoisomero detto enantiomero.
Le molecole che hanno immagini speculari non sovrapponibili sono dette
chirali, ovviamente non sarà possibile prendere una molecola chirale e la
sua immagine speculare e metterli una sull’altra in modo che tutti gli atomi
combacino. La chiralità è una proprietà della molecola nel suo insieme.
Una molecola che possiede un piano di simmetria, ovvero un piano che
taglia in due una molecola in modo che un metà è l’esatta immagine
speculare dell’altra metà, NON è chirale.
La causa più comune perché una molecola organica sia chirale è la
presenza di un atomo di carbonio tetraedrico legato a quattro gruppi tutti
differenti. Tali atomi di carbonio sono detti centri chirali o stereocentri.
(Bisogna sempre ricordare che i carboni CH2, CH3, C=C, C=O, e il triplo
legame carbonio carbonio, non possono essere stereocentri perché, come
minimo, presentano due legami uguali).
Una delle proprietà delle molecole chirali è l’attività ottica. Quando un
raggio di luce ordinaria passa attraverso un polarizzatore, questo è in grado
di far passare solo le onde che oscillano su di un piano ben preciso: da qui
il nome di luce piano-polarizzata. Quando la luce polarizzata interagisce
con una sostanza chirale, il suo piano di polarizzazione cambia la sua
orientazione rispetto alla direzione di propagazione: tale distorsione è nota
come rotazione ottica, quindi l’attività ottica è la capacità di una sostanza,
detta otticamente attiva, di far ruotare il piano della luce polarizzata.
L’angolo di rotazione si indica con la lettera greca α.
Oltre all’angolo si determina anche la direzione della rotazione. Alcune
molecole otticamente attive ruotano il piano a sinistra, ovvero in senso
antiorario, e perciò si dicono levogire (prendono il segno meno), altre lo
ruotano a destra, in senso orario, e si dicono destrogire (prendono il segno
più).
Per attribuire un nome ad ogni centro chirale occorre utilizzare la
configurazione R o S. L’assegnazione di tale configurazione segue tre
regole:
1) Si considerano i quattro atomi direttamente legami allo stereocentro e
si assegna loro le priorità in ordine di numero atomico decrescente.
L’atomo col numero atomico più alto viene per primo, quello col
numero atomico più basso viene per quarto.
2) Se non si è in grado di giungere ad un ordine univoco sulla base dei
primi atomi dei sostituenti, si confrontano i numeri atomici degli
atomi che vengono per secondi, per terzi o per quarti, finché non si
trova una differenza.
3) Gli atomi che portano legami multipli vanno considerati equivalenti
ad un ugual numero di atomi con legami semplici.
Dopo aver assegnato le priorità ai quattro gruppi legati ad uno
stereocentro, possiamo stabilire la configurazione attorno a questo atomo
di carbonio orientando la molecola in modo che il gruppo con la priorità
più bassa (4) punti in direzione opposta rispetto a quella dell’osservazione.
(Occorre, sempre, effettuare un numero pari di rotazioni). Se per passare
dal gruppo a priorità più alta, a quello a priorità immediatamente inferiore,
a quello a priorità ancora più bassa (123) si deve ruotare in senso
orario, lo stereocentro avrà configurazione R; al contrario se si deve
ruotare in senso antiorario, lo stereocentro avrà configurazione S.
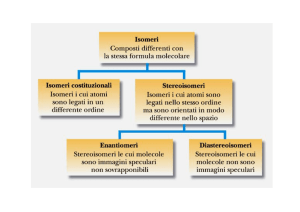
Quando ci sono due stereocentri, sono possibili quattro stereoisomeri,
ovvero due coppie di enantiomeri (immagini speculari); gli stereoisomeri
che non sono immagini speculari sono detti diastereomeri. Gli
enantiomeri hanno configurazioni opposte in tutti gli stereocentri, mentre i
diastereomeri hanno configurazioni opposte solo in qualche stereocentro,
ma la stessa configurazione in qualche altro stereocentro. In generale, una
molecola con n stereocentri dà origine a un massimo di
stereoisomeri
(
coppie di enantiomeri). Esiste, però, un’eccezione a riguardo
quando si parla dei composti meso. Essi presentano degli stereocentri, ma
sono complessivamente achirali in quanto possiedono un piano di
simmetria che taglia perpendicolarmente il legame C2-C3 rendendo una
metà della molecola l’immagine speculare dell’altra metà.