ISOMERIA ISOMERIA
e
STEREOISOMERIA
1
ISOMERIA COSTITUZIONALE e STEREOISOMERIA
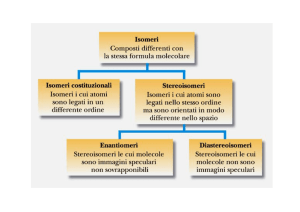
ISOMERI
composti che hanno la stessa formula molecolare, ma che differiscono in ,
termini di struttura.
ISOMERI COSTITUZIONALI
differiscono per il modo in cui gli atomi sono legati tra loro
atomi sono legati tra loro.
ISOMERI CONFORMAZIONALI molecole interconvertibili per rotazione intorno a uno o più legami singoli
STEREOISOMERI presentano la stessa connettività tra gli atomi ma differiscono tra loro per
gli atomi, ma differiscono tra loro per il modo in cui i legami tra gli atomi sono orientati nello spazio. ISOMERI CONFIGURAZIONALI molecole non interconvertibili per semplice rotazione intorno a legami singoli
2
ISOMERIA COSTITUZIONALE e STEREOISOMERIA
ISOMERI COSTITUZIONALI
C7H16O
ISOMERI CONFORMAZIONALI
3
ISOMERIA COSTITUZIONALE e STEREOISOMERIA
ISOMERI CONFIGURAZIONALI
molecole non interconvertibili per
molecole non interconvertibili per semplice rotazione intorno a legami singoli
ENANTIOMERI
stereoisomeri che sono immagini t
i
i h
i
i i
speculari non sovrapponibili.
DIASTEREOISOMERI stereoisomeri non sovrapponibili ma
stereoisomeri non sovrapponibili ma che non sono immagini speculari.
4
STEREOISOMERIA:: ISOMERIA CONFIGURAZIONALE
STEREOISOMERIA
ENANTIOMERI
DIASTEREOISOMERI
5
STRUTTURE TRIDIMENSIONALI
OH
H
Et
Me
OH
H
Et
Me
6
CHIRALITÀ
Le molecole che non sono sovrapponibili l l h
bl
alla loro immagine speculare sono dette chirali.
chirale: dal greco cheir = mano
Una molecola che manca di chiralità
viene detta achirale.
7
CHIRALITÀ: elementi di simmetria
CHIRALITÀ: Piano e asse di simmetria
d
PIANO DI SIMMETRIA: è il piano ideale
che divide la molecola in due parti
specularmente
p
identiche.
ASSE DI SIMMETRIA: è l’asse ideale
attorno al quale è possibile far ruotare la
molecola di un determinato numero di
gradi, in modo tale che tutte posizioni
occupate dai vari elementi della
molecola
l l prima
i
d ll rotazione
della
t i
siano
i
occupati, dopo la rotazione, da elementi
uguali.
8
Come stabilire se una molecola è chirale?
Verificare la sovrapponibilità o meno alla sua immagine speculare.
Verificare la presenza del piano di simmetria.
Nel caso sia presente, la molecola è achirale.
9
CENTRO di CHIRALITÀ e CENTRO STEREOGENICO
Centro di chiralità (elemento stereogenico)
Un
atomo
ibridato
sp3
(tetraedrico) a cui sono legati
quattro atomi o gruppi di atomi
diversi tra loro viene chiamato
CENTRO di CHIRALITÀ .
Il centro chirale rappresenta un caso particolare di centro stereogenico.
10
NOMENCLATURA DEGLI ENANTIOMERI
IL SISTEMA (R
IL SISTEMA (R,S): Convenzione di Cahn, Ingold e Prelog
La distribuzione spaziale degli atomi che caratterizza un dato La
distribuzione spaziale degli atomi che caratterizza un dato
stereoisomero si chiama configurazione. La distribuzione spaziale degli atomi intorno a uno stereocentro è p
g
specificata usando una serie di regole di priorità.
S (sinister)
movimento antiorario
movimento antiorario
R (rectus)
movimento orario
movimento orario
11
NOMENCLATURA DEGLI ENANTIOMERI
REGOLE DI PRIORITÀ
À
1. La priorità è basata sul
p
numero atomico: q
quanto più il numero p
atomico è alto, tanto maggiore è la priorità. Il numero atomico di un elemento è il numero dei protoni nel nucleo. ‐H, ‐CH3, NH2, OH, ‐SH, ‐Cl, ‐Br, ‐I
priorità crescente
3
1
R
senso orario
i
2
12
NOMENCLATURA DEGLI ENANTIOMERI
REGOLE DI PRIORITÀ
À
2. Se la priorità non può essere assegnata sulla base del numero
atomico degli atomi direttamente legati allo centro chirale, si guarda alla serie successiva di atomi e si continua in questo modo fino a quando non si riesce ad assegnare un ordine di priorità.
q
g
p
‐CH2‐H, ‐CH2‐CH3, ‐CH2‐NH2, ‐CH2‐OH, ‐CH2‐Cl
priorità crescente
priorità crescente
3
CH3
R
CH2OH 1
CH2CH3
H
senso orario
senso orario
2
13
NOMENCLATURA DEGLI ENANTIOMERI
REGOLE DI PRIORITÀ
À
3. Gli atomi che fanno parte di un doppio o triplo legame sono considerati come legati a un numero equivalente di legami semplici, sempre riferiti allo stesso atomo.
3
2
S
senso antiorario
1
14
NOMENCLATURA DEGLI ENANTIOMERI
ALCUNI ESEMPI
15
PROIEZIONI DI FISCHER
Significato
(S) 2 b t
(S)‐2‐butanolo
l
• Rappresentazione planare di Rappresentazione planare di
una molecola tridimensionale.
•Il centro di chiralità si trova l
d h l à
nell’intersezione delle 4 linee
formula tridimensionale
•Le linee orizzontali sono rivolte verso l’osservatore
•Le linee verticali si allontanano dall’osservatore
proiezione di Fischer
16
PROIEZIONI DI FISCHER
R l
Regole per manipolare le proiezioni di Fischer
i l
l
i i i di Fi h
Non ruotare la molecola di 90° sul piano del foglio. Tale rotazione genera una struttura enantiomerica
Tale rotazione genera una struttura enantiomerica CH3
H
OH
CH2CH3
(S)‐2‐butanolo
H
OH
(R)‐2‐butanolo
H3CH2C CH3
17
PROIEZIONI DI FISCHER
R l
Regole per manipolare le proiezioni di Fischer
i l
l
i i i di Fi h
Non ruotare la molecola di 180° staccandola dal piano del foglio.
Tale rotazione genera una struttura enantiomerica
Tale rotazione genera una struttura enantiomerica ( ) b
(S)‐2‐butanolo
l
CH3
H
OH
CH2CH3
conversione nella
rappresentazione
i
tridimensionale
CH3
HO
H
CH2CH3
(R)‐2‐butanolo
18
PROIEZIONI DI FISCHER
R l
Regole per manipolare le proiezioni di Fischer
i l
l
i i i di Fi h
La rotazione di 180° sul piano del foglio è l’unica consentita.
(S)‐2‐butanolo
CH3
H
OH
CH2CH3
conversione nella
rappresentazione
tridimensionale
CH2CH3
HO
H
CH3
(S)‐2‐butanolo
HO
H
H3C CH2CH3
19
PROPRIETÀ DEGLI ENANTIOMERI
Stessi punti di ebollizione , punti di fusione, densità, indice di rifrazione , solubilità in solventi achirali ecc.
Differenti direzioni di rotazione della luce polarizzata
Differenti interazioni con le molecole chirali (enzimi, recettori)
20
ATTIVITÀ OTTICA
L’attività ottica è definita come la capacità di far ruotare il piano di polarizzazione di un fascio di luce linearmente polarizzata.
L’attività ottica di una sostanza può essere misurata dal polarimetro.
Ogni membro di una coppia di enantiomeri ruota il piano della luce polarizzata. Per questa ragione si dice che gli enantiomeri sono l i t P
t
i
i di
h li
ti
i
otticamente attivi. Una miscela racemica, pur contenendo composti chirali, è priva di attività ottica.
21
POTERE ROTATORIO SPECIFICO
angolo di rotazione misurato
l di t i
i
t
cammino ottico(dm)
concentrazione del campione (g/mL)
H
OH
H3CH2C CH3
(R)‐2‐butanolo
α25
13 52°
D = − 13,52
(S)‐2‐butanolo
α25
13 52°
D = + 13,52
22
MOLECOLE con DUE o PIÙ CENTRI di CHIRALITÀ
L’eccesso enantiomerico (sinonimo di purezza ottica) è l’eccesso di un enantiomero rispetto alla miscela R,S in una miscela R,S.
un enantiomero rispetto alla miscela R,S in una miscela R,S.
Orchin, M et al. “The Vocabulary of Organic Chemistry”
John Wiley & Sons 1980
John Wiley & Sons, 1980
ee = % di un enantiomero‐ % dell’altro enantiomero
23
MOLECOLE CON PIÙ DI UN CENTRO CHIRALE Per una molecola che contiene n centri chirali, il numero massimo di possibili stereoisomeri è 2n 2 centri chirali : 22 = 4 stereoisomeri
Composti con più centri chirali possono essere achirali (composti meso)
Viene detto composto meso un diastereoisomero non planare che è otticamente non attivo a causa
non planare che è otticamente non attivo a causa della presenza di un elemento di simmetria in una delle sue possibili conformazioni.
HO
COOH
HO
COOH
24
MOLECOLE CON PIÙ DI UN CENTRO CHIRALE Per una molecola che contiene 2 centri chirali, il numero massimo di possibili stereoisomeri è 22 2 centri chirali : 22 = 4 stereoisomeri
25
MOLECOLE CON PIÙ DI UN CENTRO CHIRALE 26