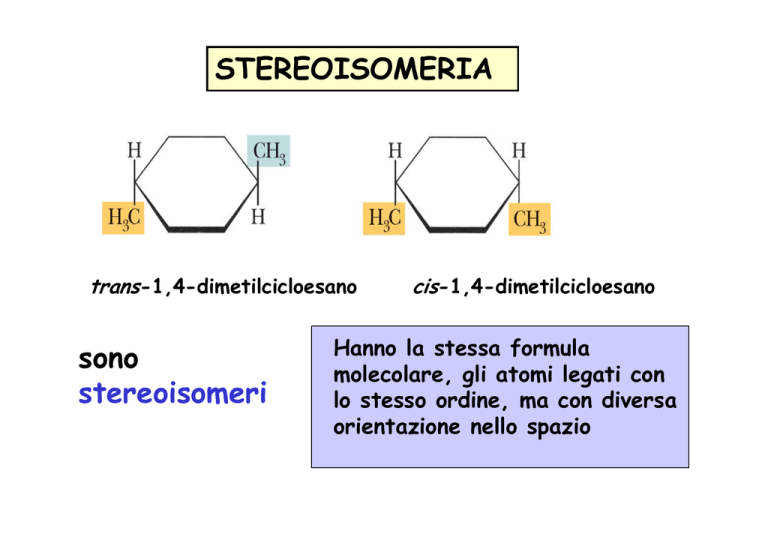
STEREOISOMERIA
trans-1,4-dimetilcicloesano
sono
stereoisomeri
cis-1,4-dimetilcicloesano
Hanno la stessa formula
molecolare, gli atomi legati con
lo stesso ordine, ma con diversa
orientazione nello spazio
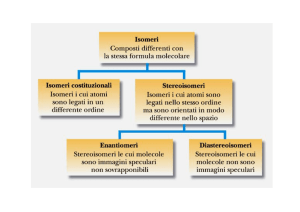
ISOMERI
Composti differenti con la stessa formula molecolare
ISOMERI
COSTITUZIONALI
(STRUTTURALI)
gli atomi della molecola
sono legati con un ordine
diverso
STEREOISOMERI
Hanno la stessa formula
molecolare, gli atomi
legati con lo stesso
ordine, ma con diversa
orientazione nello spazio
STEREOISOMERI
STEREOISOMERI
CONFIGURAZIONALI
ENANTIOMERI
Stereoisomeri le cui molecole
sono l’una l’immagine speculare
dell’altra (non sovrapponibili)
CONFORMAZIONALI
DIASTEREOISOMERI
Stereoisomeri le cui molecole
non sono l’una l’immagine
speculare dell’altra
ISOMERI
Composti differenti con
la stessa formula molecolare
ISOMERI
COSTITUZIONALI
gli atomi della molecola sono
legati con un ordine diverso
O
Formula Molecolare:
STEREOISOMERI
gli atomi legati con lo stesso ordine,
ma con diversa orientazione
nello spazio
OH
C3H8O
ISOMERI
Isomeri
Costituzionali
Stereoisomeri
Isomeri
Configurazionali
Formalmente
Formalmente possono
possono
esser
esser interconvertiti
interconvertiti solo
solo
attraverso
attraverso la
la rottura
rottura ee la
la
riformazione
riformazione di
di legami
legami
Isomeri
Conformazionali
Possono
Possono esser
esser interconvertiti
interconvertiti attraverso
attraverso la
la
rotazione
rotazione attorno
attorno ad
ad un
un legame
legame
CH3
CH3
ISOMERI
Isomeri
Costituzionali
Stereoisomeri
Isomeri
Configurazionali
Isomeri Ottici
Differiscono
Differiscono nella
nella relazione
relazione
tridimensionale
tridimensionale relativa
relativa dei
dei
sostituenti
sostituenti su
su uno
uno oo più
più
atomi
atomi
Isomeri
Conformazionali
Isomeri
Geometrici
L’impedita
L’impedita rotazione
rotazione aa
livello
livello di
di un
un ciclo
ciclo oo di
di un
un
legame
legame multiplo
multiplo determina
determina
la
la disposizione
disposizione spaziale
spaziale
relativa
relativa degli
degli atomi
atomi
ISOMERI
Isomeri
Costituzionali
Stereoisomeri
Isomeri
Configurazionali
Isomeri
Geometrici
Isomeri Ottici
Enantiomeri
Diastereoisomeri
HO H
HO H
H
OH
HO
Isomeri
Conformazionali
H
Stereoisomeri
Stereoisomeri le
le cui
cui molecole
molecole sono
sono
l’una
l’una l’immagine
l’immagine speculare
speculare dell’altra
dell’altra
(non
(non sovrapponibili)
sovrapponibili)
HO
H
H
Stereoisomeri
Stereoisomeri le
le cui
cui molecole
molecole
non
non sono
sono l’una
l’una l’immagine
l’immagine
speculare
speculare dell’altra
dell’altra
OH
Enantiomeri e Chiralità
Un qualsiasi oggetto si definisce CHIRALE
quando non è sovrapponibile alla propria
immagine speculare
Esempi: la mano, una vite, un guanto, ecc.
ACHIRALE è un oggetto privo di chiralità
Esempi: un cubo, una sfera, un cucchiaio, ecc.
In genere un oggetto achirale possiede uno o più elementi di
simmetria (generalmente, un piano di simmetria)
Oggetti achirali
Piano di simmetria
Piani di
simmetria
Piano di
simmetria
Oggetti chirali
Non presentano piani di simmetria
Conchiglia
Il caso più tipico di chiralità nei composti organici è dato
da un carbonio tetraedrico con quattro sostituenti diversi
Molecole Chirali
La più comune (ma non l’unica) causa di chiralità
nelle molecole è la presenza di uno STEREOCENTRO
(carbonio chirale o asimmetrico)
STEREOCENTRO:
(carbonio chirale
o asimmetrico)
Un atomo tetraedrico (carbonio)
che ha legati quattro atomi (o
gruppi) diversi
Carbonio chirale (stereocentro)
Il 2-clorobutano
e’ una molecola chirale
Il 2-clorobutano è una molecola chirale:
non è sovrapponibile alla propria immagine
speculare
I
specchio
II
Le due molecole I e II sono due
ENANTIOMERI
Enantiomeria e Chiralità
Molecole Chirali
A
A
D
C
B
D
B
C
asse di rotazione
specchio
rotazione
di 180°
A
A
sovrapposizione
B
D
C
B
A
C
B
D
A
C
D
B
D
C
Il 2-clorobutano esiste in due forme
enantiomeriche (due stereoisomeri)
come distinguerli e attribuire loro nomi diversi?
Il sistema di nomenclatura R, S designa la
configurazione di uno stereocentro (carbonio chirale)
Carbonio con
configurazione R
(R)-2-clorobutano
Carbonio con
configurazione S
(S)-2-clorobutano
Il sistema R, S fu ideato alla fine degli anni 50 da Cahn,
Ingold e Prelog
Come si attribuisce la configurazione R o S
ad un carbonio chirale?
1. Identificare lo stereocentro e i gruppi ad esso legati
2. Assegnare una priorità ai gruppi da 1 (più alta)
a 4 (più bassa)
1
4
3
2
La priorità si assegna in
base al numero atomico
dell’atomo legato allo
stereocentro
1
4
3
Perché l’etile ha priorità
maggiore rispetto al
metile?
2
-CH3
Il C ha legati 3 H
-CH2-CH3
Il C ha legati 2 H e un C
(prevale nella scala di priorità)
3. Orientare la molecola nello spazio in modo che il
gruppo a priorità minore (4) sia diretto lontano
dall’osservatore, (come può esserlo la canna dello
sterzo di una automobile)
Senso
1 orario
1
R
4
3
2
3
2
4. Partendo dal gruppo a priorità maggiore (1) leggere i tre
gruppi. Si individua così un senso di rotazione.
Se il senso è orario il carbonio chirale sarà R
Se il senso di rotazione è antiorario il carbonio chirale sarà S
Assegniamo la configurazione
Assegniamo la
priorità ai gruppi
Orientiamo la molecola in modo
che il gruppo 4 sia il più lontano
dall’osservatore e individuiamo
il senso di rotazione per
procedere da 1 a 3
Senso antiorario: la configurazione è S
Cl
Enantiomeria e Chiralità
Proiezioni di Fischer
H
H
CH3
OH
Cl
I legami
verticali sono
lontani
dall’osservatore
Cl
OH
CH3
Proiezione di Fischer
H
Cl
OH
CH3
I legami orizzontali si
dirigono verso
l’osservatore
Assegniamo la configurazione
3-clorocicloesene
equivale a
Molecole acicliche con più di due stereocentri
Numero di stereoisomeri
(massimo possibile)
= 2n (n = numero
di stereocentri)
Una molecola con due carboni chirali esisterà
in quattro (22) forme stereoisomeriche
Esempio:
2,3,4-triidrossibutanale
Una coppia di enantiomeri
eritrosio
Una coppia di enantiomeri
treosio
Due elementi di coppie diverse sono tra loro
DIASTEREOISOMERI
Esempio:
stereoisomeri del 1,2,3-butantriolo
(1) e (4) sono enantiomeri
(2) e (3) sono enantiomeri
Isomeri Ottici
Enantiomeri
Diastereoisomeri
Stereoisomeri le cui molecole
sono l’una l’immagine speculare
dell’altra (non sovrapponibili)
Stereoisomeri le cui molecole
non sono l’una l’immagine
speculare dell’altra
Composto meso
Molecola achirale che possiede due o più stereocentri
L’acido tartarico dovrebbe esistere
in quattro forme stereoisomeriche
in realtà ne esistono solo tre
Coppia di enantiomeri
Composto meso
(achirale)
Esempio :
quali composti sono enantiomeri e qual è il composto
meso?
Molecole cicliche con due o più stereocentri
Derivati del ciclopentano
cis
trans
enantiomeri
enantiomeri
trans
cis
Composto meso
enantiomeri
Derivati del cicloesano
trans
cis
enantiomeri
enantiomeri
trans
cis
composto meso
enantiomeri
Proprietà degli stereoisomeri
Gli enantiomeri hanno identiche proprietà chimiche e fisiche
I diastereoisomeri hanno diverse proprietà chimiche e fisiche
Come è possibile distinguere e separare gli enantiomeri?
Gli enantiomeri interagiscono in maniera diversa in
ambiente chirale, ad esempio con la luce polarizzata e
con altre molecole chirali
Cosa è la luce polarizzata?
Luce polarizzata
Filtro polarizzatore
Luce polarizzata:
Luce che vibra in
un solo piano
Sorgente
luminosa
luce non polarizzata
Piano della
luce polarizzata
Polarimetro
Filtro polarizzatore
Tubo contenente
la sostanza
Filtro ruotante
Sorgente
luminosa
Compos
to
otticam
ente a
ttivo
Piano della
luce polarizzata
Consente di stabilire la rotazione
del piano della luce polarizzata
Un enantiomero è un composto otticamente attivo
Rotazione specifica = []d
[]d =
rotazione osservata (gradi)
Lunghezza (dm) x Concentrazione (g/ml)
(S)-(+)-2-butanolo
[]d = +13.52
(R)-(-)-2-butanolo
[]d = -13.52
Miscela racemica
Una miscela equimolecolare di due enantiomeri
50%
(S)-(+)-2-butanolo
50%
(R)-(-)-2-butanolo
Una miscela racemica, analizzata al polarimetro, non farà
ruotare il piano della luce polarizzata: []d = 0
Separazione di enantiomeri
Risoluzione di miscele racemiche
Si può trasformare la coppia di enantiomeri in
una coppia di diastereoisomeri mediante la
reazione con un reagente di risoluzione
Una reazione utile alla risoluzione chimica di una
miscela racemica è la formazione di sali
RCOOH + :B
RCOO-HB+
Acido
Base
carbossilico
Sale
(+)-cinconina
cinconina
Acido (R,S) mandelico
meno solubile
Coppia di diastereoisomeri
più solubile
Separazione per cristallizzazione
Addizione di HCl e separazione
dalla cinconina
Enzimi quali agenti risolventi
gli enzimi sono capaci di distinguere gli enantiomeri
Estere etilico dell’(S)-Naprossene
Enzima esterasi
Estere etilico dell’(R)-Naprossene
(non è attacato dalle esterasi)
Il sale sodico del Naprossene è il principio
attivo di numerose preparazioni di farmaci
anti-infiammatori non steroidei
Perché gli enzimi hanno la capacità di distinguere gli
enantiomeri e quindi di reagire con uno solo di questi?
Substrato
Superficie dell’enzima
Tre interazioni
corrette
Superficie dell’enzima
Due interazioni
corrette
Gli enzimi sono essi stessi specie chirali quindi
producono o reagiscono solo con sostanze che hanno
una ben determinata chiralità per ogni stereocentro
Tutte le biomolecole (molecole prodotte dal
metabolismo degli esseri viventi) sono sostanze chirali
La maggior parte dei farmaci noti
sono composti chirali
Captopril
Enzima
L-DOPA
Dopamina
(S)-Ibuprofen