Isomeria costituzionale negli alcani
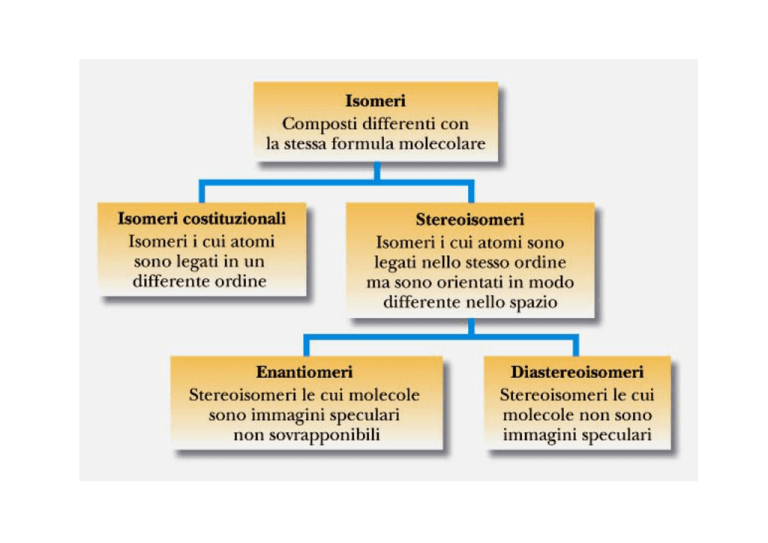
Isomeri costituzionali (strutturali): composti con uguale formula
molecolare ma diversa formula di struttura (con un diverso
ordine con cui sono legati i loro atomi).
C4H10
Hanno la stessa formula molecolare C4H10.
C4H10
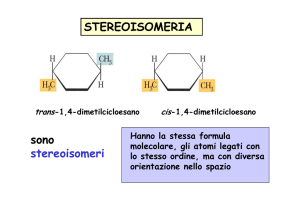
Stereoisomeria
Gli stereoisomeri hanno la stessa formula molecolare, gli atomi legati
con lo stesso ordine, ma con diversa orientazione tridimensionale
nello spazio.
Enantiomeria
Gli enantiomeri sono stereoisomeri che sono immagini speculari non
sovrapponibili l’uno dell’altro.
2-butanolo
2-propanolo
Enantiomeri e Chiralità
Un qualsiasi oggetto si definisce CHIRALE quando non è
sovrapponibile alla propria immagine speculare.
Es. La mano, una vite
ACHIRALE è un oggetto privo di chiralità,
sovrapponibile alla propria immagine speculare
cioè
Es. Un cubo, una sfera, un cucchiaio etc.
In genere un oggetto achirale possiede almeno un piano di
simmetria, mentre uno chirale non né possiede.
Molecole Chirali
La più comune (ma non l’unica) causa di chiralità nelle
molecole è la presenza di uno STEREOCENTRO
(carbonio chirale o asimmetrico)
STEREOCENTRO:
(carbonio chirale
o asimmetrico)
Un atomo tetraedrico (carbonio) che ha
legati quattro atomi (o gruppi) diversi
Carbonio chirale (stereocentro)
2-clorobutano
È una molecola chirale
Il 2-clorobutano è una molecola chirale: non sovrapponibile
alla propria immagine speculare
Esiste in due forme di stereoisomeri (enantiomeri)
I
specchio
II
Le due molecole I e II sono due ENANTIOMERI.
Gli enantiomeri sono molecole che sono l’una l’immagine
speculare dell’altra e non sono sovrapponibili
A
A
D
D
C
B
B
C
asse di rotazione
specchio
rotazione
di 180°
A
A
A
C
B
D
sovrapposizione
B
D
C
B
A
C
D
B
D
C
Cl
F
Cl
OH
H
HO
H
F
Rappresentazione degli enantiomeri
OH
H
C
H3C
H
CH2CH3
H
OH
OH
OH
C
H3C
CH2CH3
Differenti rappresentazioni di un enantiomero del 2-butanolo
OH
un enantiomero
del 2-butanolo
OH
OH
Rappresentazioni alternative della sua
immagine speculare
Il 2-clorobutano esiste in due forme enantiomeriche
(due stereoisomeri)
come distinguerli e attribuire loro nomi diversi?
Il sistema di nomenclatura R, S designa la
configurazione di uno stereocentro (carbonio chirale)
Carbonio con
configurazione R
(R)-2-clorobutano
Carbonio con
configurazione S
(S)-2-clorobutano
Denominazione degli stereocentri: il sistema R,S
Il sistema R, S fu ideato alla fine degli anni 50 da Cahn, Ingold e Prelog
Come si attribuisce la configurazione R o S ad un carbonio
chirale?
1. Identificare lo stereocentro e i gruppi ad esso legati
2. Assegnare una priorità ai gruppi da 1 (più alta)
a 4 (più bassa)
1
4
3
2
La priorità si assegna in base al
numero atomico dell’atomo legato
allo stereocentro
1
Perché l’etile ha priorità
maggiore rispetto al metile?
4
3
2
-CH3
Il C ha legati 3 H
-CH2-CH3
Il C ha legati 2 H e un C
(prevale nella scala di priorità)
REGOLE DI PRIORITA’
1) In base al numero atomico: più alto è il numero atomico, più alta è la
priorità.
H
CH3
NH2
OH
SH
Cl
Br
I
2) Se la priorità non può essere assegnata dal numero atomico, si osserva
il gruppo di atomi successivo e si continua fino a quando la priorità può
essere assegnata.
CH2 H
CH2 CH3
CH2 NH2
CH2 OH
CH2 Cl
3) Nei gruppi contenenti carboni sp2 e sp, questi devono essere trattati in
modo da massimizzare il numero di gruppi ad esso legati.
CH
CH2
C
C
O
O
C
CH
CH2
CH
C
O
H
3. Orientare la molecola nello spazio in modo che il gruppo a
priorità minore (4) sia diretto lontano dall’osservatore, (come
può esserlo la canna dello sterzo) di una automobile
Senso
1 orario
1
R
4
3
2
3
2
4. Partendo dal gruppo a priorità maggiore (1) leggere i tre
gruppi individuando in questo modo un senso di rotazione. Se il
senso è orario il carbonio chirale sarà R. Se il senso di rotazione
è antiorario il carbonio chirale sarà S.
Assegniamo la configurazione
Assegniamo la
priorità ai gruppi
Orientiamo la molecola nel modo
corretto e individuiamo il senso di
rotazione.
Senso antiorario: la configurazione è S
Cl
Proiezioni di Fisher
I legami
verticali si
allontanano
dall’osservatore
H
Cl
CH 3
OH
H
Cl
OH
CH 3
I legami orizzontali
si dirigono verso
l’osservatore
H
Cl
OH
CH 3
Assegniamo la configurazione
3-clorocicloesene
Equivale a
Molecole acicliche con due stereocentri
Numero di stereoisomeri
(massimo possibile)
=
2n ( n = numero
di stereocentri)
Una molecola con due carboni chirali esisterà in
quattro (22) forte stereoisomeriche.
Es.
*
*
2,3,4-triidrossibutanale
Diastereoisomeri
Due elementi di coppie
DIASTEREOISOMERI.
diverse
sono
tra
loro
I diastereoisomeri sono stereoisomeri le cui molecole non sono l’una
l’immagine speculare dell’altra
Due elementi di coppie diverse sono tra loro
DIASTEREOISOMERI
Esempio: gli stereoisomeri di 1,2,3-butantriolo
(1) e (4) sono enantiomeri;
(1) e (3) sono diastereoisomeri
(2) e (3) sono enantiomeri;
(2) e (4) sono diastereoisomeri
Composti meso
Un composto meso è una molecola achirale che possiede
due o più stereocentri.
Acido tartarico, dovrebbe esistere in
quattro forme stereoisomeriche. In
realtà ne esistono solo tre.
Esempio 4.5 :
quali composti sono enantiomeri e qual è il composto meso?
Molecole cicliche con due stereocentri
Derivati disostituiti del ciclopentano
CH3
H3 C
CH3
H3C
OH
HO
OH
HO
cis-2-Metilciclopentanolo
(coppia di enantiomeri)
trans-2-Metilciclopentanolo
(coppia di enantiomeri)
Derivati disostituiti del cicloesano
Molecole con tre o più stereocentri
Proprietà degli stereoisomeri
Gli enantiomeri hanno identiche
diastereoisomeri le hanno diverse.
proprietà
chimiche
e
fisiche
mentre
i
Come è possibile distinguere e separare gli enantiomeri?
Gli enantiomeri interagiscono in maniera diversa con la luce polarizzata e con altre
molecole chirali.
Cosa è la luce polarizzata?
L’attività ottica
Filtro polarizzatore
Luce polarizzata:
Luce che vibra in un
solo piano (il vettore
campo elettrico)
Sorgente
luminosa
luce non polarizzata
Piano della
luce polarizzata
Polarimetro
Filtro polarizzatore
Tubo contenente
il campione
Filtro ruotante
Compo
sto
otticam
ente att
i vo
Sorgente
luminosa
Piano della
luce polarizzata
Consente di stabilire la rotazione
del piano della luce polarizzata
Un enantiomero è un composto otticamente attivo
Rotazione specifica = [α]d
rotazione osservata (gradi)
[α]d =
Lunghezza (dm) x Concentrazione (g/ml)
(S)-(+)-2-butanolo
(R)-(-)-2-butanolo
[α]d = +13.52
[α]d = -13.52
destrogiro
levogiro
Miscela racemica
Una miscela equimolecolare di due enantiomeri
50%
(S)-(+)-2-butanolo
50%
(R)-(-)-2-butanolo
La miscela analizzata nel polarimetro non farà
ruotare il piano della luce polarizzata: [α]d = 0
SIGNIFICATO DELLE CHIRALITA’ NEL MONDO BIOLOGICO
Perché gli enzimi hanno la capacità di distinguere gli enantiomeri e
quindi di reagire con uno solo di questi?
Tre interazioni corrette
Due interazioni corrette
FARMACI CHIRALI
H3 C
H
H
HOOC
HOOC
(S)-Ibuprofene
analgesico ed antipiretico
H3C
CH3
(R)-Ibuprofene
inattivo
H
H
HOOC
CH3
HOOC
OCH3
(S)-Naprosene
analgesico
OCH3
(R)-Naprosene
epatotossico!
Gli enzimi sono essi stessi sostanze chirali quindi
producono o reagiscono solo con sostanze che hanno
una ben determinata chiralità per ogni stereocentro
La maggior parte delle biomolecole (molecole
prodotte dal metabolismo degli esseri viventi) sono
sostanze chirali.
Farmaci chirali
Enzima
L-DOPA
Captopril
Dopamina
(S)-Ibuprofen
Separazione di enantiomeri - Risoluzione
Si può trasformare la coppia di enantiomeri in una coppia di
diastereoisomeri mediante la reazione con un reagente di
risoluzione
Una reazione utile alla risoluzione chimica è la
formazione di sali:
RCOOH + :B
base
Acido
carbossilico
RCOO-HB+
sale
(+)-cinconina
cinconina
Acido (R,S) mandelico
meno solubile
Coppia di diastereoisomeri
più solubile
Separazione per cristallizzazione
Addizione di HCl e separazione
dalla cinconina
Miscela racemica di
R+S
acido mandelico
Sali diastereomerici
RR
Base chirale
R
SR
SEPARAZIONE
Enzimi quali agenti risolventi
gli enzimi sono capaci di distinguere gli enantiomeri
Estere etilico dell’(S)-Naprosene
esterasi
Estere etilico dell’(R)-Naprosene
(non attaccato dall’esterasi)
Il sale sodico del Naprosene è il principio attivo di
numerose preparazioni di farmaci anti-infiammatori
non steroidei