CdLM LM-67 - Scienze e Tecniche delle attività motorie
preventive e adattate
Metodologia
epidemiologica
Prof. Giovanni Capelli)
(Cattedra di Igiene Università di Cassino [email protected])
C.I. Epidemiologia e valutazione degli stili di vita sulla salute
1
CdLM LM-67 - Scienze e Tecniche delle attività motorie preventive
e adattate
I trials clinici
Trials clinici
2
La Evidence Based Medicine (EBM)
Fondamenti epidemiologici
3
Evidence Based Medicine
(Medicina basata sulle prove di efficacia)
• Approccio metodologico
clinico che consiste
al
problema
nell’utilizzare
nella pratica clinica i risultati
di studi epidemiologici osservazionali e
sperimentali
al fine di standardizzare l’utilizzo di test
diagnostici e terapie validate
che assicurino il miglior rapporto costoefficacia
4
The concept of Evidence and its
evaluation
• Due dei più significativi cambiamenti avvenuti negli
ultimi vent’anni nel cosiddetto linguaggio scientifico
riguardano da una parte la preferenza accordata alla
parola “opinione” in confronto ad altri elementi di
prova e dall’altra il declino della parola “esperimento”
• La parola opinione deve, senza dubbio la sua fortuna
a molti motivi, dei quali uno dei più evidenti penso
sia l’influenza del metodo adottato dagli intervistatori
e produttori televisivi: per essi le risposte devono
essere brevi, essenziali, chiare, mentre ogni
discussione a proposito di “evidenze” empiriche è
fatta di sfumature, di esitazioni, di ambiguità...
Archibald L. Cochrane, “Effectiveness and efficiency. (Random
reflections on health services), 1972
5
Nascita della
Evidence Based Medicine
• Il
termine
EBM
è
stato
usato
pubblicamente su una rivista scientifica
nel 1992
Evidence-based
Medicine Working Group.
“Evidence-based medicine: a new approach to
teaching the practice of medicine”. JAMA,
1992; 268:2420-5
Questo articolo affermava in modo esplicito
che tutte le azioni cliniche sul piano
diagnostico, della valutazione prognostica e
delle scelte terapeutiche dovevano essere
basate su solide evidenze QUANTITATIVE
derivate da una ricerca epidemiologico-clinica
di buona qualità
6
Tappe di un approccio EBM
• Tradurre il problema clinico/assistenziale da
esaminare
in una domanda per la quale è possibile trovare una
risposta
• Ricercare nella letteratura disponibile, e nelle
altre fonti di informazione,
l’esistenza di prove credibili
• Valutare criticamente
la validità metodologica e la rilevanza clinica delle
eventuali prove di efficacia identificate
• Impostare
paziente
un
piano
assistenziale
per
il
che sia coerente con le prove di efficacia disponibili
7
Conseguenze della visione EBM
• Si deve accettare di dover prendere
determinate decisioni in condizioni di
INCERTEZZA,
per mancanza assoluta di informazioni rilevanti o
per cattiva qualità di quelle esistenti
• Il rispetto dell’ AUTORITA’ ha un peso molto
inferiore rispetto alla valutazione critica
rigorosa della qualità delle conoscenze
disponibili
A.
Liberati, “La medicina delle prove di
efficacia”, Il Pensiero Scientifico Editore, 1997
8
Livelli di “evidence” e
forza delle raccomandazioni
(Shekelle PG, Woolf SH, Eccles M, Grimshaw J, Developing Guidelines, BMJ, 318: 593-596, 1999)
• Livelli di prova (evidence)
Ia
Prove basate su studi di meta-analisi
o trials clinici controllati randomizzati (RCT)
Ib
Prove basate su almeno 1 trial
clinico randomizzato
IIa
Prove basate su almeno 1 studio
controllato ma non randomizzato
IIb
Prove basate su almeno un altro tipo
di studio quasi-sperimentale
III
Prove basate su studi descrittivi non
sperimentali, quali studi comparativi, studi di
correlazione, studi caso-controllo
IV
Prove basate su Reports di Comitati
di Esperti, o Esperienza clinica di autorità
rispettate, o entrambi
9
Rilevanza di effetto ed esposizione negli
studi epidemiologici
EFFETTO
ESPOSIZIONE
• Case reports
• Case series
Descrittivi
• Studi trasversali
• Studi ecologici
• Studi caso-controllo
Costruttivi
• Studi di coorte
• Studi sperimentali
Sperimentali
10
La Sperimentazione clinica
Definizioni e concetti chiave
11
Sperimentazione clinica:
alcune parole chiave
• COMITATO ETICO
Struttura e funzione
Giudizio di notorietà
Copertura assicurativa
Istruttoria
Investigator’s brochure
Dichiarazione di Helsinki
Nota informativa ai
partecipanti
Consenso informato
Legge sulla Privacy 675/96
• EPIDEMIOLOGIA
Studio Controllato
L’inferenza statisticoepidemiologica
L’evidence epidemiologica
Epidemiologia osservazionale
e sperimentale
Questionari HRQoL
Scale di valutazione
• SPERIMENTAZIONE
Fasi degli studi (I, II, III, IV)
Condizioni di cecità
Placebo e trattamenti di
confronto
Schemi di trattamento
Efficacia e sicurezza
Criteri di inclusione
Criteri di esclusione
Drop out
Studi multicentrici
Outcomes (endopoints)
• ANALISI STATISTICA
Intention to treat
Interim analysis
Dimensioni del campione e
potenza degli studi
Significatività statistica
12
Introduzione
• La validità nel metodo sperimentale
risiede nel controllo diretto da parte
del ricercatore sulla assegnazione
dei soggetti ai gruppi di studio
• Negli studi descrittivi, invece, il
ricercatore accetta essenzialmente
la situazione così come si presenta.
13
Esperimenti epidemiologici
• 1. Sperimentazioni cliniche
Clinical
Trial
l’efficacia di un farmaco e di una
misura preventiva viene testata nei
singoli individui.
• 2. Sperimentazioni su comunità
Community
Trial
l’efficacia di un farmaco o misura
preventiva viene saggiata su un gruppo
di individui.
14
Sperimentazione controllata
• E’ possibile sperimentare:
farmaci
tecniche
chirurgiche
vaccini
misure
di sanità pubblica (es. screening)
• Gli individui (nei clinical trials) o le
comunità (nei community trials) sono
assegnati casualmente a due gruppi:
gruppo
sperimentale
gruppo di controllo
15
Sperimentazione controllata
• Cosa differenzia
(“bracci”)?
Gruppo
i
due gruppi
sperimentale
viene effettuato l’intervento
– es. viene somministrato il farmaco in esame
Gruppo
di controllo
non viene effettuato l’intervento, o
viene
effettuato
uno
pseudointervento, o comunque non si fa nulla
di nuovo
– es. viene somministrato il farmaco in uso nella
pratica corrente, o un placebo (sostanza inerte
come una pillola di zucchero o soluzione
fisiologica)
16
Sperimentazione controllata
intervento
Valutazione degli
effetti dell’intervento
non intervento
17
Trial Controllato Randomizzato (RCT)
da Last, JM, A dictionary of Epidemiology, Oxford Univ. Press, 1995
• Un esperimento epidemiologico nel
quale
soggetti
tratti
da
una
popolazione sono assegnati a caso a
gruppi
generalmente
detti gruppo in studio e
gruppo di controllo
al fine di essere sottoposti o meno ad un
trattamento o procedura preventiva o
terapeutica
• I risultati vengono poi analizzati
attraverso un rigoroso confronto
dei
tassi dell’outcome scelto
il disegno controlla per i “confondenti”
18
Definizioni
da: GU Comunità Europee, posizione comune 44/2000, 20/10/2000
• Sperimentazione clinica
indagine
effettuata su soggetti umani,
volta a scoprire o verificare gli effetti clinici
e/o farmacologici di medicinali in fase di
sperimentazione
e/o individuare reazioni avverse
e/o
studiarne
l’assorbimento,
la
distribuzione, il metabolismo o l’eliminazione
• Sperimentazione clinica pluricentrica
sperimentazione
clinica effettuata in base ad un unico
protocollo in più di un sito
i siti possono essere ubicati in uno o più stati
19
Tipi di sperimentazioni cliniche
• Sperimentazioni terapeutiche
In questo tipo di sperimentazione una procedura
terapeutica viene somministrata nel tentativo di
alleviare sintomi e/o migliorare la sopravvivenza
di coloro che hanno la malattia.
• Sperimentazioni di intervento
In questo tipo di sperimentazione il ricercatore
interviene prima che la malattia si sia sviluppata,
su quegli individui con caratteristiche tali da farli
considerare soggetti a rischio aumentato di
sviluppare la malattia.
• Sperimentazioni preventive
In questo tipo di sperimentazione si tenta di
determinare l’efficacia di un agente o di una
procedura preventiva. Vengono anche dette
sperimentazioni di profilassi.
20
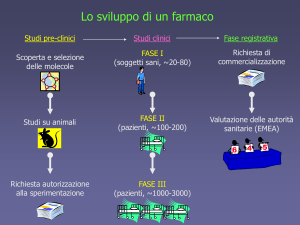
La sperimentazione clinica: fasi
• Fase I
Farmacologia
clinica e tossicità
• Fase II
Indagine
clinica iniziale dell’effetto del
trattamento
• Fase III
Valutazione
scala
del trattamento su larga
• Fase IV
Farmacovigilanza
21
Sperimentazioni Cliniche
Fase I - Farmacologia clinica e Tossicità
• Primi esperimenti nell’uomo
su
volontari sani
su pazienti
• Obiettivo
accertamento
della
tollerabilità,
più
che
dell’efficacia
determinare un dosaggio singolo accettabile
esperimenti a dosaggio graduale
studi
su metabolismo e biodisponibilità
• Numero di soggetti coinvolti
20-80
tra sani e pazienti
Da S. Pocock, Sperimentazioni cliniche. Un approccio pratico, Centro Scientifico Torinese, 1989
22
Sperimentazioni Cliniche
Fase I
• Primi studi su un nuovo principio attivo
condotti
nell’uomo spesso su volontari sani
• Lo scopo è quello di
fornire
una valutazione preliminare sulla
sicurezza
ed un primo profilo della farmacocinetica e
della farmacodinamica del principio attivo
nell’uomo
Da Circolare Ministeriale 5/10/00, n. 15, Aggiornamento della Circ. Min. 8 del 10/7/97
relativa alla sperimentazione clinica dei medicinali, Allegato quater
23
Sperimentazioni Cliniche
Fase II - Indagine clinica iniziale degli effetti
• Valutazione dell’efficacia terapeutica
in scala ridotta
su
pazienti
• Peculiarità
stretto
controllo di ogni pazienti
utile per lo screening di efficacia delle
sostanze da avviare alle fasi successive
• Numero di soggetti coinvolti
raramente
più di 100-200 pazienti
Da S. Pocock, Sperimentazioni cliniche. Un approccio pratico, Centro Scientifico Torinese, 1989
24
Sperimentazioni Cliniche
Fase II - Studi terapeutici pilota
• Lo scopo è quello di
dimostrare l’attività e valutare la sicurezza a breve termine
di un principio attivo
in pazienti affetti da una malattia o da una condizione clinica
per la quale il principio attivo è preposto
• Gli studi vengono condotti
su un numero limitato di soggetti
e spesso, in uno stadio più avanzato, secondo una schema
comparativo
es. controllato con placebo
• Questa fase ha anche lo scopo
di determinare un appropriato intervallo di dosi e/o schemi
terapeutici
e, se possibile, di identificare il rapporto dose/risposta
al fine di fornire le migliori premesse per pianificare studi più
estesi
Da Circolare Ministeriale 5/10/00, n. 15, Aggiornamento della Circ. Min. 8 del 10/7/97
relativa alla sperimentazione clinica dei medicinali, Allegato quater
25
Sperimentazioni Cliniche
Fase III - Valutazione su larga scala del trattamento
• Valutazione efficacia comparativa
su
pazienti
con
confronto
standard
placebo
o
trattamenti
• Caratteristiche
confronto
in “condizioni costanti” (RCT)
controllo del confondimento “by design”
condizioni “teoriche” (EFFICACY)
valutazione
effetti collaterali
• Numero di soggetti coinvolti
numero
rilevante di soggetti
spesso studi multicentrici
Da S. Pocock, Sperimentazioni cliniche. Un approccio pratico, Centro Scientifico Torinese, 1989
26
Sperimentazioni Cliniche
Fase III - Studi su gruppi più numerosi
• Al fine di determinare
il rapporto sicurezza/efficacia a breve e lungo termine
delle formulazioni del principio attivo
come pure di valutarne il valore terapeutico assoluto e relativo
• L’andamento e le caratteristiche
delle più frequenti reazioni avverse devono essere indagati
e si devono esaminare le speicifiche caratteristiche del prodotto
(interazioni clinicamente rilevanti tra farmaci, fattori che inducono
differenti risposte, quali l’età, ecc.)
• Il programma sperimentale dovrebbe essere
preferibilmente a doppio cieco randomizzato
ma altri disegni possono essere accettabili, come nel caso di studi a
lungo termine sulla sicurezza
• Generalmente le condizioni degli studi
dovrebbero essere il più possibile vicine alle normali condizioni d’uso
Da Circolare Ministeriale 5/10/00, n. 15, Aggiornamento della Circ. Min. 8 del 10/7/97
relativa alla sperimentazione clinica dei medicinali, Allegato quater
27
Sperimentazioni Cliniche
Fase IV - Farmacovigilanza
• Follow-up del farmaco
su
normali prescrizioni sui pazienti
• Obiettivi
Valutazione
sicurezza
effetti collaterali “rari” o a lungo termine
Valutazione
EFFECTIVENESS
efficacia pratica, al fuori dei gruppi sperimentali
– importanza effetti collaterali e non compliance!
• Numero di soggetti coinvolti
post-marketing
grandi database
Da S. Pocock, Sperimentazioni cliniche. Un approccio pratico, Centro Scientifico Torinese, 1989
28
Sperimentazioni Cliniche
Fase IV - Studi condotti dopo la commercializzazone
del prodotto medicinale
• Sono studi condotti
sulla
base delle informazioni contenute
riassunto delle caratteristiche del prodotto
nel
relativo alla autorizzazione alla immissione in
commercio
– per esempio, farmacovigilanza, o valutazione del valore
terapeutico
• Dopo che un prodotto è stato posto sul
mercato
gli
studi clinici miranti ad indagare, ad esempio,
nuove indicazioni
nuove vie di somministrazione
nuove associazioni
– vanno considerati come studi su nuovi prodotti medicinali
Da Circolare Ministeriale 5/10/00, n. 15, Aggiornamento della Circ. Min. 8 del 10/7/97
relativa alla sperimentazione clinica dei medicinali, Allegato quater
29
Programmazione di uno studio:
il protocollo
• Il disegno di una sperimentazione clinica è
definito in un protocollo
che
contiene gli obiettivi e
specifiche da usarsi nello studio
le
procedure
Deve essere scritto prima del trial
– e dovrebbe contenere informazioni quali i metodi per la
selezione dei gruppi di studio e istruzioni dettagliate per
l’esecuzione dei test di laboratorio
• Se durante il corso della sperimentazione
sorgono dei problemi, a causa di determinate
situazioni contingenti,
il
protocollo deve essere utilizzato come guida
per quello che il ricercatore deve fare.
30
Schema di protocollo (1)
1. Fondamenti e motivazioni scientifiche dello
studio
2. Obiettivi specifici dello studio
3. Concisa definizione del disegno dello studio
(mascheramento,
schemi
di
randomizzazione,
tipi
e
durata
dei
trattamenti, numero dei pazienti)
4. Criteri per l’inclusione ed esclusione dei
soggetti
5. Schema delle procedure di trattamento
6. Definizione di tutte le metodiche cliniche, di
laboratorio, etc.
31
Schema di protocollo (2)
7. Metodi per assicurare l’integrità dei dati
8. End point primari e surrogati
9. Iniziative previste per l’osservazione e la
registrazione degli effetti collaterali
10. Procedure per deviazioni dal protocollo
11. Procedure per ottenere il consenso del
soggetto
12. Procedure per analizzare i risultati
13. Appendici, schede, etc.
(adattato da Bearman, 1975)
32
Definizioni
da: GU Comunità Europee, posizione comune 44/2000, 20/10/2000
• Medicinale in fase di sperimentazione
principio attivo in forma farmaceutica o placebo
sottoposto a sperimentazione o utilizzato come
riferimento nel corso di una sperimentazione
clinica
comprende prodotti già autorizzati se utilizzati o
preparati in maniera diversa da quella autorizzata
o per indicazioni non autorizzate o per ottenere
maggiori informazioni su quanto già autorizzato
• Giudizio/delibazione di notorietà
qualora il medicinale non risulti di nuova
istituzione viene rilasciata l’esenzione dagli
accertamenti dell’ISS sul farmaco
la sperimentazione può essere effettuata senza i
preliminari accertamenti
33
Definizioni
da: GU Comunità Europee, posizione comune 44/2000, 20/10/2000
• Comitato Etico
Organismo
indipendente
in
uno
stato
membro, composto di personale sanitario e
non
incaricato di garantire la tutela dei diritti,
della sicurezza e del benessere dei soggetti
della sperimentazione
e di fornire pubblica garanzia di questa tutela,
emettendo, ad esempio,
pareri sul protocollo di sperimentazione,
sull’idoneità dello o degli sperimentatori, sulle
strutture e sui metodi e documenti da
impiegare per informare i soggetti della
sperimentazione prima di ottenerne il
consenso
34
Comitato Etico - Composizione
•
Circ. Ministeriale luglio 1997 (recepimento linee guida UE Buona
Pratica Clinica) raccomanda
almeno 5 membri
almeno 1 membro la cui area di interesse primario sia di carattere non scientifico
almeno
1 membro che sia indipendente dall’Istituzione/dal centro di
sperimentazione
•
Linee guida di riferimento per l’istituzione ed il funzionamento dei
CE (DM 18/3/98)
2 clinici con documentata esperienza e conoscenze delle sperimentazioni
terapeutiche controllate e randomizzate
1 biostatistico con documentata esperienza delle sperimenrtazioni controllate e
randomizzate
1 farmacologo
1 farmacista del servizio farmaceutico della istituzione di ricovero o territoriale
sede della sperimentazione clinica dei medicinali
il direttore sanitario
1 esperto in materia giuridica
1 medico di medicina generale territoriale
1 esperto di bioetica
1 diplomato in materia sanitaria (dirigente infermieristico)
1 rappresentante dei malati (volontariato, associazionismo)
35
Definizioni
da: GU Comunità Europee, posizione comune 44/2000, 20/10/2000
• Consenso informato
la
decisione di partecipare
ad una
sperimentazione
clinica
presa
spontaneamente,
dopo essere stati debitamente informati
delle modalità di sperimentazione
e
aver ricevuto una documentazione
appropriata
da una persona capace di dare il proprio
consenso o dal suo rappresentante legale
36
Definizioni
da: GU Comunità Europee, posizione comune 44/2000, 20/10/2000
• Sperimentatore
la
persona
responsabile
sperimentazione in un dato sito
dell’esecuzione
della
• Dossier per lo sperimentatore
la
raccolta di dati clinici e non clinici sul medicinale in fase
di sperimentazione che sono pertinenti per lo studio dei
medesimi nell’uomo
• Sponsor
la persona, società o istituzione che si assume la
responsabilità di avviare, gestire e/o finanziare una
sperimentazione clinica
37
Definizioni
da: GU Comunità Europee, posizione comune 44/2000, 20/10/2000
• Evento avverso
qualsiasi evento clinico dannoso che si manifesta in un
paziente o in un soggetto della sperimentazione clinica cui
è stato somministrato un medicinale
non necessariamente ha un rapporto causale con questo
trattamento
• Reazione avversa
qualsiasi
reazione dannosa o indesiderata a un medicinale
in fase di sperimentazione, indipendentemente dalla dose
somministrata
• Evento avverso serio
qualsiasi
evento avverso che, indipendentemente dalla dose
somministrata, mette a repentaglio la vita del soggetto, o
comporta una invalidità o incapacità grave o prolungata, o
malformazioni congenite o difetti alla nascita.
38
Parole chiave di interesse statistico in un
Randomized Controlled Trial (RCT)
• Disegno dello studio
Randomizzazione
Calcolo delle dimensioni del campione
Criteri di inclusione/esclusione
Cecità
• Obiettivi dello studio
Definizione ENDPOINTS e loro misura
Hard: sopravvivenza, intervallo libero da malattia
Soft: Percezione individuale di dimensioni della Qualità di
Vita
• Valutazione dei risultati
Intention to treat
Formalizzazione ipotesi nulla ed ipotesi alternativa
39
Randomizzazione (1)
• La
principale
differenza
tra
una
sperimentazione clinica ed uno studio
prospettico è che nella prima si ricorre a
procedure di randomizzazione.
• Il gruppo sperimentale ed il gruppo di
controllo devono essere confrontabili per
tutti i fattori ad eccezione per quello in
studio (farmaco o misura preventiva)
40
Randomizzazione (2)
• L’epidemiologo potrebbe ottenere la
confrontabilità per i fattori di cui siano
note le influenze sulla malattia oggetto
dello studio, quali:
età
sesso
razza
gravità
della malattia
accoppiando i soggetti dei due gruppi per
questi fattori
41
Randomizzazione (3)
• D’altra parte non si possono accoppiare gli
individui per quei fattori la cui influenza non
è conosciuta o non può essere misurata.
Questo
problema può essere risolto mediante la
randomizzazione dei soggetti, o assegnandoli al
gruppo sperimentale o al grippo di controllo.
Ciò consente la confrontabilità di questi gruppi
rispetto a tutti i fattori, noti e ignoti, misurabili e
no, eccetto per quello studiato.
42
Randomizzazione (4)
• La randomizzazione è lo strumento con cui il
ricercatore evita di introdurre distorsioni
(bias) conscie ed inconscie nel processo di
assegnazione degli individui ai gruppi
sperimentali e di controllo, aumentando il
grado di confrontabilità.
• Una frase che esprime bene questo concetto
di confrontabilità è “ceteris paribus”, che
significa appunto “essendo uguali tutte le
altre cose”.
43
Randomizzazione (5)
• Proprietà di un campione casuale
Ogni
La
unità della popolazione ha la stessa probabilità di essere scelta
scelta di una unità non influenza la selezione delle altre
• Semplice
Lista di numeri casuali con probabilità del 50% (sono 2
trattamenti) di essere assegnati ad A o B
es. A se 0-4, B se 5-9
– 0 5 2 7 8 4 3 7 4 1
– A B A B B A A B A A
Possibili Bias: sbilanciamento gruppi
• A blocchi a permutazione randomizzata
Per evitare lo sbilanciamento ogni numero casuale non assegna il
trattamento ad un solo paziente, ma ad un blocco (es una
coppia)
es. AB se 0-4, BA se 5-9
– 0 5 2 7 8 4 3 7 4 1
– AB BA AB BA BA AB AB BA AB AB
44
Criteri inclusione ed esclusione (1)
• In ogni ricerca clinica è necessario
definire esattamente quali siano i
pazienti eleggibili
L’
obiettivo principale è garantire che i
pazienti nella sperimentazione
possano
essere
un
campione
rappresentativo
di
qualche
futura
categoria di pazienti a cui potranno
essere applicati i risultati della ricerca
– tuttavia, non è bene essere talmente restrittivi
sulla eleggibilità dei pazienti da limitare la ricerca
e
rischiare
che
i
risultati
manchino
di
generalizzabilità
45
Criteri inclusione ed esclusione (2)
Nelle
fasi iniziali dello sviluppo del
protocollo si può procedere tracciando
solamente un profilo approssimativo del
paziente voluto
ma prima che la ricerca abbia inizio,
questo deve essere trasformato in una
descrizione dettagliata
– La condizione patologica sotto indagine deve
essere definita, e ciò’ richiede l’esplicitazione di
criteri molto dettagliati nel protocollo di studio
46
Cecità e placebo (1)
• Tre sono gli attori che potrebbero condizionare
il loro atteggiamento nei confronti dello studio
alla conoscenza del regime di trattamento:
Il
paziente (Singolo cieco)
L’
equipe di trattamento (Doppio cieco)
Il
valutatore (“Triplo” cieco o cecità parziale)
47
Cecità e placebo (2)
• L’ approccio a doppia cecità e’ possibile solo
quando si confrontano trattamenti simili
modalità
di somministrazione
l’ uso di placebo per sperimentazioni di farmaci
non per via orale è molto raro, per problemi
pratici ed etici (un esempio in Hjalmarson et al,
Lancet, 1981)
effetti
collaterali
possono rendere riconoscibili farmaco e placebo
al medico ma anche al pz. (consenso
informato?)
48
Intention to treat
• Tutti
i
pazienti
che
sono
stati
randomizzati vanno inclusi nella analisi
statistica
considerati
nel gruppo di trattamento nel
quale
erano
stati
inseriti
dalla
randomizzazione
anche se non hanno completato il ciclo di
trattamento (Intention to treat)
• Questo
perché
la
probabilità
di
abbandono del ciclo potrebbe essere
diversa per i due trattamenti
intolleranza
al trattamento
compliance piu’ difficile
49
Calcolo numerosità campione
• Il
corretto
dimensionamento
del
campione è punto fondamentale e
richiede uno sforzo da parte del clinico:
nel definire esplicitamente in termini
quantitativi gli obiettivi che lo studio si
prefigge
QUANTO miglioramento
ci si aspetta dal nuovo
trattamento?
50
Sample size, Hypothesis test & power
• Utilizziamo
lo
“statistical
power”
(“potenza” o “potere” statistico) per
calcolare la dimensione del campione
appropriata per un trial clinico
Per
il quale siamo in grado di specificare la
minima effettiva differenza tra i trattamenti
che abbia una utilità clinica
Questo rende il calcolo un po’ artificioso
– MA, nella pratica, è generalmente possibile
specificare il grado di beneficio che il nuovo
trattamento dovrebbe apportare perché valga la
pena di adottarlo
» Altman DG, Practical Statistics for Medical
Research, Chapman & Hall, 1994
51
Sample size, Hypothesis test & power
• L’idea che sta alla base dei calcoli delle
dimensioni del campione è quella di
avere una
“high
chance of detecting, as statistically
significant, a worthwhile effect if it exists”
e perciò di essere reagionevolmente sicuri
che quel beneficio non esiste se non lo
troviamo nel trial
» Altman DG, Practical Statistics for Medical
Research, Chapman & Hall, 1994
52
Etica e sample size
• I soggetti arruolati in
“abbastanza numerosi”
uno
studio
devono essere
Da far sì che un effetto di una dimensione tale da essere
“scientificamente
significativo”
riesca
ad
essere
anche
“statisticamente significativo”
Ma è anche importante che gli arruolati non siano “troppi”, tanti da
rendere statisticamente significativo un risultato di scarsa rilevanza
scientifica
• La numerosità campionaria è importante per motivi
economici
Uno studio sottodimensionato può portare ad uno spreco di risorse,
perché non riuscirà a produrre risultati utili
Uno studio sovradimensionato usa comunque più risorse del
necessario
• Nella sperimentazione animale o umana, la numersità
campionaria è un aspetto importante
Uno studio sottodimensionato espone i soggetti a trattamenti
potenzialmente rischiosi senza portare un avanzamento delle
conoscenze scientifiche
Uno studio sovradimensionato sono esposti ad un trattamento
potenzialmente dannoso troppi soggetti, ovvero si nega un
trattamento potenzialmente benefico a qualcuno
– Lenth RV, The American Statistician, 55: 187-193, 2001
53
Calcolo numerosità campione
Proporzioni
pC=0.20
pT-pC=0.30
a=0.05
Za=1.96 (2 code)
Za=1.645 (1 coda)
b=0.20 (Zb=1.28)
45 per gruppo (2 code)
37 per gruppo (1 coda)
b=0.10 (Zb=0.84)
58 per gruppo (2 code)
48 per gruppo (1 coda)
Za 2p 1 p Z b p T 1 p T p C 1 p C
n
(
p
p
)
T
C
2
54
Calcolo numerosità campione
Medie
( za zb )
n 2
H0
2
H1
55
Il test statistico di ipotesi
• L’ immaginazione umana non ha limiti nella
capacità di creare teorie e modelli per
descrivere la realtà
ma quale principio si segue nel decidere il
modello che meglio si attiene ai dati?
Il principio del “rasoio di Occam”,
secondo cui:
– è necessario adottare sempre la
spiegazione più semplice tra
quelle coerenti con i fatti noti
– e solo quando sono presenti
incoerenze
è
giustificata
l’introduzione di una spiegazione
più elaborata e complessa
56
Il test statistico di ipotesi
• E’ esattamente questo principio che
viene applicato nel test di ipotesi in
statistica:
si definisce la spiegazione più semplice
“Ipotesi nulla”
si verifica se i dati raccolti nel campione
disponibile sono compatibili con essa
si calcola, cioè, quanto sarebbe stato
probabile ottenere quei dati nel caso che
l'ipotesi nulla fosse vera
57
Ipotesi nulla ed ipotesi alternativa
•
Si segue dunque, in statistica, il principio della
“dimostrazione inversa”:
se si intende proporre che due popolazioni siano
diverse
non potendosi dimostrare in via diretta la diversità
si propone come ipotesi la loro uguaglianza
definita come “Ipotesi nulla” o H0
e si dimostra che tale ipotesi cade in contraddizione, è
incompatibile con i dati, rende i dati estremamente
improbabili
è allora necessario accettare l’ “ipotesi alternativa”
HA
– che altro non è che il reciproco di H0
» e cioè l’ ipotesi che le due popolazioni NON
siano uguali, cioè siano diverse
58
Il livello di significatività
•
In quali casi riteniamo che le incongruenze tra l’
ipotesi nulla ed i dati siano sufficienti a rifiutare l’
ipotesi nulla?
dobbiamo introdurre il concetto di significatività statistica
che non necessariamente è sinonimo di significatività ad
esempio, clinica
•
Per significatività statistica si intende una soglia
arbitraria, stabilita a priori, di probabilità che i dati
derivino da una realizzazione casuale dell’ Ipotesi
nulla
se la probabilità che i dati derivino dall’ ipotesi nulla è
inferiore alla soglia
possiamo rifiutare
alternativa
•
l’ipotesi
nulla
e
accettare
l’ipotesi
La soglia di significatività definisce dunque il limite
sotto al quale riteniamo accettabile la probabilità di
commettere un errore rifiutando l’ ipotesi nulla
59
Un suggerimento per interpretare i valori di p
presentati in letteratura
1.0
Prove contrarie all’ipotesi nulla deboli
Valore di p
0.1
Il valore di p si riduce: le prove
0.01
0.001
contro l’ipotesi nulla si rafforzano
Prove schiaccianti contrarie all’ipotesi nulla
0.0001
Da: Sterne JAC, Smith GD, “Sifting the evidence-what’s wrong with significance
tests?”, BMJ, 322:226-231,2001
60
La “potenza” di un test
• La potenza è la probabilità di rifiutare l’
ipotesi nulla H0 quando essa è falsa
potenza=P(rifiutare H0 | H0 è falsa)
• Può essere intesa come la probabilità che
ha un particolare studio di individuare una
deviazione dall’ ipotesi nulla nel caso in
cui esista
61
La “potenza” di un test
• La potenza è la probabilità di rifiutare l’
ipotesi nulla H0 quando essa è falsa
potenza=P(rifiutare H0 | H0 è falsa)
• La potenza è definita come 1-b
ed è dunque la probabilità complemento dell’
errore di tipo II
e come b dipende da:
numerosità del campione
errore a
parametri della popolazione di riferimento
– es 0
variazione nei parametri attesi nel campione
– es. Diff.= 1-0
62