Illustrate la chiralità delle molecole:
Chiralità
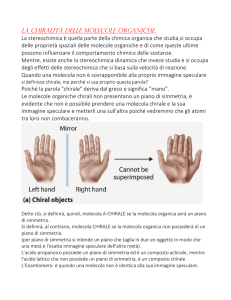
• Un oggetto si definisce chirale se non è sovrapponibile alla
propria immagine speculare (mano destra e mano sinistra). Non
c’è un piano di simmetria
• La stessa definizione vale per le molecole: una molecola è
chirale se non è sovrapponibile alla propria immagine speculare.
Centro di chiralità
• Una molecola è chirale quando è presente un atomo tetraedrico
con 4 gruppi diversi (esistono anche altri motivi di chiralità).
• L’atomo tetraedrico con 4 gruppi diversi si definisce “centro di
chiralità” o centro stereogenico (o stereogeno)
• Le due molecole, una immagine speculare dell’altra ma non
sovrapponibili, sono due enantiomeri
Quale isomeria?
• Le due molecole una immagine speculare dell’altra hanno la stessa
struttura ma diverso orientamento degli atomi nello spazio
(stereoisomeri), inoltre sono interconvertibili solo per rottura e
formazione di legami (configurazionali)
Gli stereoisomeri configurazionali già visti (alcheni E-Z, cicloalcani cistrans,
non sono immagini speculari l’uno dell’altro:
• enantiomeri: immagini speculari l’uno dell’altro non sovrapponibili
• diastereoisomeri: stereoisomeri configurazionali non immagini
speculari l’uno dell’altro
In chimica è detta chirale (dal greco χειρ, "mano") una molecola non sovrapponibile
alla propria immagine speculare nelle tre dimensioni.Al contrario, una molecola
sovrapponibile alla propria immagine speculare nelle tre dimensioni è detta achirale. La
chiralità è la proprietà di un oggetto rigido (o di una disposizione spaziale di punti o
atomi) di essere non sovrapponibile alla sua immagine speculare.Esempi macroscopici
di oggetti chirali sono una mano - che può essere destra o sinistra - o una vite, che può
avere un filetto che ruota in senso orario o antiorario. Un chiodo, invece, possedendo
infiniti piani di simmetria lungo la propria lunghezza, è identico e sovrapponibile alla
propria immagine speculare, quindi non è chirale.È frequentissimo commettere l'errore
di descrivere la chiralità come proprietà puntuale: non esiste un atomo (o un punto)
che sia chirale, bensì la chiralità è una proprietà appartenente alla molecola (o a un
oggetto in generale).Ad esempio, citando un caso tipico in chimica organica, un
carbonio che porti quattro sostituenti diversi, e faccia parte di una molecola chirale, è
correttamente definibile come carbonio stereogenico.In una molecola chirale tutti gli
atomi che la costituiscono, sono opportunamente definibili "chirotopici".Una molecola
è chirale se tra i suoi elementi di simmetria non vi è alcun asse di rotazione improprio.
Due molecole identiche in tutto, salvo l'essere una l'immagine speculare dell'altra tra
loro non sovrapponibili, sono dette enantiomeri.Possono essere un esempio di
molecole chirali quelle che contengono un atomo di carbonio (ibridato sp³) legato a
quattro sostituenti diversi.A volte però, una molecola contenente più di un atomo di
carbonio chirotopico (ad esempio l'acido tartarico) oltre ad ammettere due forme
enantiomere, ammette una terza forma achirale (quindi sovrapponibile alla propria
immagine speculare), detta forma "meso" e la si indica col prefisso "meso".Modelli
molecolari dei due enantiomeri dell'acido lattico.Esempi di molecole chirali che non
presentano stereocentri sono gli eliceni.
Proprietà delle molecole chirali
Due molecole tra di loro enantiomere possiedono le medesime proprietà fisiche tranne
il potere rotatorio (identico per intensità ma opposto di segno per ognuna di esse) e
mostrano lo stesso comportamento chimico nei confronti di sostanze non chirali.
Diversa è invece la loro interazione chimica nei confronti delle altre molecole chirali
(esattamente come una mano destra, stringendo un'altra mano riesce a distinguere
una mano destra da una sinistra).Una miscela 1:1 di due enantiomeri viene detta
racemo. La miscela dei due enantiomeri non ha le stesse proprietà dell'enantiomero
puro, ad esempio varia il punto di fusione che raggiunge il minimo o, a volte, il
massimo, in corrispondenza del racemo. Questo deriva dalla diversa organizzazione
delle molecole nel cristallo e può essere ricondotto all'esempio in cui una mano,
stringendone un'altra riconosce se è la destra o la sinistra.Nella quasi totalità gli
organismi biologici producono un solo enantiomero di una molecola chirale. Spesso nei
sistemi viventi solo uno dei due enantiomeri di una coppia viene coinvolto nei cicli
metabolici mentre l'altro viene ignorato o può addirittura esercitare effetti dannosi.
Alcuni esempi:
Nel caso dell'acido lattico in figura, l'enantiomero che si forma nei muscoli in seguito a
sforzo è solo il secondo dei due, l'acido (S)-(+)-lattico detto anche acido (L)-(+)-lattico.
L'amido e la cellulosa sono entrambi dei polimeri del glucosio ma l'organismo umano
riesce ad assimilare solo l'amido in cui i legami tra le molecole di glucosio sono del tipo
α(1→4) glicosidici e non la cellulosa in cui tali legami sono β(1→4) glicosidici. Nel caso
delle tarme invece succede il contrario.
Di tutti gli amminoacidi, solo gli L-amminoacidi sono quasi esclusivamente utilizzati
dagli organismi viventi per la sintesi proteica.
La talidomide venne introdotta in Europa nel 1957 come sedativo e antiemetico, salvo
essere ritirata quattro anni più tardi in seguito al manifestarsi di numerosi casi di
malformazioni agli arti a danno dei neonati le cui madri assunsero con questo farmaco
per curare l'emesi gravidica. Alcuni studi suggeriscono che l'attività ipnotica sia legata
all'enantiomero (R), mentre l'(S) è un teratogeno;[6] sta di fatto che anche se si
utilizzasse solo l'isomero (R), questo verrebbe convertito dal metabolismo nella forma
(S).
Proprietà di un oggetto, di una figura geometrica o di un insieme rigido di punti di
non essere sovrapponibile alla propria immagine speculare. L’oggetto chirale e la
sua immagine speculare (indicati come forme enantiomorfe) sono pertanto diversi
e distinguibili. Per es., sono chirali le mani umane, ciascuna delle quali è non
sovrapponibile rispetto all’altra, di cui rappresenta appunto l’immagine speculare.
Il concetto è usato nella fisica delle particelle elementari e, estesamente, in chimica.
Molte molecole organiche sono infatti chirali. Un esempio semplice è rappresentato
da una molecola di forma tetraedrica (struttura tipica dell’idrocarburo più
semplice, il metano CH4) nella quale l’atomo centrale di carbonio sia legato a
quattro atomi diversi tra loro.
L’assenza nella molecola di elementi di simmetria, quali un piano di simmetria, un
centro di inversione e un asse di rotoriflessione, rappresenta una condizione
necessaria perché vi sia chiralità. Le due molecole enantiomorfe sono dette
enantiomeri e sono caratterizzate evidentemente da composizione e legami chimici
identici. Ciò le rende identiche nelle proprietà fisiche e chimiche generali e fa sì che,
nelle normali sintesi chimiche, siano prodotte entrambe, e in quantità eguali. Gli
enantiomeri differiscono però nella posizione relativa degli atomi nello spazio (sono
due configurazioni differenti) e hanno perciò un comportamento diverso verso ciò
che è chirale (per es., le componenti della luce polarizzata o altre molecole chirali).
L’importanza dei composti chimici chirali è andata crescendo negli ultimi decenni
del XX sec. sia per ragioni scientifiche sia per interessi applicativi. Il funzionamento
dei sistemi viventi, infatti, è largamente affidato a molecole chirali dotate di una
delle due possibili configurazioni.
La grande maggioranza degli organismi utilizza, per es., proteine composte da
amminoacidi della serie L, in cui l’atomo di carbonio chirale è dotato di una data
configurazione, e i monosaccaridi impiegati come fonte di energia e come
costituenti dei polisaccaridi e degli acidi nucleici sono quelli della serie D. I
D-amminoacidi e gli L-zuccheri sono rari in natura. Proprio in connessione con
questa chiralità intrinseca dei sistemi viventi, la produzione sintetica di specie
chimiche chirali enantiomericamente pure (cioè in una sola delle due possibili
configurazioni) ha assunto grande rilevanza tecnologica, soprattutto nell’industria
farmaceutica e dei prodotti per l’agricoltura. Le proprietà farmacologiche di due
enantiomeri, infatti, sono spesso molto diverse, come testimoniato anche dal fatto
che i principî attivi ottenuti da sorgenti naturali presentano in genere chiralità ben
precise. In alcuni casi, uno dei due enantiomeri di un principio attivo può avere
addirittura effetti nocivi. Grazie allo sviluppo di nuovi metodi di sintesi organica di
singoli enantiomeri (sintesi asimmetrica) e di separazione di specie chirali da loro
miscele, la produzione e la commercializzazione di prodotti farmaceutici
enantiomericamente puri ha subito un grande incremento a partire dagli ultimi
anni del secolo scorso.
Rappresentazione degli enantiomeri
Vi sono diversi modi per rappresentare le strutture tridimensionali degli enantiomeri su
di un piano bidimensionale (p.e. di una pagina). Nella figura 1 del 2-butanolo si mette in
evidenza la geometria tetraedrica dello stereocentro. La figura 2 rappresenta la
molecola ruotata in modo tale che la catena di atomi di carbonio si trovi sul piano del
foglio. La figura 3 è una rappresentazione abbreviata della figura 2 mentre nella figura
4 è stato omesso l’atomo di idrogeno rendendo implicita la sua presenza.
Denominazione degli stereocentri:il sistema R-S
Poiché gli enantiomeri sono composti differenti, a ciascuno di essi bisogna attribuire un
nome diverso. Per questo scopo i chimici hanno sviluppano il sistema R-S.
L’assegnazione di una configurazione R o S ad uno stereocentro segue varie fasi: 1)
Identificare lo stereocentro e i gruppi ad esso legati; 2) Assegnare una priorità ai gruppi
legati allo stereocentro, da 1 (più alta) a 4 (più bassa), seguendo le stesse regole
descritte in precedenza per assegnare la configurazione E-Z ad un alchene.orientare la
molecola nello spazio in modo che il gruppo a priorità minore (in questo caso
l’idrogeno) sia diretto lontano dall’osservatore. Nella nuova orientazione i gruppi a
priorità maggiore (1, 2 e 3) si dirigono verso l’osservatore mentre quello a priorità
minore (4) è nascosto dal carbonio asimmetrico; 4) Partendo dal gruppo a priorità
maggiore (1) leggere i tre gruppi in ordine di priorità individuando in questo modo un
senso di rotazione. Se il senso è orario il carbonio chirale sarà R, se il senso di rotazione
è antiorario il carbonio chirale sarà S.
Composti Meso
Certe molecole con due o più stereocentri hanno speciali proprietà di simmetria che
riducono il numero di stereoisomeri possibili rispetto a quello calcolato secondo la
formula 2n. Ad esempio, l’acido tartarico esiste come tre isomeri dei quali due sono
una coppia di enantiomeri, cioè (a) e (b) e l’altro è un cosiddetto composto meso. Pur
possedendo due carboni asimmetrici il composto meso risulta achirale e la sua
immagine speculare è perfettamente sovrapponibile all’immagine originale.Una
maniera più semplice per stabilire che una forma meso è achirale è osservare che
possiede un piano di simmetria che divide la molecola in due parti in modo tale che la
metà superiore è l’immagine speculare di quella inferiore. Riassumendo, la forma meso
dell’acido tartarico è una molecola che pur possedendo stereocentri risulta achirale
grazie alla presenza di un piano di simmetria.