Capitolo 6
Alogenuri Alchilici:Sostituzioni
Nucleofiliche ed Eliminazioni
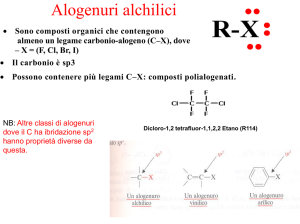
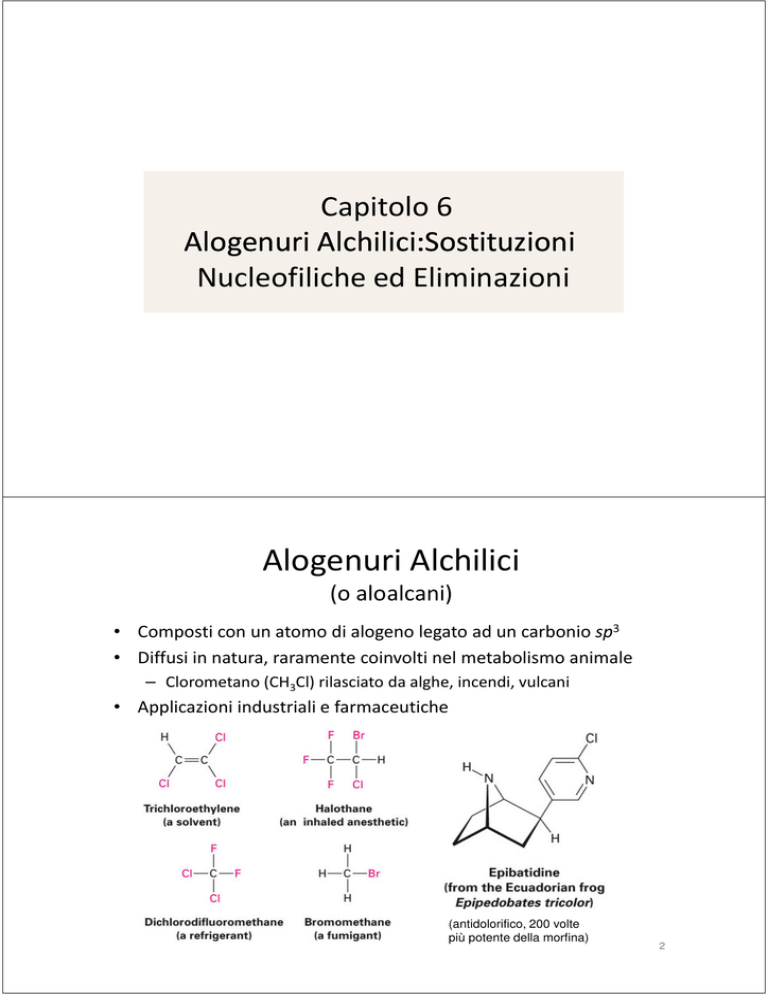
Alogenuri Alchilici
(o aloalcani)
• Composti con un atomo di alogeno legato ad un carbonio sp3
• Diffusi in natura, raramente coinvolti nel metabolismo animale
– Clorometano (CH3Cl) rilasciato da alghe, incendi, vulcani
• Applicazioni industriali e farmaceutiche
(antidolorifico, 200 volte
più potente della morfina)
2
Nomenclatura
•
Alogeno trattato come un sostituente dell’alcano principale
5-Bromo-2,4-dimetileptano
•
2-Bromo-4,5-dimetileptano
Nomi d’uso: si nominano i gruppi alchilici
Ioduro di metile
(iodometano)
Cloruro di isopropile
(2-cloropropano)
Bromuro di cicloesile
(bromocicloesano)
3
Sintesi degli Alogenuri Alchilici
• Addizioni elettrofile di HX and X2 ad alcheni
–
–
–
–
HCl, HBr, e HI danno prodotto Markovnikov
Br2 e Cl2 danno addizioni anti
Composti di F (HF e F2) troppo reattivi
I2 non reattivo
4
Sintesi degli Alogenuri Alchilici
• Reazione degli alcoli (spec. 3i) con HX (Cl, Br, I)
– Coinvolgono carbocationi
5
Sintesi degli Alogenuri Alchilici
• Reazioni degli alcoli 1i e 2i con cloruro di tionile (SOCl2)
e tribromuro di fosforo (PBr3)
– Condizioni blande, non coinvolgono carbocationi
6
Sintesi degli Alogenuri Alchilici
7
Reagenti di Grignard
Alogenuri di alchilmagnesio (RMgX)
• Da alogenuri alchilici (RX), opp. alchenici o arilici, + Mg metallico
in etere o tetraidrofurano (THF)
• Sono composti organometallici (legame carbonio-metallo)
• Non presenti in natura
8
Reagenti di Grignard
base coniugata
fortissima
acido coniugato
debolissimo
pKa= 45-60
9
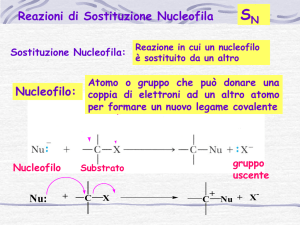
Reazioni di Sostituzione Nucleofila
10
Reazioni di Sostituzione Nucleofila
• Sostituzione di un gruppo uscente (X) con un nucleofilo (Nu)
• Decorre spesso con stereochimica definita
δ+
δ−
Cl
I
Br
OTs
O
O
S
= Ts
O
O
H3C
δ+
δ−
11
HO
+ H3C
Br
HO
CH3 +
Br
H2O
+ H3C
I
HO
CH3 +
I
CH3 +
Br
H
N
I
+ H3C
Br
C
+ H2C
Br
I
N
CH3
CH3
H
H3C
H3C
C
C
CH2
OTs
H3C
C
H
C
+
+
Br
H2
C
CH2
C
H
MgBr
Br
CH2 +
C
H2C
+
H2
C
C
H2
C
H
CH3
Cl
C
C
H2
H
O
OTs
H
C
H2C
O
CH3 + MgBr
2
CH3
+
Cl
12
Cinetica di Reazione
• Legge cinetica: relazione tra velocità di reazione e
concentrazioni dei reagenti
A+B+C…→X +Y+Z…
v = k [A]a ⋅ [B]b ⋅ [C]d ⋅ …
• Ordine di reazione: n = a + b + c +…
Reazione del 1°ordine (o monomolecolare):
v = k [A]
Reazione del 2°ordine (o bimolecolare):
v = k [A]2 oppure v = k [A] ⋅ [B]
k
[X]
costante di velocità, k ∝ exp(‒∆G‡/RT)
concentrazioni molari
13
13
Reazione SN2
(Sostituzione Nucleofila del 2° ordine)
v = k [CH3Br] ⋅ [OH–]
• Avviene in un unico passaggio
• Con stereochimica definita (inversione)
14
15
Reazione SN2: Stereochimica
• Reazione stereospecifica
• La configurazione del centro chirale si inverte
• A causa delle regole di priorità può non esserci inversione formale
16
Reattività SN2: Substrato
17
Reattività SN2: Substrato
18
Reattività SN2: Substrato
Alogenuro vinilico
Alogenuro arilico
19
Reattività SN2: Nucleofilo
• Base di Lewis
• Specie neutra o anionica con doppietto elettronico
– se anionica, il prodotto è neutro
– se neutra, il prodotto è carico positivamente
20
Reattività SN2: Nucleofilo
• Di solito i prodotti carichi positivamente (ottenuti
da nucleofili neutri) perdono un H+ in un passaggio successivo
• Es. H2O, NH3, ROH, RNH2
SN2
SN2
21
Reattività SN2: Nucleofilo
22
Reattività SN2: Nucleofilo
• La nucleofilicità ricalca la basicità (se il sito Nu è lo stesso)
OH- > CH CO - > H O
3
2
2
• Aumenta scendendo lungo un gruppo
I- > Br- > Cl- (ma dipende anche dal solvente)
HS- > OH• E’ maggiore per Nu anionici rispetto ai neutri
OH- > H O
2
23
Reattività SN2: Gruppo Uscente
• Inversamente proporzionale alla basicità
• Alcoli, ammine, eteri, fluoruri non reagiscono
24
Reattività SN2: Alcoli
• Per effettuare una SN2 su un alcol, si converte in un
miglior gruppo uscente
SO2 + HCl
SOCl2
R
OH +
R
X +
H3PO3 + HBr
PBr3
R
OH + TsCl
R
OTs + HCl
O
O
S
O
= Ts
H3C
O
25
Reattività SN2: Eteri Ciclici
Epossidi: eteri ciclici a 3 termini
• Reattivi a causa della tensione angolare
SN2
26
Reattività SN2: Solvente
• Solventi protici (contengono O–H o N–H) ostacolano la SN2
– Stabilizzano il nucleofilo (polare)
– Possono solvatare il nucleofilo tramite legame a idrogeno
27
Reattività SN2: Solvente
• Solventi polari aprotici (polari ma privi di gruppi O–H o N–H)
favoriscono la SN2
– Solvatano preferenzialmente il controione metallico del Nu,
rendendolo “nudo”
(NaN3)
δ−
δ−
δ+
δ+
δ−
δ+
28
Reattività SN2: Sommario
Effetto sui reagenti:
Effetto sullo stato di transizione e/o sui prodotti:
29
30
31
Reazione SN1
(Sostituzione Nucleofila del 1° ordine)
3io
v = k [RX]
• Avviene in più passaggi
• Con perdita della stereochimica
(parziale racemizzazione)
32
v = k [RX]
33
Reazione SN1: Stereochimica
• Intermedio di reazione (carbocatione) achirale
• Si prevede completa racemizzazione di substrati chirali
• Nella realtà la racemizzazione non è mai completa,
leggero eccesso del prodotto di inversione (<20%)
34
Reazione SN1: Stereochimica
35
Reattività SN1: Substrato
•
•
Segue l’ordine di stabilità dei carbocationi
Postulato di Hammond: più stabile è l’intermedio (carbocatione) ad alta
energia, più veloce è la sua formazione
36
Reattività SN1: Substrati Allilici e Benzilici
37
Reattività SN1: Substrato
SN1
38
Reattività SN1: Gruppo Uscente
SN1
• Ordine analogo alla SN2
Acqua come gruppo uscente
39
Reattività SN1: Nucleofilo
SN1
• Non influenza la velocità di reazione
40
Reattività SN1: Solvente
SN1
• Solventi polari (acqua, metanolo) favoriscono la SN1 rispetto
a solventi apolari (cloroformio, etere)
– I solveti polari stabilizzano (solvatano) l’intermedio
carbocationico
41
Reattività SN1: Solvente
42
Sostituzioni Nucleofile Biologiche
• Coinvolgono organodifosfati come substrati
(“equivalenti biologici” degli alogenuri alchilici)
• Il gruppo uscente è lo ione difosfato (PPi)
43
Sostituzioni Nucleofile Biologiche
• Biosintesi dei terpeni, es. Geraniolo (essenza profumata)
44
Sostituzioni Nucleofile Biologiche
• Metilazioni biologiche: reazioni SN2
• Donatore di metile (elettrofilo): SAM (equivalente biologico di CH3X)
• Biosintesi dell’adrenalina dalla noradrelina
45
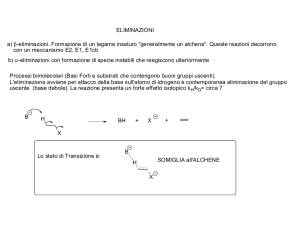
Reazioni di Eliminazione
α
β
Alogenuro alchilico
Base
Alchene
(con atomi di H in β)
• Confronto con le reazioni di sostituzione:
Alogenuro alchilico
Nucleofilo
Alcol
46
Reazioni di Eliminazione:
Regiochimica (regola di Zaitsev)
• Nelle reazioni di eliminazione di HX da un alogenuro alchilico,
si forma preferenzialmente l’alchene più sostituito
47
Reazioni di Eliminazione:
Meccanismo (E1, E2, E1cB)
• Differiscono nella tempistica di scissione dei legami C-H e C-X
• Reazioni del 1° o del 2° ordine
E1
1) Si rompe il legame C-X e si forma un carbocatione
2) Si rompe il legame C-H ad opera della base
48
E2
I due legami si rompono simultaneamente
1) Si rompe il legame C-H ad opera della base e si forma un carbanione
E1cB 2) Si rompe il legame C-X
49
Reazioni di Eliminazione E2
• Favorite da basi forti (OH‒,RO‒)
• Reazione del 2° ordine
v = k [RX] ⋅ [base]
• Avvengono con stereochimica
definita (periplanare)
50
Reazioni di Eliminazione E2: Stereochimica
Geometria anti-periplanare
(sfalsata, energia minore)
Geometria sin-periplanare
(eclissata, energia maggiore)
p
sp3
sp3
p
51
Reazioni di Eliminazione E2:
Stereochimica
•
Negli alogenuri ciclici possono eliminare solo gli alogeni in posizione assiale
52
Reazioni di Eliminazione E2: Stereochimica
•
Si ottiene preferenzialmente l’alchene E o Z corrispondente all’eliminazione anti
53
Reazioni di Eliminazione E1
• Reazione del 1° ordine
v = k [RX]
• Lo stadio lento è il 1°
• Prive di requisiti stereochimici
54
Reazioni di Eliminazione E1
• Reazioni SN1 ed E1 hanno lo stesso intermedio (carbocationico)
• Avvengono spesso in contemporanea (reazioni competitive)
• Entrambe poco selettive
55
Reazioni di Eliminazione E1cB
• Le più comuni nei meccanismi biologici
• Avvengono solitamente su alcoli anziché su alogenuri alchilici
• Cattivo gruppo uscente (–OH) in posizione β a gruppo carbonilico C=O
Stadio
lento
composto
β-idrossi carbonilico
anione stabilizzato per risonanza
composto
carbonilico α,β
β-insaturo
56
Reazioni di Eliminazione Biologiche
(E1cB)
•
Biosintesi dei grassi
(R = ACP)
57
Sommario di Reattività
SN1, SN2; E1, E1cB, E2
Alogenuri Alchilici 1i
• SN2 in presenza di un buon nucleofilo
• E2 in presenza di una base forte
Alogenuri Alchilici 2i
• SN2 in presenza di un buon nucleofilo in solvente polare aprotico
• E2 in presenza di una base forte
• SN1 e E1 (spec. allilici/benzilici) in presenza di nucleofili deboli
e in solvente polare protico
Alogenuri Alchilici 3i
• E2 in presenza di una base forte
• SN1 e E1 in condizioni neutre (es. in acqua o etanolo)
In tutti i casi
• E1cB se il gruppo uscente (spec. OH) è in β a un gruppo carbonilico
58