Alessandro Fornasaro – Fabio Musiani
classe 5^B
3/11/2014
ALCOLI
Struttura della molecola
Gli alcoli sono sostanze organiche che derivano formalmente da un alcano per sostituzione
di un atomo di idrogeno con un gruppo ossidrile (o idrossile) —OH.
ROH (R = gruppo alchilico)
Nomenclatura
La nomenclatura tradizionale degli alcoli si ottiene dal nome del gruppo alchilico preceduto dal termine
alcol.
Nella nomenclatura IUPAC bisogna determinare la catena più lunga contenente il gruppo carbossilico (che
non necessariamente deve essere la più lunga in assoluto) e il suffisso -o dell'alcano corrispondente viene
sostituito dal suffisso -olo dell'alcol.
Pertanto:
CH3OH Metanolo (Alcol metilico)
CH3CH2OH Etanolo (Alcol etilico)
Alcoli primari, secondari e terziari
Gli alcoli possono essere classificati come primari, secondari e terziari a seconda del numero di gruppi
alchilici legati al carbonio che porta il gruppo -OH. Negli esempi riportati in precedenza, l'alcol isopropilico
è un alcol secondario mentre il 2-Etil-1-pentanolo è un alcol primario.
1
Alessandro Fornasaro – Fabio Musiani
classe 5^B
3/11/2014
Proprietà degli alcoli
Gli alcoli metilico, etilico, n-propilico, isopropilico, t-butilico e molti alcoli poliossidrilati (che hanno più
gruppi ossidrilici) sono completamente miscibili in acqua. Gli altri variano fra l'essere debolmente solubili a
insolubili, secondo il numero di atomi di carbonio che hanno per ogni gruppo ossidirlico. In genere un
gruppo ossidrilico può solubilizzare da tre a quattro atomi di carbonio.
Negli alcoli ROH (R = gruppo alchilico) l'idrogeno è debolmente acido (pKa = 15,5÷19) a causa dell'elevata
elettronegatività dell'ossigeno che permette di sopportare in modo efficace una carica negativa:
Gli alcoli hanno un punto di ebollizione assai più alto dei corrispondenti idrocarburi o di molti altri composti
a simile peso molecolare. L'alta solubilità in acqua e i punti di ebollizione inaspettatamente alti possono
essere attribuiti all'intervento di legami a idrogeno intermolecolari.
Particolarità
Il metanolo (o alcol metilico, o spirito di legno) veniva preparato per distillazione secca del legno - da cui il
nome; oggi si produce principalmente per idrogenazione catalitica dell'ossido di carbonio
CO + 2 H₂ → CH₃-OH
L'etanolo (o alcol etilico, o spirito di vino), viene prodotto per fermentazione degli zuccheri nelle bevande
alcoliche, ma quello per uso industriale viene principalmente prodotto per idratazione dell'etene
H+
CH₂= CH₂ + H₂O -----> CH₃-CH₂-OH
Il propanolo (o alcol propilico), composto organico, alcool alifatico derivato dal propano, usato come
solvente
CH₃-CH₂-CH₂-OH
Reazioni
Sostituzione nucleofila
Reazione di disidratazione degli alcoli è la reazione inversa all'addizione di acqua agli alcheni, ed è
detta reazione di eliminazione
Ossidazione: il carbonio è tanto più ossidato quanti più legami forma con l'ossigeno e quanti meno ne
forma con l'idrogeno
Reazione degli alcoli con diazometano: gli alcoli possono essere metilati per reazione con
diazometano in presenza di un acido di Lewis (es. BF3).
2
Alessandro Fornasaro – Fabio Musiani
classe 5^B
3/11/2014
ETERI
Struttura della molecola
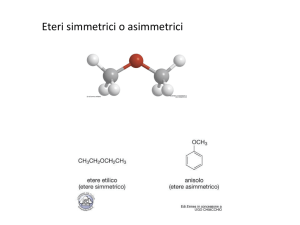
Gli eteri sono composti in cui due gruppi alchilici R ed R' (che possono essere diversi ma anche uguali) sono
legati allo stesso atomo di ossigeno. La loro formula generale è: R—O—R'.
Nomenclatura degli eteri
Per la nomenclatura tradizionale degli eteri i nomi dei due gruppi alchilici o arilici legati all'ossigeno
vanno elencati in ordine alfabetico e a questi si fa seguire la parola etere. Pertanto:
Nella nomenclatura IUPAC gli eteri vengono invece denominati come alcossi-derivati del residuo a catena
più lunga:
Proprietà degli eteri
Gli eteri sono composti a molecola polare. Ciò è dovuto alla geometria angolata del legame R—O—R
causata dall'ibridazione sp3 dell'atomo di ossigeno:
Gli eteri hanno punti di ebollizione piuttosto bassi in quanto non possono associarsi tra di loro mediante
legami a idrogeno. Malgrado questo, la presenza dell'ossigeno permette la formazione di legami a idrogeno
con l'acqua:
Questo è il motivo per cui gli eteri a bassa peso molecolare (in particolare il dimetiletere) sono solubili in
acqua. Per lo stesso motivo gli eteri sono solubili anche negli alcoli.
3
Alessandro Fornasaro – Fabio Musiani
classe 5^B
3/11/2014
Un'altra proprietà degli eteri è che si ossidano facilmente all'aria per dare idroperossidi altamente esplosivi.
Particolarità
Gli eteri (soprattutto se a basso peso molecolare) sono sostanze estremamente pericolose. Ad esempio,
l'etere dietilico è estremamente infiammabile ed altamente volatile; per tali motivi può formare con l'aria
miscele esplosive.
Metodi di preparazione degli eteri
Gli eteri possono essere preparati in vari modi:
Condensazioni di alcoli
Gli eteri possono essere ottenuti per condensazione di alcoli. Tale reazione si ottiene trattando un alcol con
H2SO4. Per favorire la condensazione piuttosto che la disidratazione dell'alcol bisogna operare ad una
temperatura più bassa di quella necessaria per disidratare l'alcol stesso ad alchene.
Sintesi di Williamson
Gli eteri possono essere ottenuti per reazione tra uno ione alcossido (RO-) e un alogenuro alchilico (R-X).
Tale reazione è nota con il nome di sintesi di Williamson.
Reazioni degli eteri
Gli eteri sono generalmente composti con una bassa reattività. Per questo motivo e per la loro capacità di
sciogliere sostanze apolari, vengono spesso utilizzati come solventi in molti reazioni organiche.
Un'altra proprietà degli eteri è che si ossidano facilmente all'aria per dare idroperossidi altamente esplosivi.
La reazione tipica degli eteri è la scissione acido-catalizzata. Attraverso questa reazione si ha la rottura del
legame C-O degli eteri.
Eteri ciclici
Gli eteri ciclici invece sono composti ciclici contenenti un atomo di ossigeno nell'anello.
4
Alessandro Fornasaro – Fabio Musiani
classe 5^B
3/11/2014
Epossidi
Gli epossidi (o ossirani) sono i derivati dell'ossido di etilene.
Eteri corona
Gli eteri corona (Crown Ethers) polieteri ciclici ad anello grande nella cui struttura si ripete l'unità -CH₂CH₂-O-.
5