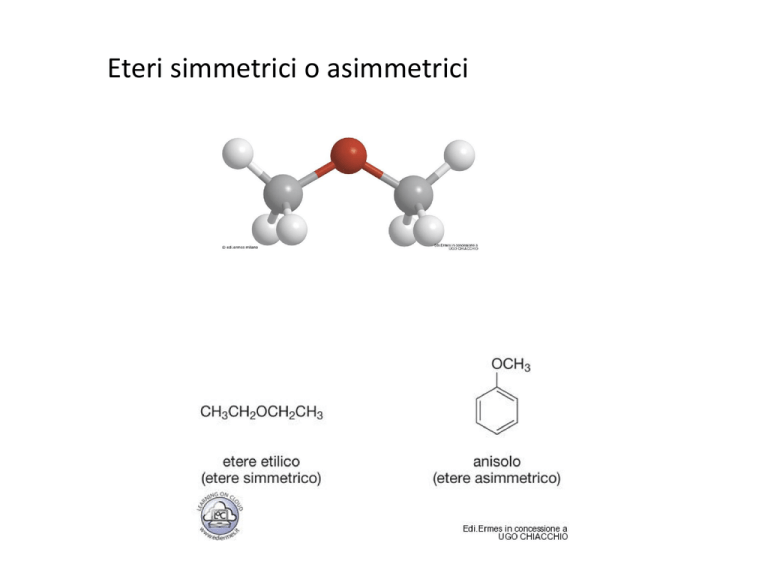
Eteri simmetrici o asimmetrici
Proprietà chimico-fisiche degli eteri
L'ossigeno etereo si protona in presenza di acidi forti
portando alla formazione di un etere protonato
Preparazioni
2) Sintesi di Williamson degli eteri
La sintesi di Williamson degli eteri si può utilizzare per
preparare gli eteri asimmetrici, a patto che il substrato che
subisce il processo SN2, cioè l'alogenuro o il tosilato o il
solfonato alchilico, siano metilici, primari, benzilici e allilici.
Preparazione dello ione alcossido (RO-).
Lo ione alcossido, RO-, nucleofilo della sintesi di Williamsom, si ottiene dall'alcol
corrispondente per reazione di riduzione con sodio metallico (Na) o con idruro di
sodio (NaH).
La sintesi di Williamson degli eteri è utilizzabile anche in versione intramolecolare, per la
formazione di eteri ciclici.
3) Disidratazione degli alcoli con formazione degli eteri
Se l'alcol è primario e la temperatura non è molto elevata, si verifica
una SN2 (al posto di una E1) che porta alla formazione di un etere
Confronto: Disidratazione degli alcoli con
formazione degli alcheni .
Gli alcoli, in presenza di acidi minerali
concentrati, vanno incontro a
disidratazione con formazione degli alcheni
corrispondenti attraverso un meccanismo
di eliminazione E1 a temperature più
elevate
Reattività
Poiché gli eteri sono praticamente inerti a tutti i tipi di reattivi, vengono
spesso utilizzati come solventi nelle reazioni organiche. I più usati sono
l'etere etilico e il tetraidrofurano, THF
.
Scissione degli eteri con acidi alogenidrici
L'unica reazione che avviene sugli eteri è la scissione con acidi alogenidrici che
richiede condizioni drastiche e acido bromidrico e iodidrico. Il prodotto finale, che si
forma attraverso una rottura del legame carbonio-ossigeno, è un alogenuro alchilico
Nel primo stadio l'acido protona l'atomo di
ossigeno con la formazione dell'etere
protonato. Si tratta di una reazione acido-base
secondo Brønsted-Lowry
meccanismo SN1
meccanismo SN2
Epossidi
R1
O
H
O
R
R
R
+
O
R
R
R
1
R CO2OH
+ R1CO2H
O
R1
DBU
O
+
R1
R1
t-Bu
O O
t-BuOOH
Epossidazione elettrofilica
O
O
O
Epossidazione nucleofilica
R
R
R
Reazione di Darzens
-
Me3CO
EtO2C
Cl
R
EtO2C
EtO2C
Cl
Cl
R
O
R
O
R
EtO
R O
O
R
su substrati elettronpoveri
Reattività degli epossidi: apertura dell'anello
In condizioni acide gli epossidi reagiscono con gli acidi alogenidrici per
fornire le aloidrine; per reazione con l'acqua forniscono un diolo vicinale (o
glicole) e, con gli alcoli, un 2-alcossi-alcol
Nel primo stadio, si ha l'attacco nucleofilo dell'ossigeno epossidico sull'acido
bromidrico e la formazione dell'epossido protonato. Il bromo si allontana
come bromuro
Nel secondo stadio, il bromuro attacca dal retro (cioè dal lato opposto dell'ossigeno a ponte)
secondo un meccanismo di tipo SN2 uno dei due atomi di carbonio legati all'ossigeno,
portando alla formazione dell'aloidrina.
Dioli
Il gruppo migrante è ANTI:
OH
Me
Me
OH
Me
OH
Me
- H+
Me
O
Me
Me
Me
OH2
H+
H+
OH
OH
O
Me
OH2
OH
Me
- H+
Me
Me
La reazione di trasposizione può avvenire, anche, in catalisa basica, trasformando il diolo nel monotosilato
OTs
Me
B
OTs
O
Me
HO
Me
O
R
R1
R1
R
R1
R1
R
OH
OH
R
Pb(OAc)4
- 2 AcOH
OH
H5IO6
OH
- 2 H2O
R
R1
R1
R
R1
R1
R
O
OAc
Pb
OAc
O
R
O O OH
I OH
O OH
- Pb(OAc)2
R
O
+
R1
R1
R
- H3IO4
R
O
R
O
+
R1
O
R1
Scissione
Ossidativa