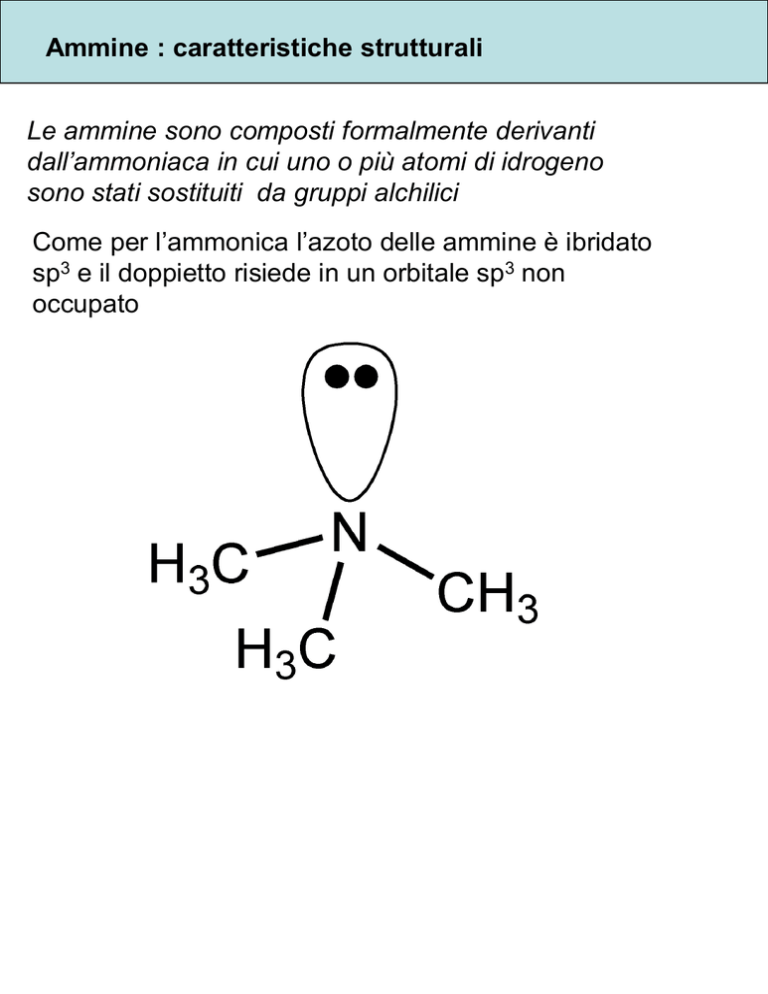
Ammine : caratteristiche strutturali
Le ammine sono composti formalmente derivanti
dall’ammoniaca in cui uno o più atomi di idrogeno
sono stati sostituiti da gruppi alchilici
Come per l’ammonica l’azoto delle ammine è ibridato
sp3 e il doppietto risiede in un orbitale sp3 non
occupato
Ammine : nomenclatura
Esistono ammine primarie, secondarie e terziarie .
La classificazione si basa sul numero di gruppi alchilici legati
all’azoto
Confronto con alcoli e alogenuri alchilici in cui si guarda il numero di
gruppi alchilici legati al carbonio che porta il gruppo OH o
l’alogenuro
Ammine : nomenclatura
Il nome d’uso prevede di nominare i gruppi alchilici legati all’azoto in
ordine alfabetico seguito da ammina in una sola parola
Nel sistema IUPAC la desinenza «o» dell’alcano è sostituita dal
suffisso «ammina». Il carbonio a cui è legato l’azoto si indica con
un numero
I sostituenti sono disposti in ordine alfabetico e nominati in ordine
alfabetico, ma preceduti da un N ad indicare che sono legati
all’azoto.
Ammine : nomenclatura
Ammine cicliche sature
Nel sistema IUPAC possono essere denominate come un
cicloalcano usando il prefisso aza per indicare la presenza
dell’azoto. Sono però accettati anche i nomi d’uso.
Le ammine possono formare sistemi eterociclici
ovvero cicli in cui uno o più atomi non sono carbonio
ma altri atomi (eteroatomi)
Gli anelli eterociclici sono numerati in modo da
assegnare all’eteroatomo il numero più basso possibile
Sali di ammonio quaternari
I composti azotati con quattro gruppi alchilici legati all’azoto
(che quindi acquista una carica formale positiva) sono detti
sali di ammonio quaternari
Si utilizza la nomenclatura dei sali. Il nome del catione si
ottiene denominando i gruppi alchilici legati all’azoto in
ordine alfabetico seguito dalla parola ammonio
Impiego
Battericida
Catalizzatori a trasferimento di fase
Ammine : proprietà
I punti di ebollizione sono relativamente elevati perché le
ammine possono formare legami ad idrogeno. Sono
comunque più bassi di quelli degli alcoli corrispondenti
perché l’N è meno elettronegativo dell’O e quindi forma
legami ad idrogeno più deboli
Poiché le ammine primarie hanno due legami NH i legami ad
idrogeno sono più importanti che nella ammine secondarie,
mentre le ammine terziarie non possono formare legami ad
idrogeno
Solubilità : le ammine primarie a basso peso molecolare
sono solubili in acqua perché formano legami ad idrogeno,
risultano più solubili di ammine secondarie e terziarie a
parità di peso molecolare .
Ammine : l’azoto come centro di asimmetria
Se all’azoto di un sale di ammonio quaternario sono legati
quattro gruppi diversi questo diventa un centro asimmetrico
Inversione delle ammine
Nel caso delle ammine uno dei gruppi è il doppietto
elettronico. Gli enantiomeri non possono essere
separati perché si interconvertono rapidamente a
temperatura ambiente. Il processo è anche descritto
come inversione ad ombrello
Ammine : reattività
Le ammine sono caratterizzate da una spiccata basicità
e nucleofilia
Le ammine come basi
Le ammine sono tra le più comuni basi organiche
Se consideriamo i sali di ammonio …
Lo ione anilinio è molto più
acido perché la base
coniugata è molto più
stabile per
delocalizzazione
elettronica
D’altra parte le ammine sono molto poco acide
Anche le ammine eterocicliche alifatiche hanno basicità
comparabile alle ammine lineari
Se consideriamo i sali di ammonio …
Le ammine come nucleofili
Alchilazione
Le ammine reagiscono come nucleofili in reazioni di
sostituzione nucleofila
Acilazione
Le ammine reagiscono come nucleofili in reazioni di
addizione eliminazione (sostituzione nucleofila acilica)
Le ammine come nucleofili
Condensazione
Le ammine 1° e 2° reagiscono come nucleofili dando
addizione a composti carbonilici ed eliminazione a formare
immine o enammine
Le ammine reagiscono come nucleofili in reazioni di
addizione coniugata.
Reazione delle ammine con acido nitroso
La reazione di ammine primarie alifatiche o aromatiche
con nitrito in acido porta ai sali di diazonio
Si genera come intermedio altamente elettrofilo lo ione
nitrosonio dall’acido nitroso per perdita di una
molecola d’acqua
Reazione delle ammine con acido nitroso
Sali di arendiazonio sono stabili
Reazione delle ammine con acido nitroso
Sali di alchildiazonio non sono stabili e si decompongono
Con allontanamento dell’azoto e formazione di un carbocatione
I sali di arendiazonio come intermedi sintetici
I sali di arendiazonio sono stabili e sono intermedi sintetici
estremamente versatili poiché Il gruppo diazonio può
essere sostituito da una varietà di nucleofili.
La reazione di sostituzione è favorita perché il gruppo uscente è
una molecola stabile che si allontana come gas
Reazione di Sandmeyer: sostituzione con un sale rameoso
I sali di arendiazonio come intermedi sintetici
Per aggiunta di ioduro di potassio il gruppo diazonio viene
sostituito dallo iodio
Reazione di Schiemann: Per riscaldamento in presenza di
HBF4 è possibile introdurre un atomo di fluoro sull’anello
aromatico.
Per riscaldamento in soluzioni acquose acide è possibile
sostituire il gruppo diazonio con OH ottenendo il
corrispondente fenolo.
I sali di arendiazonio come intermedi sintetici:
Azocomposti
I sali di arendiazonio possono anche essere usati come
elettrofili nelle reazioni di sostituzione elettrofila aromatica
Le reazioni devono essere condotte a basse temperature
perché i sali di diazonio sono instabili. Quindi la reazione
può avvenire solo con composti aromatici fortemente attivati
come aniline o fenoli
Il prodotto della reazione è un azocomposto
Azocomposti di questo tipo trovano applicazione come
coloranti: coloranti azoici
Es:metilarancio
I sali di arendiazonio come intermedi sintetici: azocomposti
Meccanismo delle reazioni di sostituzione elettrofila aromatica
con sali di arendiazonio
Rosso para
Gli azocomposti possono esistere nelle forme cis e trans.
Il trans è notevolmente più stabile
Reazioni delle ammine secondarie con acido nitroso
Le alchil e arilammine secondarie reagiscono con lo ione
nitrosonio a dare le nitrosammine e non ioni diazonio
Il primo stadio della reazione è analogo a quello delle
ammine primarie ma la reazione non procede oltre perché
non può essere eliminato il protone per dare lo ione diazonio
Ammine : metodi di sintesi
Sintesi di Gabriel ammine primarie
Riduzione di nitrocomposti
Ammine : metodi di sintesi
Riduzione di ammidi
Ammine : metodi di sintesi
Riduzione di nitrili
Ammine : metodi di sintesi
Amminazione riduttiva
Sali di ammonio quaternari: eliminazione di Hoffman
La reazione di uno ione ammonio quaternario con lo ione
idrossido è detta eliminazione di Hofmann.
E’ richiesto calore per eliminare l’ammina terziaria che
rappresenta un gruppo uscente relativamente debole.
La reazione procede con un meccanismo di tipo E2,
concertato in un solo stadio
Sali di ammonio quaternari: eliminazione di Hoffman
Regiochimica dell’eliminazione
Se ci sono più posizioni b allora l’alchene che si forma come
prodotto principale è quello derivante dall’eliminazione del
protone dal carbonio che porta il maggior numero di idrogeni
ovvero si forma l’alchene meno sostituito
Eliminazione anti-Zaitsev
Sali di ammonio quaternari: eliminazione di Hoffman
Perché viene violata la regola di Zaitsev
Nell’eliminazione degli
alogenuri alchilici secondo
Zaitsev con formazione
dell’alchene più sostituito
l’alogenuro è un ottimo gruppo
uscente che si allontana
rapidamente quando lo ione
idrossido comincia a rimuovere
il protone formando uno stato
di transizione simile all’alchene
Gli ioni ammonio (come i
fluoruri) hanno gruppi uscenti
peggiori e pertanto si forma
una parziale carica negativa
sul carbonio formando uno
stato di transizione simile ad
un carbanione, pertanto si
formerà preferenzialmente il
carbanione più stabile ovvero
primario>secondario>
terziario
L’eliminazione avviene solo dagli idrossidi di ammonio. È possibile convertire
un alogenuro di ammonio in un idrossido per trattamento con ossido di argento