Scienze I
I.I.S.S. “BOSCARDIN” – VICENZA
A.S. 2016/2017
CHIMICA MATERIALI E BIOTECNOLOGIE
Articolazione: BIOTECNOLOGIE AMBIENTALI
Programmazione di dipartimento di
CHIMICA ORGANICA E BIOCHIMICA
Classe QUARTA
TEORIA
* saperi di base
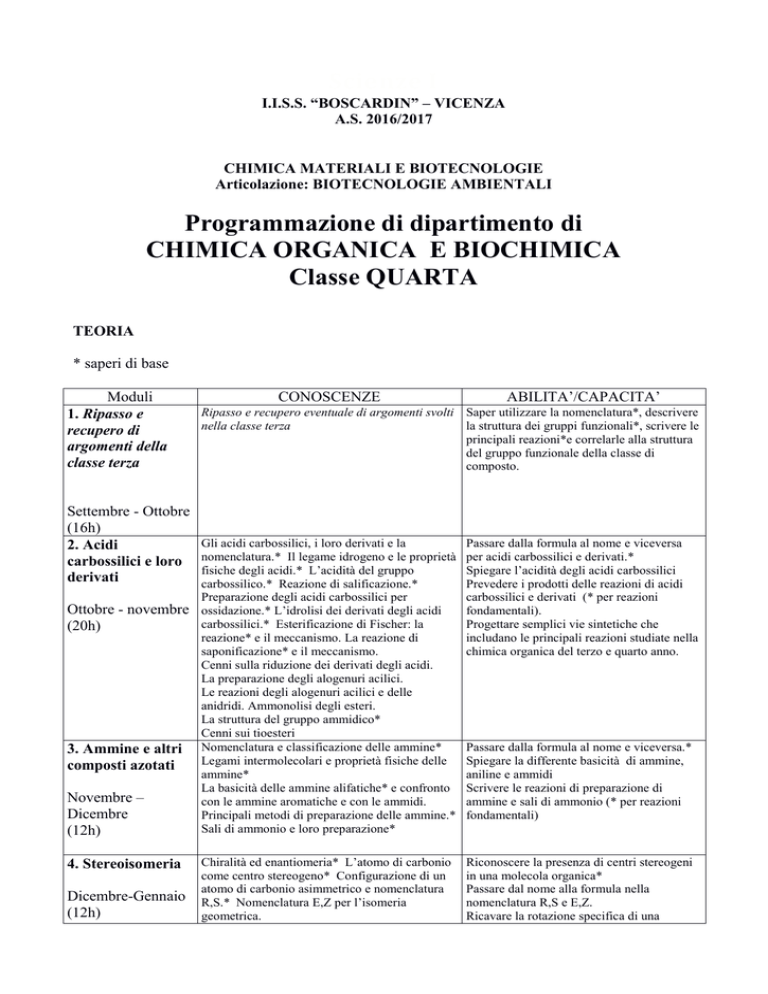
Moduli
1. Ripasso e
recupero di
argomenti della
classe terza
Settembre - Ottobre
(16h)
2. Acidi
carbossilici e loro
derivati
Ottobre - novembre
(20h)
3. Ammine e altri
composti azotati
Novembre –
Dicembre
(12h)
4. Stereoisomeria
Dicembre-Gennaio
(12h)
CONOSCENZE
ABILITA’/CAPACITA’
Ripasso e recupero eventuale di argomenti svolti Saper utilizzare la nomenclatura*, descrivere
nella classe terza
la struttura dei gruppi funzionali*, scrivere le
principali reazioni*e correlarle alla struttura
del gruppo funzionale della classe di
composto.
Gli acidi carbossilici, i loro derivati e la
nomenclatura.* Il legame idrogeno e le proprietà
fisiche degli acidi.* L’acidità del gruppo
carbossilico.* Reazione di salificazione.*
Preparazione degli acidi carbossilici per
ossidazione.* L’idrolisi dei derivati degli acidi
carbossilici.* Esterificazione di Fischer: la
reazione* e il meccanismo. La reazione di
saponificazione* e il meccanismo.
Cenni sulla riduzione dei derivati degli acidi.
La preparazione degli alogenuri acilici.
Le reazioni degli alogenuri acilici e delle
anidridi. Ammonolisi degli esteri.
La struttura del gruppo ammidico*
Cenni sui tioesteri
Nomenclatura e classificazione delle ammine*
Legami intermolecolari e proprietà fisiche delle
ammine*
La basicità delle ammine alifatiche* e confronto
con le ammine aromatiche e con le ammidi.
Principali metodi di preparazione delle ammine.*
Sali di ammonio e loro preparazione*
Passare dalla formula al nome e viceversa
per acidi carbossilici e derivati.*
Spiegare l’acidità degli acidi carbossilici
Prevedere i prodotti delle reazioni di acidi
carbossilici e derivati (* per reazioni
fondamentali).
Progettare semplici vie sintetiche che
includano le principali reazioni studiate nella
chimica organica del terzo e quarto anno.
Chiralità ed enantiomeria* L’atomo di carbonio
come centro stereogeno* Configurazione di un
atomo di carbonio asimmetrico e nomenclatura
R,S.* Nomenclatura E,Z per l’isomeria
geometrica.
Riconoscere la presenza di centri stereogeni
in una molecola organica*
Passare dal nome alla formula nella
nomenclatura R,S e E,Z.
Ricavare la rotazione specifica di una
Passare dalla formula al nome e viceversa.*
Spiegare la differente basicità di ammine,
aniline e ammidi
Scrivere le reazioni di preparazione di
ammine e sali di ammonio (* per reazioni
fondamentali)
5. Carboidrati
Febbraio-Marzo
(20h)
6. Lipidi e
detergenti
Marzo-Aprile (16h)
7. Polimeri
sintetici
Maggio-giugno
(12h)
L’attività ottica degli enantiomeri*
Il polarimetro e la misura della rotazione
specifica*
Proiezioni di Fischer* Diastereoisomeria. *
Composti meso.
molecola da misure sperimentali*
Disegnare la proiezione di Fischer di
semplici molecole.
Definizione e classificazione dei carboidrati.*
Gliceraldeide e diidrossiacetone* Proiezioni di
Fischer dei principali monosaccaridi* Epimeri*
La formazione delle strutture emiacetaliche* e le
proiezione di Haworth dei principali
monosaccaridi*. Anomeria* e mutarotazione.
Conformazioni stabili dei monosaccaridi.
Derivati di riduzione e di ossidazione dei
monosaccaridi.
Disaccaridi: la natura del legame acetalico*;
struttura e proprietà dei principali disaccaridi*.
Polisaccaridi*: struttura e proprietà
caratteristiche di amido, glicogeno e cellulosa.
Cenni su altri derivati dei monosaccaridi:
zuccheri fosfati, deossizuccheri,
amminozuccheri.
Saper correlare le caratteristiche strutturali
principali dei più importanti monosaccaridi,
disaccaridi e polisaccaridi alle principali
funzioni biologiche di tali molecole.
Saper rappresentare mediante formule di
struttura di Fischer e Haworth tali molecole
(*monosaccaridi principali).
Interpretare dal punto di vista chimico la
formazione delle strutture emiacetaliche e
del legame glicosidico*
Triacilgliceroli*: struttura generale,
classificazione, proprietà fisiche, funzione
biologica.
Idrogenazione degli oli vegetali
La reazione di saponificazione e le proprietà dei
saponi*
I detergenti sintetici*: struttura chimica e azione
Glicerofosfolipidi*: struttura e funzione
biologica.
Terpeni: unità isoprenica, esempi di terpeni e
terpenoidi; struttura del colesterolo*; esempi di
composti steroidei.
Correlare le strutture dei lipidi alle loro
principali funzioni biologiche*
Correlare la struttura di saponi e detergenti
alla loro attività.*
Definizione e classificazione dei polimeri
sintetici*
Polimerizzazione per addizione: addizione
radicalica*, reticolazione; esempi di polimeri di
addizione. Gomma naturale e vulcanizzazione.
Polimerizzazione per condensazione: esempi di
poliesteri e poliammidi*; poliuretani; resine
termoindurenti. Polimeri biodegradabili*
Classificare in base alla formula di struttura
un polimero e prevederne le principali
caratteristiche tecnologiche.
LABORATORIO
Si prevede lo svolgimento di esperienze connesse con i contenuti teorici sviluppati nei moduli
suindicati, riguardanti ad esempio: tecniche di separazione e di purificazione, analisi qualitativa,
determinazione di proprietà fisiche, sintesi di composti organici. In particolare sono state
concordate in dipartimento le seguenti esperienze:
Ripasso ed eventuale esecuzione di esperienze del terzo anno non svolte
Riconoscimento di aldeidi con i reattivi: Fehling, Benedict e Tollens
Reazione di saponificazione
Esterificazione: sintesi dell’aspirina.
Esterificazione: sintesi dell'acetato di isoamile (facoltativo)
Saggi per il riconoscimento degli zuccheri riducenti: Fehling, Benedict e Tollens.
Idrolisi acida del saccarosio (zucchero invertito).
Uso del polarimetro.
Costruzione di curva di taratura polarimetrica del saccarosio.
Riconoscimento dei polisaccaridi con il reattivo di Lugol.
Idrolisi acida dell'amido.
Ricerca dei lipidi negli alimenti con il reattivo Sudan III (facoltativo)
Estrazione della trimiristina dalla noce moscata
Produzione di biodiesel (facoltativo)
L’attività di laboratorio si propone in questa disciplina il raggiungimento dei seguenti obiettivi:
(*contenuti e abilità da conseguire per il livello base)
Conoscere e applicare le norme di sicurezza nel laboratorio chimico;*
Conoscere e saper utilizzare strumenti di laboratorio e vetreria;*
Individuare e gestire le informazioni per organizzare le attività sperimentali;*
Effettuare l’elaborazione dati delle esperienze proposte;*
Interpretare dati e risultati sperimentali in relazione a semplici modelli teorici di
riferimento;*
Redigere relazioni tecniche e documentare le attività individuali e di gruppo relative a
situazioni professionali;*
Controllare progetti e attività, applicando le normative sulla protezione ambientale e sulla
sicurezza;
Individuare e gestire le informazioni per organizzare le attività sperimentali.
UTILIZZO DELLE ORE CURRICOLARI (132 ORE)
Totale ore di lezione/attività di laboratorio/verifiche orali: 108
Ore previste per verifiche teoriche scritte 10
ore previste per verifiche pratiche scritte: 6
Ore utilizzabili per attività di recupero in itinere: 8