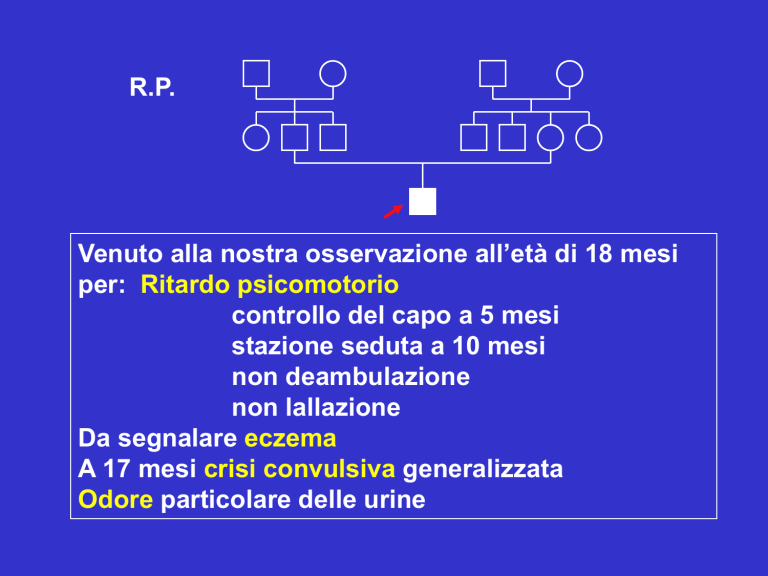
R.P.
Venuto alla nostra osservazione all’età di 18 mesi
per: Ritardo psicomotorio
controllo del capo a 5 mesi
stazione seduta a 10 mesi
non deambulazione
non lallazione
Da segnalare eczema
A 17 mesi crisi convulsiva generalizzata
Odore particolare delle urine
Indagini praticate
Routine nella norma
EEG: attività mal organizzata per l’età
Ammoniemia, EAB, ac. lattico nella norma
FeCl3 positivo
Profilo aminoacidi plasmatici: aumento
della fenilalanina (24 mg/dl)
Diagnosi: fenilchetonuria
Attualmente grave handicap neurologico
M.C.P.
Alla nascita screening per fenilchetonuria:
positivo
Conferma della diagnosi mediante profilo degli
aminoacidi plasmatici
Inizia dieta a basso contenuto di fenilalanina
Attualmente normale sviluppo psicomotorio
guanosina trifosfato
diidroneopterina trifosfato
6-piruvoil tetraidropterina
tetraidrobiopterina
q-diidrobiopterina
Tetraidro biopterina
4-a-carbinolamina
Ac. 2-OH fenilacetico
Ac. fenilacetico
Ac. fenillattico
Ac. fenilpiruvico
fenilalanina
Fenilalanina
idrossilasi
tirosina
Precursore
Enzima
Substrato
Intossicazione
Prodotto
Metabolita
Fenilchetonuria
Ereditarietà: autosomica recessiva
Difetto enzimatico: fenilalanina idrossilasi
Frequenza: 1: 10000
Quadro clinico: ritardo psicomotorio
compromissione neurologica
convulsioni
eczema
cute e capelli chiari
Fenilchetonuria
Diagnosi: screening neonatale
escrezione urinaria di metaboliti
aumento della Phe plasmatica
analisi molecolare
Fenilchetonuria
analisi molecolare
Il gene della PAH è stato clonato
Le mutazioni più frequenti sono:
R261Q
IVS-546
L48S
Terapia dietetica della PKU
obiettivi
Mantenere la Phe post-prandiale (2-4 ore dopo un
pasto) tra 2 e 6 mg/dl (oltre i 10 anni tra 2 e 8
mg/dl)
Mantenere la Tyr post-prandiale tra 50 e 100
mmol/l
Mantenere un adeguato stato nutrizionale
Mantenere una normale crescita
Prevenire il ritardo mentale
F.Maria
gravidanza normale
nata a termine da parto eutocico
dimessa in 3a giornata in buone
condizioni
ricoverata dopo 1 giorno in terapia
intensiva neonatale per torpore, rifiuto
dell’alimentazione, ipotonia, crisi
toniche
In ospedale:
EAB
ammoniemia
ac. lattico
nella norma
nella norma
nella norma
odore caratteristico delle urine
-DNPH positivo
-LEU 3056 mM, ILE 339, VAL 740
Scompenso metabolico acuto
chetosi
Aminoacidemia
Pattern aminoacidi
specifico
Leucinosi
Acidosi
iperammoniemia
Precursore
Enzima
Substrato
Intossicazione
Prodotto
Metabolita
MSUD
Aminoacidi
a catena
ramificata
a-chetoacidi
Dieta
Proteine tessutali
Leucina
Isoleucina
Valina
a-cheto-
a-cheto-3-
a-cheto-
isocaproico metilvalerico isovalerico
Deidrogenasi
aminoacidi
ramificati
Acetil-CoA
+
acetoacetato
Acetil-CoA
+
Propionil-CoA
Succinil-CoA
Propionil-CoA
Succinil-CoA
A 3 anni
diarrea acuta per 2 giorni
portata a ricovero d’urgenza
disidratazione
coma
MSUD
Terapia dello scompenso acuto
Eliminare dalla dieta ILE, LEU, VAL
Fornire alimentazione normo-iper calorica (120150 kcal/kg/die per bambini, 80-100 per ragazzi,
40-50 per adulti) con integratori calorici e
formule prive di ILE, LEU, VAL (gavage,
glucosata, lipidi iv)
Fornire adeguato apporto di liquidi (gavage, iv)
Correggere squilibri associati (disidratazione,
acidosi, elettroliti)
TERAPIA DELLO SCOMPENSO ACUTO
Se miglioramento dei parametri biochimici e
clinici:
graduale reintroduzione delle proteine
naturali e dei precursori.
In caso di mancata risposta:
dialisi
Se necessario assistenza in terapia intensiva
Proteine tessutali
Carboidrati
Transaminazione
glutamato
Urea
Proteine della dieta
Aminoacidi
Azoto non
proteico
Transaminazione
Acetil-CoA
Ciclo
dell’acido
citrico
CO2
Corpi
chetonici
Metabolismo
degli
aminoacidi
Caso clinico
Nato da TC a 38 settimane
Peso kg 4,450
Nessun problema perinatale
A 3 gg ipotonia, scarsa reattività, polipnea
Ricoverato in una TIN della provincia di Salerno
EAB pH 7.0
BE -27.4
HCO3 4.5
Na 135
K 5.0
Cl 108
Ammoniemia 400 mmol/l
Glicemia 65
acido lattico 2.8
Ca 6.8
Emocromo nella norma Emocultura ?
Rachicentesi nella norma
Funzionalità epatica
nella norma
Chetoni urinari ++
Correzione con bicarbonati, alimentazione sospesa,
programma infusionale
Scompenso metabolico acuto
chetosi
Acidosi
Latticoacidemia
iperammoniemia
Organico acidemie
GC/MS
Diagnosi specifica
di organico acidemia
Trasferito alla SAAN del Dipartimento di Pediatria
Polipnea, assenza di reattività, clonie
EAB pH 7.31
EB -8.3
HCO3 12
Ammoniemia 417 mmol/l
Ca 6
Raccolta campione per acidi organici urinari
Dieta per gavage a basso apporto proteico (0.5 g/kg/die)
Infusione per integrazione di liquidi e calorie
Carnitina
Miglioramento clinico
Risposta acidi organici: aumento di 3-OH-propionato, 3OH-isovalerato, metilcitrato
Diagnosi: Propionicoacidemia
Propionico acidemia
Frequenza: 1:100000
Ereditarietà: autosomica recessiva
Difetto di base: propionil-CoA-carbossilasi (PCCA,
PCCB)
Quadro clinico
Forme acute
latenza
vomito, rifiuto dell’alimentazione,
crescita stentata, disidratazione,
ipotonia, acidosi, iperammoniemia,
coma, segni neurologici
Forme intermittenti o croniche
Dieta
Proteine tessutali
Isoleucina
Valina
Metionina
Treonina
Ac. Grassi a catena dispari
adenosilcobalamina
PropionilCoA
MetilmalonilCoA
Propionil-CoA
carbossilasi
Ac. propionico
Metilmalonil-CoA
mutasi
Ac. Metilmalonico
SuccinilCoA
Metilmalonico acidemia
Frequenza: 1:20000
Ereditarietà: autosomica recessiva
Difetto di base: metilmalonil CoA mutasi, dif. sintesi
cofattore (B12)
Quadro clinico
Forme acute
latenza
vomito, rifiuto dell’alimentazione,
crescita stentata, disidratazione,
ipotonia, acidosi,iperammoniemia,
coma, segni neurologici
Forme intermittenti o croniche
MMA-PA
Diagnosi di laboratorio
Acidosi
Iperammoniemia
Chetosi
Test qualitativi urinari (paranitroanilina)
Aminoacidemia quantitativa: aumento di GLY, ALA
Ac organici urinari (metilcitrato, propionilglicina,
ac. tiglico, 3-OH-propionato, metilmalonato o
propionato)
Profilo acilcarnitine plasmatiche (TMS)
Dosaggio enzimatico in fibroblasti
Analisi molecolare
MMA-PA
terapia
Dieta: restrizione di ILE, VAL, THR, MET, ac. grassi a
catena dispari
Integrazione con miscele di aminoacidi prive di
precursori
Normale apporto calorico
Biotina: 10-30 mg/die (cofattore di PCC)
B12: 1 mg/die (cofattore di mutasi)
OH-B12: nei deficit di sintesi di B12 (cblC, cblD)
Carnitina 100 mg/kg/die
Metronidazolo
MMA-PA
Terapia dello scompenso acuto
Eliminare parzialmente o totalmente dalla dieta le
proteine
Fornire alimentazione normo-iper calorica (120-150
kcal/kg/die per bambini, 80-100 per ragazzi, 40-50 per
adulti) con integratori calorici e formule prive di
precursori (gavage, glucosata, lipidi iv)
Nutrizione enterale: riduce lipolisi
Fornire adeguato apporto di liquidi (gavage, iv)
Correggere squilibri associati (disidratazione, acidosi,
elettroliti)
Carnitina i.v., metronidazolo
C.F.
Nata a 38 sett. con TC
Sofferenza fetale. Oligoidramnios.
Peso alla nascita Kg 2600
In 1a gg di vita: Ipotermia (Tc 35.5), ipoglicemia (10 mg),
Ipertransaminasemia e acidosi metabolica
Anamnesi familiare negativa. Genitori non consanguinei
In 4a gg per il persistere dell’ipoglicemia viene trasferita
alla TIN dell’Ospedale Annunziata
Colorito roseo pallido. Normale il tono muscolare.
Addome globoso. Fegato a 3 cm dall’arco costale
Attività cardiorespiratoria valida e ritmica
Glicemia 6
GB 11100
PLT 209000
Colesterolo 122
GR 3130000
ALT 71
Trig 676
Hb 11.5 Ht 35
AST 300
Emocoltura : Neg
Ac Lattico : 77.5 mg/100ml
Aminoacidemia: di Ala
Aminoaciduria: nella norma
Corpi chetonici urinari : +
Profilo glicemico:
ipoglicemia dopo due ore e mezzo
dalla somministrazione del pasto
Inizia alimentazione frazionata con 12 pasti/die
sospettata diagnosi di Glicogenosi tipo I
trasferita presso il Dipartimento di Pediatria
Peso 2900 (10° pc) Alt 50 (10°-25° pc) CC 37 (50°pc)
Epatomegalia
GR 3500000 Hb 11.6 Ht 33.9
GB 8360 PLT 653000
AST 222
ALT 174
GGT 1212
TRIG 908
Profilo Glicemico: si riconferma la ridotta tolleranza
glicemica al digiuno
Glicogenosi
Diagnosi
Quadro clinico
Epatomegalia, stentata crescita, crisi
ipoglicemiche, ipotonia
Quadro bioumorale
Ipoglicemia, acidosi lattica, iperuricemia,
dislipidemia, ipertransaminasemia, iperCK
Prove da carico o da provocazione in vivo
Dosaggio enzimatico
Analisi molecolare
Test da carico con glucagone
160
Glicemia (mg/dl)
dopo pasto
a digiuno
120
80
40
GSD I
Tempo (min)
0
10
20
30
40
50
60
Test da carico con glucagone
160
dopo pasto
a digiuno
Glicemia (mg/dl)
120
GSD III
80
GSD I
40
Tempo (min) 0
10
20
30
40
50
60
Metabolismo dei carboidrati
Dieta
Glicogenosi III
Glucosio
Glicogenosi I
Glucosio P
Glicogeno
Trioso-P
Piruvato
aminoacidi
Acetil-CoA
proteine
CO2
Acidi grassi
Glucosio 6-P
Glucosio 6-P
Pirofosfato
T2
G6Pasi
Fosfato
Glucosio
Glucosio
Analisi molecolare del gene della
glucosio 6-fosfatasi:
R83C / R83C
GLICOGENOSI EPATICHE
Tipo
Nome
GSD
Ia
M. di Von Glucosio-6Gierke
fosfatasi
GSD
Ib
Glucosio-6fosfato
traslocasi
M. di Cori Enzima
M. di
deramificante
Forbes
GSD
IIIa
Difetto di base Organi
Manifestazioni cliniche
interessati
GSD
IIIb
GSD
IV
Enzima
deramificante
M. di
Enzima
Andersen ramificante
GSD
VI, I X
M. di
Hers
Fosforilasi
epatica
Fegato,
rene,
intestino,
pancreas
Come in Ia
neutrofili
Ipoglicemia, epatomegalia, ritardo di
crescita, dislipidemia, aumento di
acido lattico e acido urico
Fegato,
muscolo,
eritrociti,
leucociti
Fegato
epatomegalia, ritardo di crescita,
debolezza muscolare, ipoglicemia,
iperlipidemia, aumento delle
transaminasi epatiche
Sintomi epatici come nel tipo IIIa;
assenza dei sintomi muscolari.
Difetto di crescita, ipotonia,
epatosplenomegalia, cirrosi
progressiva e insufficienza epatica
Epatomegalia, li eve ipoglicemia,
iperlipidemia e chetosi.
I sintomi migliorano con l’età
Fegato,
muscolo
Fegato
Come in Ia, associata a neutropenia,
morbo di Crohn.
TERAPIA DELLE GLICOGENOSI
EPATICHE
Pasti frequenti
1976
alimentazione enterale
notturna
1986
amido crudo di mais
2002
trapianto di epatociti
I. D.
Nato a 37 sett. con TC
La gravidanza è stata complicata da gestosi
Sin dai primi gg di vita ha presentato :
difficoltà ad alimentarsi
scarso accresimento
pianto lamentoso
Ad 1 mese di vita viene ricoverato presso
l’Ospedale di Santa Maria Capua Vetere per
Distress respiratorio
Torpore marcato
Durante il ricovero per l’insorgenza di un
episidio critico viene traferito all’Osp.
Santobono
All’ingresso
Distress respiratorio
Alcalosi respiratoria
Iperammoniemia marcata (800 mmol/l)
Ac lattico nella norma
Chetoni urinari negativi
Glicemia nella norma
Aminoacidemia nella norma
Ac. Orotico nella norma
Scompenso metabolico acuto
chetosi
Acidosi
iperammoniemia
Difetti del ciclo dell’urea
Aminoacidemia
Pattern
specifico
Citrullinemia
Argininosuccinico aciduria
Argininemia
Intolleranza alle proteine con
lisinuria
Deficit di CP sintetasi
Deficit di N-acetilglutamato sintetasi
Pattern
aspecifico
oroticoaciduria
normale
aumentata
Deficit di OCT
Glutamina, Aspartato,
Alanina, Glicina, Glutamato
NAGS
Ac. Glutamico
+
Acetil-CoA
NH4 + HCO3
N-acetil
glutamato
CPS
CP
OTC
mitocondrio
ornitina
citrullina
ornitina
citrullina
AS
Arginasi
AL
urea
citosol
arginina
Ac. fumarico
ac.arginino
succinico
Ac.
aspartico
Difetti del ciclo dell’urea
Frequenza: CPS
1: 62000
OCT
1:14000
AS
1:57000
AL
1:70000
Arginasi
1:363000
complessiva
1:8200
Ereditarietà: autosomica recessiva OCT legata all’X recessiva (?)
Quadro clinico
Presentazione neonatale: iperammoniemia, torpore,
coma, convulsioni, shock, exitus
Forme tardive: episodi di scompenso ricorrenti
estrema variabilità per eterozigoti per OCT
Difetti del ciclo dell’urea
Diagnosi
Ammoniemia
EAB
Aminoacidemia
Ac. orotico urinario
Dosaggi enzimatici (fegato)
Analisi molecolare
Difetti del ciclo dell’urea
Terapia
Restrizione di apporto di proteine (azoto)
Prevenire catabolismo
Fornire vie alternative: ARG, CIT, sodio benzoato,
sodio fenilbutirrato, carbamilglutamato
Mantenere normali livelli di ammonio
Mantenere normali livelli di GLN, CIT, ARG
Mantenere normale stato nutrizionale
Mantenere normale crescita
Terapia di emergenza delle iperammoniemie
CPS - OCT sodio benzoato
sodio fenilacetato
arginina
250 mg/kg
250 mg/kg
210 mg/kg
In 25-35 ml/kg glucosata 10% in 90 m; poi stesse dosi in 24 ore
AS
sodio benzoato
sodio fenilacetato
arginina
250 mg/kg
250 mg/kg
660 mg/kg
In 25-35 ml/kg glucosata 10% in 90 m; poi stessa dose in 24 ore
AL
arginina
660 mg/kg
In 25-35 ml/kg glucosata 10% in 90 m; poistessa dose in 24 ore
Brusilow e Horwich, 2001
Glutamina, Aspartato,
Alanina, Glicina, Glutamato
NH4 + HCO3
N-acetil
glutamato
NAGS
Na Glutamico
benzoato
Ac.
+
Acetil-CoA
Na fenilbutirrato
mitocondrio
ornitina
carbamil
glutamico
citrullina
citrullina
AS
Arginasi
AL
citosol
CP
Ac. NOTC
ornitina
urea
CPS
arginina
Ac. fumarico
ac.arginino
succinico
Ac.
aspartico
LPM
Nato a termine da genitori
non consanguinei
Crescita staturoponderale nella norma
Nel 2 anno di vita
riscontro di
epatosplenomegalia
Indagini praticate
Emocromo Hb 7.5
GR 2350000
MCV 74
GB 5600
PLT 45000
ALT 35
AST 41
PT 85%
PTT 34”
Bil T 0.05
Indagini infettivologiche negative
Bil D 0.02
Striscio midollare: istiocita schiumoso
Altre indagini praticate
Rx scheletro: osteopenia
slargamento della porzione distale
dei femori
Vis. Oculistica con fundus nella norma
Striscio periferico nella norma
Dosaggio b-glucosidasi in leucociti
Attività enzimatica carente
Analisi molecolare del gene
b-glucocerebrosidasi (b-glucosidasi):
Riscontro di mutazioni N370S/L444P
Diagnosi: Malattia di Gaucher
Malattia di Gaucher
Tipi clinici
tipo 1
Esordio
tipo 2
infanzia primi mesi
eta’ adulta
tipo 3
infanzia
Visceromegalia
+
+
+
Segni ematologici
+
+
+
Coinvolgimento
scheletrico
+
-
+
Coinvolgimento
neurologico
-
+++
++
<2anni
20-40 anni
1:500000
1:100000
Sopravvivenza
6-80 anni
Frequenza
1:60000
Malattie lisosomiali
diagnosi
Striscio periferico
Striscio midollare
Rx scheletro
Vis. oculistica
Test screening urinari:
MPS, oligosaccaridi
Dosaggi enzimatici (siero, leucociti, fibroblasti)
Analisi molecolare
TERAPIA DELLE MALATTIE
METABOLICHE
Principi generali
Riduzione dell’accumulo di metaboliti dannosi
Supplementazione di metaboliti carenti
Supplementazione di cofattori
Detossificazione di metaboliti dannosi
Stimolazione di vie metaboliche alternative
Inibizione della produzione di metaboliti dannosi
Correzione di squilibri metabolici secondari
MALATTIE METABOLICHE ACUTE
Obiettivi della terapia a lungo termine
Mantenere nella norma concentrazioni
plasmatiche e urinarie di metaboliti
tossici
Favorire una crescita normale
Favorire un normale stato nutrizionale
Consentire un normale sviluppo
psicomotorio
Evitare episodi di scompenso metabolico
MALATTIE METABOLICHE ACUTE
Fattori che influenzano la prognosi
Età alla diagnosi
Gravità del quadro clinico neonatale
Genotipo
Controllo metabolico a lungo
termine
TERAPIA DELLE MALATTIE METABOLICHE
Strumenti
Diete speciali
Alimenti speciali
Integratori
Vitamine
Farmaci
Follow-up del bambino con malattie
metaboliche acute
problematiche
Valutazione dell’equilibrio metabolico
Adeguatezza apporto nutrizionale
Crescita
Sviluppo psicomotorio
Terapia degli scompensi acuti intercorrenti
Monitoraggio e prevenzione di complicanze
sistemiche
Problemi psicologici












