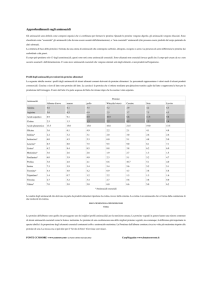
AMMINOACIDI
AMMINOACIDI
le unità di base che
costituiscono peptidi e
proteine
sono α-aminoacidi
della serie L
Gruppo R,
un gruppo (–NH2) e
un carbossilico (–COOH)
legati ad
un singolo atomo di
carbonio (α)
diversa catena laterale (-R):
Si distinguono :
aminoacidi neutri e aminoacidi carichi
• gli aminoacidi neutri si distinguono:
aminoacidi apolari e aminoacidi polari
• tra gli aminoacidi apolari si distinguono:
aminoacidi alifatici e aminoacidi aromatici
• tra gli aminoacidi carichi si distinguono
aminoacidi acidi e aminoacidi basici
ABBREVIAZIONI A UNA E TRE LETTERE DEI NOMI
DEGLI AA
AMINOACIDI : ACIDI O BASI?
a pH fisiologico i gruppi
α-amminici degli aminoacidi
liberi sono protonati e quelli
α-carbossilici sono nella forma
di base coniugata deprotonata
(carbossilato)
gli
aminoacidi liberi
sono quindi ioni
dipolari o zwitterioni
al pH isoelettrico
(pI)
CURVA DI TITOLAZIONE DI UN AMMINOACIDO ACIDO
In funzione del
pH
la struttura
dell’ aminoacido
si presenta in
una forma
diversa
LEGAME PEPTIDICO
ESEMPIO
LE CATENE POLIPEPTIDICHE
I polipeptidi sono catene
lineari in cui ciascun
amminoacido è legato al
suo prossimo in modo
“coda-testa”, senza
formare diramazioni.
La catena si estende dal
suo termine amminico (Nterminale) al suo termine
carbossilico (C-terminale)
La formazione in
successione di legami
peptidici genera la
cosiddetta “catena
principale” o “scheletro
polipeptidico”da cui
protrudono le catene
laterali
Il legame peptidico è rigido e planare
Gli atomi di Ca di amminoacidi adiacenti sono separati da tre legami
covalenti:
Ca – C – N – Ca
PROPRIETA’ DEL LEGAME PEPTIDICO
I 6 atomi del gruppo peptidico giacciono sullo stesso piano
l’ossigeno legato al carbonio del gruppo carbonilico e l’atomo di
idrogeno legato all’azoto amminico, si trovano in trans.
L’ossigeno carbonilico ha una parziale carica negativa e
l’azoto amminico ha una parziale carica positiva ciò genera
un parziale dipolo elettrico.
I legami ammidici C-N hanno un parziale carattere di doppio
legame per effetto della risonanza non possono ruotare
liberamente.
La rotazione è permessa solo attorno ai legami N-Ca e Ca-C.
ANGOLI DIEDRI Φ E Ψ
I soli gradi di libertà
dell’unità peptidica
rigida sono:
rotazione intorno al
legame N–Cα(angolo φ)
rotazione intorno al
legame Cα–C(angolo ψ)
A ciascun amminoacido
viene associata una
coppia di angoli diedri
(φ, ψ), che determina in
modo univoco la
conformazione della
catena principale.
DIAGRAMMA (“PLOT”) DI RAMACHANDRAN
Le coppie (φ, ψ)
permesse per gli
amminoacidi sono
riportate in un
diagramma
chiamato :
plot di
Ramachandran