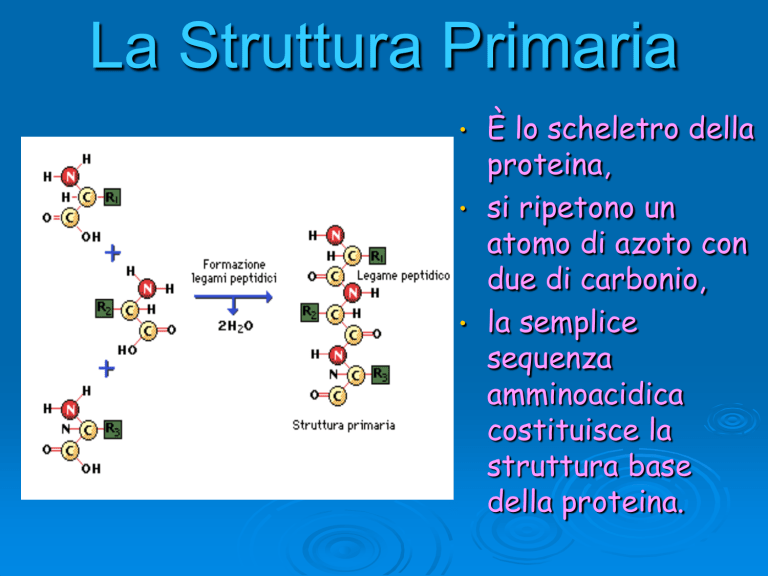
La Struttura Primaria
È lo scheletro della
proteina,
• si ripetono un
atomo di azoto con
due di carbonio,
• la semplice
sequenza
amminoacidica
costituisce la
struttura base
della proteina.
•
La Struttura Primaria
•
La struttura primaria
di una proteina è una
lunga sequenza di
amminoacidi legati
per mezzo del legame
peptidico: il gruppo
carbossilico di un
amminoacido si lega
al gruppo amminico di
quello adiacente con
la liberazione di una
molecola d'acqua.
Reazione di
condensazione
La Struttura Primaria
•
Sequenza primaria di
amminoacidi differenti.
Dalla proteina possiamo
risalire alla struttura a
seconda:
• del tipo di amminoacidi
presenti,
• dalla quantità di
amminoacidi presenti,
• della sequenza
amminoacidica (ossia
da come gli
amminoacidi si
dispongono).
La Struttura Secondaria
•
Gli angoli e le lunghezze
di legame sono ben
definite:
• Il gruppo ammidico sta
su un piano,
• L’azoto è ibridato sp2 e
il legame peptidico ha
un carattere di doppio
legame,
• Ciascun gruppo
amminico è planare
Ma non è detto che
due gruppi amminici
adiacenti siano
coplanari (nello
stesso piano).
La Struttura Secondaria
Essenziale per
la
determinazione
della struttura.
•
È molto facile formare
dei legami idrogeno
•
La catena si avvolge in
modo che l’idrogeno di
un ammino gruppo si
leghi con legame ad
idrogeno col carbonile
di un altro residuo aa.
La Struttura Secondaria
•
Studi ai raggi X.
•
Ipotesi di Pauling: la
catena polipeptidica si
avvolge su se stessa
per formare un’
ELICA!
• Tenuta rigida da
legami ad idrogeno
α- elica
La Struttura Secondaria
•
•
L' α-elica ha un passo di 5.4 Å e
ogni spira dell'elica è costituita
da 3.6 residui amminoacidici.
L'eccezionale stabilità di questa
conformazione dipende dal fatto
che tutti gli NH e i C=O dei
gruppi peptidici sono impegnati
in legami a ponte di idrogeno.
L'α-elica è il risultato del ripiegamento
probabilmente più "naturale" che una
catena peptidica possa assumere.
La Struttura Secondaria
•
L' α-elica presente nelle proteine è
quasi sempre destrogira
(l'andamento è quello della
filettatura di una vite
tradizionale).
La Struttura Secondaria
•
Perché è destrogira?
• È dovuto al fatto che gli
amminoacidi proteici
sono tutti nella
configurazione "L" e in
un'elica sinistrorsa i
gruppi laterali R
risulterebbero troppo
vicini ai gruppi C=O,
destabilizzando l'elica.
La Struttura Secondaria
•
Le catene laterali R dei residui
amminoacidici sono tutte
rivolte verso l'esterno
dell'elica.
• Procedendo dall’azoto
terminale, tutti i gruppi
carbonilici sono rivolti verso
il basso.
• Sono legati con legami ad
idrogeno a gruppi N-H che di
trovano avanti lungo la catena.
La Struttura Secondaria
•
I legami ad idrogeno sono
allineati lungo l’asse
maggiore dell’elica.
Alfa- elica vista dall’alto
La Struttura Secondaria
Le catene peptidiche sono
affacciate e sono tenute
assieme da legami ad
idrogeno fra le diverse
catene.
•
Studiando ai raggi X
altre strutture si è
trovato un sistema
ripetitivo diverso.
• Con passo di 7 Å.
Struttura a
foglietto a
La Struttura Secondaria
•
Le catene adiacente
possono svilupparsi in
direzione opposta.
Beta foglietto
anti-parallelo
La Struttura Secondaria
•
Le catene adiacente
possono svilupparsi
nella stessa
direzione.
Beta – foglietto
parallelo
La Struttura Secondaria
•
I gruppi R delle due
catene si trovano una
volta sopra e una
volta sotto il piano.
• Possono dare
repulsioni.
• Quindi la struttura
beta si trova in
proteine con
amminoacidi che
presentano R piccoli.
La Struttura Secondaria
• Le catene laterali di
residui adiacenti sono su
lati opposti del foglietto.
La Struttura Secondaria