Scienze - capitolo 3
1) I carboidrati sono biomolecole essenziali per gli organismi viventi perché rappresentano riserve di
energia a breve termine. Essi si dividono in monosaccaridi, disaccaridi e polisaccaridi.
Le piante grazie alla fotosintesi clorofilliana, reazione endoergonica (assorbe energia dall'ambiente),
producono carboidrati a partire da sostanze inorganiche (CO2 e H2O) in presenza della luce solare. Grazie
alla clorofilla, un catalizzatore presente nei vegetali, questi reagenti vengono trasformati in glucosio
(C6H12O6) e come sottoprodotto viene liberato ossigeno nell'aria. Un grammo di glucosio contiene 15,5 kJ
di energia. (Questa è una delle reazioni più importanti della natura perché alcune delle sostanze più
presenti sulla terra vengono sfruttate per produrre risorse energetiche per vivere) .
6C0 2+ 6H2O + LUCE SOLARE ==(clorofilla)==> C6H12O6 + 6O2
2) I monosaccaridi sono i carboidrati più semplici. Essi si classificano in base al numero di carboni che
possiedono e prendono il nome di triosi, tetrosi, pentosi, esosi...
Le loro caratteristiche strutturali e la reattività chimica sono determinate dai gruppi funzionali: gruppo
alcolico e gruppo carbonilico (aldeidico quindi detti aldosi o chetonico quindi chetosi).Il gruppo aldeidico si
può trovare solo all'estremità della catena, quello chetonico invece deve essere in mezzo.
I monosaccaridi sono otticamente attivi perche nella catena presentano carboni chirali. Per distinguere gli
enantiomeri si usa la convenzione D e L.
Rappresentando il monosaccaride con le formule di proiezione di Fischer (i carboni sono disposti lungo una
linea verticale e il gruppo carbonilico viene posto alto), esso sarà D se lo stereocentro più lontano dal
gruppo carbonilico (il penultimo carbonio) ha il gruppo alcolico a destra, se è a sinistra sarà L.
oppure: Essa si ricava confrontando, dalle formule di proiezione di Fischer, lo stereocentro più lontano dal
gruppo carbonilico con il carbonio-2 dei due enantiomeri della gliceraldeide(il monosaccaride più semplice).
Invece, il verso in cui il piano della luce polarizzata ruota (dato ottenuto sperimentalmente) viene indicato
dal segno + o -.
3) In natura i monosaccaridi esistono prevalentemente in forma ciclica perché avviene un'addizione
nucleofila tra il carbonio del gruppo carbonilico e il gruppo alcolico di un carbonio terminale. Per
rappresentarli si usano le formule di Haswort: l'ossigeno viene posto in alto a destra e i carboni si
numerano in senso orario a partire dal primo che viene messo a destra.
Dalla chiusura dell'anello possono avere origine 2 diversi anomeri in base al verso dell'attacco nucleofilo. Si
distinguono con le lettere α e β a seconda che il gruppo alcolico del carbonio 1 sia in posizione trans o cis
rispetto il gruppo -CH2OH legato al carbonio 5.
1
4) I disaccaridi nascono dall'unione di 2 monosaccaridi per reazione dell' -OH anomerico (del carbonio-1) di
uno con il gruppo alcolico di un altro monosaccaride. Si libera una molecola d'acqua e si forma un legame
O-glicosidico a ponte di ossigeno. I più importanti sono:
maltosio: ottenuto dall'idrolisi parziale dell'amido. Legame tra i carboni 1 e 4 di due α-D-glucosio
cellobioso: ottenuto dall'idrolisi parziale della cellulosa. Legame tra i C 1 e 4 di due β-D-glucosio
lattosio: zucchero del latte. Legame 1-4 tra β-D-galattosio + β-D-glucosio
saccarosio:costituisce lo zucchero di canna e barbabietola. Legame 1-2 tra α-D-glucosio +
β-D-fruttosio.
5) L'amido è un polimero dell' α-D-glucopiranoso presente soprattutto nelle patate e nei semi dei cereali e
costituisce la riserva di carboidrati delle piante. In esso sono presenti due componenti polimerici: l'amilosio
e l'amilopectina.
L'amilosio ha struttura lineare perché è formato dall'unione di centinaia di α-glucosio con legame 1-4-αglicosidico.
L'amilopectina ha invece struttura ramificata perché è composta anche da legami 1-6-α-glicosidici.
6) La cellulosa è il composto organico più abbondante sulla Terra perché è presente in tutti i vegetali. E un
polimero con funzione strutturale: è costituito da lunghe catene lineari di β-D-glucosio unite da legami
1-4-β-glicosidici. L'unica differenza con l'amido è proprio questo legame che rende impossibile agli umani
digerirlo, perché non possiedono i giusti enzimi.
7) I lipidi sono una categoria eterogenea di composti che però condividono il fatto di essere insolubili in
acqua ma solubili in solventi organici polari. Questo perché sono caratterizzati in prevalenza da lunghe
catene di carboni che sono apolari. A seconda del lipide, hanno diversi ruoli:
ruolo di riserva energetica: ogni grammo liberano 40 kJ di energia
ruolo strutturale: i fosfolipidi costituiscono tutti i tipi di membrana cellulare
ruolo funzionale come ormoni, vitamine, e sali biliari sono indispensabili per il corretto
funzionamento dell'organismo.
Possono essere classificati in saponificabili (gliceridi, fosfolipidi, glicolipidi) o insaponificabili (steroidi,
vitamine liposolubili) a seconda che contengano o meno il gruppo estereo e che quindi possano essere
saponificati riscaldati in ambiente basico.
2
8) I trigliceridi, formati dal glicerolo e da 3 acidi grassi, si distinguono in grassi solidi e liquidi (o oli) a
temperatura ambiente. Questo dipende dalle caratteristiche degli acidi grassi: più doppi legami ci sono, più
il punto di fusione è basso (quindi è più liquido). Negli oli prevalgono acidi grassi insaturi come l'acido
oleico, linoleico e linolenico. Essi sono fondamentali nella dieta umana per la sintesi di molecole
(prostaglandine) che regolano molte attività biologiche del corpo umano.
Il fosfogliceride è formato dal glicerolo esterificato con 2 acidi grassi e 1 gruppo fosfato al quale è legato un
altro gruppo X, solitamente un amminoalcol, spesso ionico. Pertanto i fosfogliceridi presentano una testa
polare (dove c'è il gruppo X che è ionico e quindi si lega con l'acqua) e due lunghe code apolari (le catene
idrocarburiche). Le membrane cellulari sono formate da un doppio strato fosfolipidico in cui le code apolari
sono rivolte verso l'interno, mentre le teste polari verso l'esterno. Esso isola la cellula dall'ambiente esterno
e regola lo scambio di materiali tra la cellula e l'esterno.
9) Le cellule producono lipidi insaponificabili a partire dall'isoprene (2-metil-1,3-butandiene), una molecola
molto instabile che tende a polimerizzare per condensazione formando composti sia lineari che ciclici.
A questo gruppo appartengono ad esempio gli steroidi, caratterizzati da una struttura comune formata da 4
anelli, di cui 3 sono a sei atomi di carbonio e 1 a cinque atomi. Tra gli steroidi più importanti c'è il
colesterolo che ha sia compito strutturale (andandosi a posizionare tra i due strati della membrana) sia
funzionale, perché permette la sintesi della vitamina liposolubile D e degli ormoni sessuali.
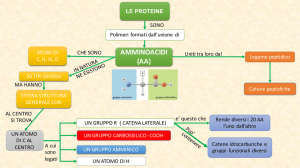
10) Gli amminoacidi sono i monomeri delle proteine. Essi sono costituiti da un atomo di carbonio al quale
sono legati: un gruppo amminico -NH2, un gruppo carbossilico -COOH, un atomo di idrogeno -H e un
gruppo -R caratterizzante per ogni amminoacido al quale conferisce particolari proprietà. Pertanto tutti,
eccetto la glicina ( che al posto di -R ha un -H), sono otticamente attivi.
I gruppi -NH2 e -COOH sono sensibili al pH dell'ambiente:
pH=7 gli amminoacidi si comportano come ioni dipolari perché l'idrogeno del gruppo carbossilico
(1) passa all'azoto del gruppo amminico(2). Quindi il primo diventa negativo, il secondo positivo.
pH<7 l'ambiente è acido e quindi cede molti protoni H+ che vanno a legarsi al gruppo carbossilico
(negativo) -COO¯
pH>7 l'ambiente basico tende ad acquistare i protoni H+ dal gruppo
11) Il corpo umano usa 20 amminoacidi che, combinati tra di loro, possono formare moltissime proteine
diverse. L'uomo, però, non è in grado di produrli tutti autonomamente e quindi deve introdurli con la dieta.
Gli amminoacidi possono essere classificati in 4 gruppi in base alla natura del gruppo -R:
apolare: sono idrofobici perché il gruppo -R è composto da catene carboniose.
polare neutra: eccetto la glicina sono solubili in acqua perché possono formare legami a idrogeno.
acida: il gruppo -R contiene un gruppo carbossilico -COOH che è abbastanza acido. Esso tende a
cedere il suo protone H+ e quindi rende l'amminoacido negativo perché rimane un eccesso di
cariche negative( - COO¯). Nelle proteine questo permette di creare legami con gli ioni metallici per
ragioni strutturali o funzionali.
basica: il gruppo -R possiede uno o più gruppi amminici che, essendo basici, tendono ad acquistare
protoni H+ in ambiente acido. Pertanto rendono positivo l'amminoacido nel suo complesso.
3
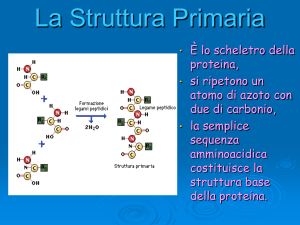
12) Le proteine sono formate da tanti amminoacidi uniti tra loro con un legame ammidico (-CO-NH-) detto
legame peptidico. Il gruppo carbossile di un amminoacido reagisce con il gruppo amminico di un altro
formando un dipeptide e liberando acqua. Il dipeptide alle sue estremità ha un gruppo carbossilico e uno
amminico che permettono di legare altri amminoacidi e formare un polimero molto lungo.
La sequenza amminoacidica determina la struttura primaria della proteina. Essa influisce sulla forma e sulla
funzione che la proteina svolgerà.
13) La struttura secondaria riguarda la disposizione che le catene polipeptidiche assumono nello spazio.
Nella struttura α-elica, la catena ha una forma elicoidale a causa dei legami a idrogeno che si formano tra
l'idrogeno del gruppo amminico e l'ossigeno di un legame peptidico. Questi legami si instaurano tra
amminoacidi della stessa catena tra le anse dell'elica.
Nella struttura foglietto-β, invece, i legami a idrogeno si formano tra gli stessi atomi di prima, ma fra
amminoacidi di due catene diverse.
Le catene laterali -R sono all'esterno della spirale nell' α-elica, sopra e sotto il piano nella foglietto-β.
14) I ripiegamenti delle strutture ad α-elica e a foglietto-β determinano la struttura terziaria. Essa è dovuta
a forze attrattive elettrostatiche o a caratteristiche ambientali. Ad esempio se una catena contenente
gruppi laterali idrofobici si trova in un ambiente acquoso, esse si ripiega in modo da avere la parte
idrofobica all'interno e quella idrofila all'esterno.
La struttura terziaria può essere stabilizzata da legami disolfuro, un legame covalente che deriva
dall'ossidazione del gruppo tiolico (-SH). (il legame disolfuro si può formare a partire da due gruppi tiolici)
15) La struttura quaternaria esiste solo nella proteine formate da più subunità (le catene polipeptidiche)
che si legano fra loro mediante deboli interazioni (forze di van der Waals, legami a idrogeno, ponti
disolfuro).
L'emoglobina è formata da 4 catene polipeptidiche (2 α e 2 β) molto ravvicinate e disposte a tetraedro.
Ciascuna catena presenta nella cavità superficiale un gruppo eme (una parte non proteica detta gruppo
prostetico) contenente un atomo di ferro che permette di legare l'ossigeno.
16) La struttura terziaria determina nelle proteine la loro forma, che influisce sulle loro proprietà.
Le proteine fibrose come il collageno sono insolubili in acqua e hanno una struttura robusta grazie ai ponti
disolfuro perché esse devono fungere da materiali strutturali.
Le proteine globulari hanno una forma sferica e sono solubili in acqua: questo permette alle proteine di
svolgere la loro funzione nell'ambiente intra o extra cellulare.
Comunque, la forma dipende dalla funzione biologica della proteina. Ad esempio gli enzimi hanno la forma
più adatta per ospitare i substrati da trasformare.
17) Le funzioni delle proteine sono: strutturale; catalitica, svolta dagli enzimi; energetica quando
carboidrati e lipidi terminano; di riserva in casi di necessità; protettiva, gli anticorpi (di natura proteica)
riconoscono gli agenti estranei; ormonale; osmotica e di tampone per regolare l'equilibro osmotico e il pH
del sangue; contrattile per le fibre muscolari; di trasporto, come l'emoglobina contenuta nei globuli rossi
per trasportare l'ossigeno; tossica.
4
18) Finchè la struttura terziaria e quaternaria sono inalterate, la proteina mantiene la sua conformazione
nativa e svolge regolarmente i suoi compiti. Ma, poiché i legami che danno forma alla proteina sono molto
deboli, la proteina può essere facilmente denaturata, cioè perde la sua conformazione nativa e la sua
attività biologica termina o diminuisce.
Il processo di denaturazione però non distrugge la struttura primaria di una proteina, perché non possiede
sufficiente energia per rompere i legami peptidici.
19) Solo in una parte dell'enzima si svolge la catalisi della reazione. Questa regione è il sito attivo
dell'enzima dove sono presenti alcuni gruppi funzionali capaci di formare legami a idrogeno direttamente
con il substrato.
Prima il substrato si lega all'enzima, formando il complesso E-S. Dopo il substrato si trasforma in prodotto e
si allontana dall'enzima, che diventa disponibile per una altra reazione. E+S <=> E-S => E+P
Nel modello ad adattamento indotto, il substrato legandosi all'enzima ne modifica la struttura in modo da
migliorare la reciproca aderenza.
20) Secondo la nomenclatura della IUBMB, gli enzimi vengono prima di tutto suddivisi in 6 classi a seconda
della reazione chimica che essi catalizzano.
ossidoreduttasi: catalizzano le reazioni di ossidoriduzione (ad esempio l'ossidazione dell'acido
lattico che vede il trasferimento di 2 atomi di idrogeno)
trasferasi: catalizzano il trasferimento di gruppi funzionali (ad es. il primo passaggio della glicolisi)
idrolasi: catalizzano la rottura di legami con l'aggiunta di acqua
liasi: catalizzano l'addizione di gruppi a doppi legami o l'inverso (ad es. la decarbossilazione. Se un
amminoacido viene decarbossilato diventa un'ammina)(R-COOH -->R-H + CO2)
isomerasi: catalizzano le reazioni di isomerizzazione (ad es. il terzo passaggio della glicolisi in cui il
glucosio-6-fosfato viene trasformato in fruttosio-6-fosfato)
ligasi: catalizzano le formazione di legami accoppiati all'idrolisi di ATP
5