Le
proteine sono polimeri lineari costituiti
da unità base formate da oltre 40
amminoacidi
Hanno
elevato PM
Possono
assumere forme diverse a seconda
della funzione
svolgono
molteplici funzioni
Tra le proteine esistono:
Proteine Strutturali (collagene, cheratine)
Proteine Contrattili (actina, miosina, tubuline)
Proteine del Sistema Immunitario
(immunoglobuline)
Trasportatori: (emoglobina)
di riserva ( ferritina, glutine)
Recettori ( chimica della visione)
Alcuni Ormoni (insulina, glucagone)
Enzimi
Di difesa (anticorpi)
PROTEINE CONIUGATE. La parte non amminoacidica viene
definita GRUPPO PROSTETICO.
Le proteine possono essere classificate in due gruppi
principali: proteine globulari e fibrose.
Proteine globulari
Le catene polipeptidiche sono ripiegate ed assumono forma
compatta, sferica o globulare.
Proteine Fibrose
Hanno catene polipeptidiche disposte in lunghi fasci o in foglietti.
In genere presentano un unico tipo di struttura secondaria.
Sono insolubili in H2O
Sono
solubili in acqua,
di forma quasi sferica,
Assolvono funzioni biologiche.
Possono essere:
Enzimi
Ormoni
Proteine di trasporto
Proteine di deposito
Cheratine
e collageni
hanno strutture ad
elica,
Le sete hanno
struttura foglietto
beta
Gruppi apolari e ponti
disolfuro tendono a
conferire rigidità e
insolubilità alle
proteine fibrose.
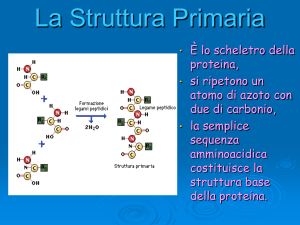
Ogni proteina in un
organismo possiede una
sequenza definita di
amminoacidi che
costituisce la sua
struttura primaria.
Tutte le molecole di una
data proteina di un certo
organismo hanno la stessa
struttura primaria.
Proteine corrispondenti di
organismi appartenenti a
specie diverse presentano
strutture primarie simili.
Dogma centrale della biologia molecolare:
il DNA di un gene viene trascritto in una molecola di RNA con
sequenza complementare al DNA. La sequenza di RNA viene tradotta
in una corrispondente sequenza di amminoacidi per formare una
proteina
la struttura
primaria delle
proteine è
codificata dalla
struttura primaria
del DNA dei geni
corrispondenti
Si distinguono fondamentalmente tre tipi di
strutture secondarie:
α-elica
foglietto
β
reverse turn
•
È molto facile formare dei
legami idrogeno
•
La catena si avvolge in
modo che l’idrogeno di
un ammino gruppo si
leghi con legame ad
idrogeno col carbonile di
un altro residuo aa.
α-elica
o
o
o
o
o
le α.eliche di tipo sinistrorso molto rare
e limitate a pochi amminoacidi
legami a H fra il gruppo carbonilico
dell’amminoacido n e il gruppo
amminico dell’amminoacido n+4.
tutti i gruppi NH e CO saranno legati da
legami a H, eccetto i primi 3 gruppi NH
e gli ultimi 3 gruppi CO alle estremità
dell’elica
L'α-elica è il risultato del ripiegamento
probabilmente più "naturale" che una
catena peptidica possa assumere.
Perché è destrogira? È dovuto al fatto
che gli amminoacidi proteici sono tutti
nella configurazione "L" e in un'elica
sinistrorsa i gruppi laterali R risulterebbero
troppo vicini ai gruppi C=O,
destabilizzando l'elica.
Champe et al., Le basi della biochimica, Ed. Zanichelli
I filamenti β sono allineati uno
vicino all’altro, in modo tale che
si possano formare legami a H tra i
gruppi CO di un filamento e i
gruppi NH del filamento β
adiacente e viceversa
I polipeptidi che formano un
foglietto b possono disporsi in
modo parallelo o anti-parallelo.
Un foglietto b può essere
formato anche da una singola
catena polipeptidica ripiegata su
se stessa: in tal caso i legami a H
sono legami intracatena.
I foglietti β formati da
un certo numero di
filamenti β sono
‘pieghettati’(pleated)
Le catene laterali
puntano
alternativamente sopra
e sotto il foglietto β.
Spesso un lato del
foglietto β può
presentare tutte catene
laterali polari e l’altro
tutte non polari
•
•
•
I gruppi R delle due
catene si trovano una
volta sopra e una volta
sotto il piano.
Possono dare repulsioni.
Quindi la struttura beta si
trova in proteine con
amminoacidi che
presentano R piccoli.
La struttura terziaria è
la conformazione
tridimensionale assunta
da una proteina.
È stabilizzata da legami
non covalenti come ponti
idrogeno, interazioni
idrofobiche tra
amminoacidi non polari e
legami ionici.
È indispensabile per la sua
attività biologica.
Come si forma una struttura terziaria?
Ponti
S_S
Interazioni idrofobiche
Formazione
di sali
Legame idrogeno
Le
catene polipeptidiche formate da più di
200 amminoacidi in genere comprendono 2 o
più domini, piccole unità compatte.
I domini sono le unità strutturali e funzionali
di una proteina.
Ciascun dominio è una regione globulare,
compatta, che si forma per la combinazione
di più elementi strutturali secondari (aeliche, foglietti b, sequenze non ripetitive).
Molte
proteine sono costituite da una sola
catena polipeptidica (proteine monomeriche).
Alcune proteine sono costituite da 2 o più
catene polipeptidiche (subunità)
strutturalmente identiche o diverse (proteine
multimeriche).
L’associazione di queste subunità costituisce la
struttura quaternaria.
Le subunità sono tenute insieme da interazioni
non covalenti.
E’ la perdita della conformazione nativa della proteina senza
alterare sequenza AA
Può essere provocato da:
Agenti chimici (alcoli, acidi)
Agenti fisici (calore, agitazione, luceUV)
Porta a:
Coagulazione
Inattivazione enzimatica
Aumento digeribilità