CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA
I° ESERCITAZIONE
1) Che tipo di ibridazione ha il carbonio coinvolto nel
doppio legame degli alcheni? Descrivi brevemente.
Alcheni
Ibridazione sp2
2s px py pz
2s px py pz
ibridazione
promozione
1s
1s
1s
Legame π
Origina dalla sovrapposizione laterale di orbitali p
situati su atomi adiacenti
sp2
sp2
Trigonale planare
120°
Legame π
:
Origina dalla sovrapposizione laterale di orbitali p
situati su atomi adiacenti
È impedita la rotazione intorno al doppio legame
C=C
Gli orbitali sp2 giacciono tutti sullo stesso piano
Il legame C=C è più corto del legame C-C:
doppietti elettronici condivisi = nuclei più vicini
2) Dare il nome IUPAC ai seguenti composti
n. Atomi di C: propan
1
2
3
Gruppi funzionali : olo
2-propanolo
Cis 2-butene
Trans 2-butene
3) Ciclizzare la molecola del fruttosio partendo
dalla sua forma lineare.
a) Che tipo di reazione è?
b) Che gruppi funzionali sono coinvolti?
CICLIZZAZIONE DEL FRUTTOSIO:
Il fruttosio forma un anello facendo reagire il gruppo
aldeidico con un ossidrile nella catena
β
I COMUNI MONOSACCARIDI HANNO
STRUTTURE CICLICHE
*
4) Disegnare in forma ciclica:
a) un dimero del glucosio con un legame β (14)
(entrambe le molecole di glucosio nella configurazione β)
b) un dimero del glucosio con legame α (16)
a) Cellobiosio
O-β-D-glucopiranosil (1→4) – β-D-glucopiranosio
b) Isomaltosio
O-α-D-glucopiranosil (1→6) – α-D-glucopiranosio
5) Disegnare una molecola del disaccaride Lattosio.
Da quali monosaccaridi è costituito?
Di che tipo di reazione si tratta?
Che legame si forma tra le unità monosaccaridiche?
DISACCARIDI
Due
MONOSACCARIDI
uniti da legame
O-glicosidico
DISACCARIDI
Due
MONOSACCARIDI
uniti da legame
O-glicosidico
Estremità
riducente
6) Scrivere la proiezione di Fisher del D-ribosio e del suo
enantiomero. Come si chiama?
n centri chiralici =2n stereoisomeri
Enantiomeri
Enantiomeri
CHO
CHO
C HO
C HO
C
H
C
OH
H
C
OH
HO C
H
H
C
H
C
OH
HO C
H
HO
C
CH2OH
D-Eritrosio
CH2OH
L-Eritrosio
OH H O
H
H
C H 2O H
L-Treosio
C H 2O H
D-Treosio
Epimeri
differiscono tra loro soltanto per la configurazione attorno
ad un atomo di C chiralico
ATTENZIONE!!!
NON SONO ENANTIOMERI
Se Differiscono per la
configurazione attorno ad un
solo carbonio chirale sono
anche detti EPIMERI
7)Quali sono le funzioni dei carboidrati in natura?
Carboidrati: funzioni
• Fornire energia chimica
• Sostegno (parete cellulare
vegetale)
• Protezione (parete batterica)
• Lubrificanti delle giunture
scheletriche
• Adesione tra cellule
• "Riconoscimento" cellulare
8) Data la seguente sequenza per uno dei filamenti di un
oligonucleotide a doppia elica:
5’ACCGTAAGGCTTTAG3’
scrivete la sequenza del filamento del DNA complementare
Nel DNA…
I contenuti di adenina sono
sempre uguali a quelli di
timina
I contenuti di citosina sono
sempre uguali a quelli di
guanina
Regola di Chargaff
Questa osservazione ha
condotto ad una conclusione:
Il DNA e’ costituito da due filamenti
Ogni base di un filamento e’ legata
con una base dell’altro filamento
(base complementare) mediante
legami idrogeno
L’adenina si lega sempre alla timina,
la guanina si lega sempre alla citosina
Tra le coppie A-T si possono formare
due legami idrogeno
Tra le coppie C-G si possono formare
tre legami idrogeno
Disposizione dei legami
Idrogeno nelle coppie di basi
8) Data la seguente sequenza per uno dei filamenti di un
oligonucleotide a doppia elica:
5’ACCGTAAGGCTTTAG3’
scrivete la sequenza del filamento del DNA complementare
5’ACCGTAAGGCTTTAG3’
3’
TGGCATTCCGAAATC 5’
9) I due filamenti complementari del DNA a doppia
elica: (Rispondete V o F)
a) sono tenuti insieme da interazioni idrofobiche.
b) sono tenuti insieme da legami a idrogeno.
c) contengono una quantità uguale di ciascuna delle
quattro basi azotate in ciascun filamento.
d) L’adenina e la timina di eliche complementari sono
tenute insieme da tre legami idrogeno.
10) Scrivete la struttura di una porzione di amido
che consenta di evidenziare le parti funzionali,
indicando quali tipi di legami sono coinvolti. Quali
sono le differenze strutturali con la cellulosa?
POLISACCARIDI
OMOPOLISACCARIDI
1 solo tipo di
unità
monomerica
ETEROPOLISACCARIDI
2 o più tipi di
unità
monomeriche
Omopolisaccaridi di riserva: Amido
polimeri di α-glucosio
amilosio: catena lineare
amilopectina:
catena ramificata
(ramificazioni ogni 24/30 residui)
Omopolisaccaridi con funzione strutturale:
CELLULOSA
polimeri di β-glucosio
Legami β1→4
Non presenta
ramificazioni
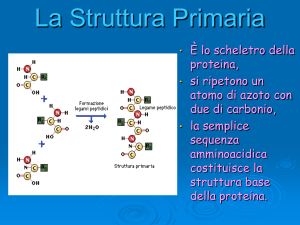
11) Disegnare la struttura di un tripeptide a
scelta, indicando:
a) I residui aminoacidici costituenti
b) I piani ammidici
c) Descrivere le caratteristiche del legame
peptidico.
Il legame Peptidico
Reazione di
condensazione
Il legame Peptidico
Dipolo
Più corto di un legame singolo
Ha parziale carattere di doppio
legame
È rigido, non permette
deformazioni e rotazioni attorno
al legame C-N
Piano ammidico
ψ
φ
nel legame peptidico gli atomi di O, C, N e H sono
rigidamente sullo stesso piano
il legame C-C α ed legame N-C α sono legami singoli perciò
è possibile la libera rotazione
Ciascun carbonio α
appartiene
contemporaneamente a
due piani peptidici, i quali
formano un angolo diedro
Il legame peptidico è quasi
sempre di tipo trans in quanto
l’impedimento sterico tra gruppi R
di aminoacidi contigui rende poco
stabile la configurazione cis
rispetto a quella trans
12) Indicare se le seguenti affermazioni
riguardanti l’istidina sono vere o false.
a) Contiene un secondo gruppo
amminico primario
b) si classifica come amminoacido
acido
c) contiene un anello imidazolico
d) contiene un gruppo carbossilico
nella catena laterale
e) è implicato nella formazione di
ponti disolfuro
13) Quale è il nome della molecola qui
rappresentata?
A quale classe di biomolecole appartiene?
Elenca tutte le molecole che conosci che
contengono la struttura qui rappresentata
Nucleotidi:
Basi azotate
Legame
N-β-glicosidico
Adenosina MonoFosfato AMP
Legame
FOSFOESTERE
mostra le proprietà dei normali esteri
fosforici, relativamente resistenti
all’idrolisi
Adenosina DiFosfato ADP
ADP e ATP hanno gruppi fosforilici
addizionali uniti per mezzo di legami a
ponte di ossigeno P–O–P, che hanno le
caratteristiche dei legami fosfoanidridici.
Legami
FOSFOANIDRIDICI
Adenosina TriFosfato ATP
Tali legami possiedono una energia
Libera di idrolisi molto elevata, e
vengono definiti legami ricchi di
energia.
La scissione di tali legami rende
quindi disponibile molta energia, utilizzabile
per rendere possibili reazioni endoergoniche.
14) Quali delle seguenti affermazioni sulla struttura
terziaria delle proteine è vera
a) la struttura terziaria è stabilizzata
esclusivamente da legami covalenti
b) è stabilizzata da un grande numero di legami
idrogeno
c) è data dalla regolare ripetizione di motivi
strutturali
d) Non sono mai presenti interazioni di tipo
idrofobico
Struttura terziaria delle proteine
Struttura terziaria delle proteine
Struttura terziaria delle proteine
Struttura terziaria delle proteine
Residui Polari
Residui Apolari
Gli amminoacidi apolari tendono a sfuggire il contatto
con l’acqua e guidano interi segmenti della proteina ad
occupare zone più interne della macromolecola ripiegata
Gli amminoacidi polari si trovano più frequentemente
sulla superficie della proteina stessa, a contatto con le
molecole d’acqua
15) Descrivere sinteticamente le caratteristiche
strutturali delle -eliche, dei filamenti e dei
ripiegamenti (-turn), indicando anche in che modo
sono stabilizzate le diverse strutture
Struttura secondaria delle proteine
Tipica disposizione spaziale
dei residui amminoacidici che
sono adiacenti nella struttura
primaria.
Ripiegamento della catena
polipeptica la cui catena
principale si dispone nello
spazio tridimensionale formando
una struttura ripetitiva.
Conformazione:
organizzazione spaziale degli
atomi di una proteina.
α-elica,
β-foglietto
Struttura secondaria delle proteine
1) INTERAZIONI IDROFOBICHE:
Le catene laterali degli
amminoacidi idrofobici
tendono a raggrupparsi
all’interno delle proteine
2) LEGAMI H
Massimo numero all’interno
della proteina
Struttura secondaria delle proteine:
α elica
N
C
C=O
α - eliche delle
proteine: destrorsa
ogni giro di elica 3,6 residui di
amminoacidi
passo = 3,6 residui
Struttura secondaria delle
proteine: α elica
stabilizzata da legami
idrogeno
il gruppo C=O di un
amminoacido forma un legame
H con il gruppo N-H
dell’amminoacido che si trova
4 residui più avanti nella
stessa catena
Struttura secondaria delle proteine:
α elica
stabilizzata da legami idrogeno
L’atomo di ossigeno del legame peptidico di ogni
aminoacido forma legame idrogeno con l’idrogeno del
legame peptidico del quarto aminoacido successivo
PROLINA & GLICINA:
residui incompatibili con la struttura
dell’α-elica
Dove c’è una prolina c’è un ripiegamento
Struttura secondaria delle proteine:
Stabilizzato tramite legami idrogeno
tra segmenti adiacenti della catena
polipeptidica
Foglietto β
Struttura secondaria delle proteine:
Foglietto β
Ripiegamenti β
Collegano le estremità di
due segmenti adiacenti
con strutture ad α elica
oppure a foglietto β